Что такое оксид кальция
Оксид кальция
Оксид кальция (е529) – пищевая добавка группы эмульгаторов.
Характеристика

Получение оксида кальция
Получают добавку несколькими способами. Распространено получение оксида кальция при термическом разложении карбоната кальция, известняка, а также при термическом разложении гидроксида кальция и кальциевых солей кислородсодержащих кислот.
Применение оксида кальция
Свойства оксида кальция позволяют применять его в качестве реагента и наполнителя. Используют его в кожевной промышленности, для нейтрализации избыточной кислоты, в нефтеперерабатывающей промышленности при производстве присадок к маслам (сульфатным, фенатным, алкилсалицилатным). В химической промышленности свойства оксида кальция применяют при производстве стеарата кальция.
Добавку е529 в пищевой промышленности применяют в производстве хлебобулочных изделий в качестве улучшителя муки и хлеба (количество добавки регламентировано технологическими инструкциями). Оксид кальция является одним из ингредиентов в комплексных хлебопекарных улучшителях. Для дрожжей добавка является питательной средой. В пищевых хлебопекарных и кондитерских продуктах е529 поддерживает определенный уровень кислотности.
Кроме того, е529 применяют в сахарной промышленности в качестве флокулянта, сорбента, осветляющего и фильтрующего материала. Применяют е529 при производстве пищевых масел в качестве катализатора гидрогенизации. При помощи оксида кальция обрабатывают воду, используемую для производства алкогольных напитков.

Добавляют е529 при изготовлении различных сухих смесей для отделочных работ, а также при производстве эбонита. Часто оксид кальция добавляют в смеси, помогающие в борьбе с вредителями различных сельскохозяйственных культур.
Влияние на организм человека
При работе с оксидом кальция необходимо соблюдать меры безопасности (носить очки и защитные перчатки). В случае попадания химического соединения на кожу или в организм человека возможны следующие последствия: стекловидный отек глаз, краснота глаз, химический ожог, трудно заживающие раны на коже, ожог пищевода или желудка. Возможно возникновение конъюнктивита и дерматита.
В продуктах питания е529 не оказывает негативного влияния на здоровье человека. Установлены четкие нормы, контролирующие количество добавки е529 в продуктах питания, которые гарантируют ее безопасность для человека.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Оксид кальция: способы получения и химические свойства
Оксид кальция CaO — бинарное неорганическое вещество . Белый, гигроскопичный. Тугоплавкий, термически устойчивый, летучий при очень высоких температурах. Проявляет основные свойства.
Относительная молекулярная масса Mr = 56,08; относительная плотность для тв. и ж. состояния d = 3,35; tпл ≈ 2614º C; tкип = 2850º C.
Способ получения
1. Оксид кальция получается при разложении карбоната кальция при температуре 900 — 1200º C. В результате разложения образуется оксид кальция и углекислый газ:
2. В результате взаимодействия гидрида кальция и кислорода при температуре 300 — 400º С образуется оксид кальция и вода:
3. Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
2Ca + O2 = 2CaO
Химические свойства
1. Оксид кальция реагирует с простыми веществами :
Оксид кальция реагирует с углеродом (коксом) при температуре 1900 — 1950º С и образует угарный газ и карбид кальция:
CaO + 3C = CaC2 + CO
2. Оксид кальция взаимодействует со сложными веществами:
2.1. Оксид кальция взаимодействует с кислотами:
2.1.1. О ксид кальция с разбавленной соляной кислотой образует хлорид кальция и воду:
CaO + 2HCl = CaCl2 + H2O
2.1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
CaO + 2HF = CaF2↓ + H2O
2.1.3. Оксид кальция вступает в реакцию с разбавленной фосфорной кислотой, образуя фосфат кальция и воду:
2.2. Оксид кальция реагирует с оксидами:
2.2.1. Оксид кальция при комнатной температуре реагирует с углекислым газом с образованием карбоната кальция:
CaO + CO2 = CaCO3
2.2.2. Взаимодействуя с оксидом кремния при 1100 — 1200º С оксид кальция образует силикат кальция:
CaO + SiO2 = CaSiO3
2.3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция:
Оксид кальция. Свойства и меры предосторожности
Оксид кальция — неорганическое соединение с 
Негашеная известь называется так для отличия от гашеной извести, когда при соединении оксида кальция с водой проходит бурная реакция — известь «гасится» водой. Получается гашеная известь Ca(OH)2, востребованная во многих областях.
Жженой известью реактив называют с отсылкой на способ получения: известь (карбонат кальция CaCO3) обжигают до тех пор, пока она не начинает разлагаться, в результате чего получается жженая известь (окись кальция).
Обычно негашеной или жженой известью называют техническую квалификацию реактива.
Получить окись кальция можно разными методами.
• Промышленный способ описан выше: разложением известняка CaCO3 при нагревании.
• Разложением при нагревании гидроокиси кальция или солей кальция (солей определенных кислот, содержащих кислород). Например, разложением нитрита кальция Ca(NO3)2 получают CaO высокой чистоты.
• Прямым окислением (сжиганием) кальция в воздухе.
 |  |  |
| Полнолицевая маска «ЗМ» серии 6900 | Кальций окись «ч» | Перчатки «Неотоп» химостойкие (Ansell) (9,5-10) |
Свойства
Реагент представляет собой порошкообразное вещество белого или сероватого цвета без запаха. Структура кристаллов подобна структуре поваренной соли. Реактив гигроскопичен, поглощает из воздуха влагу и углекислый газ. Хорошо растворяется в глицерине, не растворяется в этиловом спирте. В воде не растворяется, а вступает с ней в химическую реакцию. Не горит. Токсичен.
С химической точки зрения очень активное соединение, осно́вный оксид. Реагирует с водой с образованием щелочи Ca(OH)2 и выделением большого количества тепла. В реакции с кислотами и кислотными оксидами образует соли. Взаимодействует с углеродом (получается карбид CaC2). Вступает в реакцию с метиловым спиртом, оксидами металлов, с металлами, с хлором, бромом и другими галогенами, углекислым газом, серой, фосфором, кремнием и многими другими веществами.
Меры предосторожности
Негашеная известь — едкое вещество, которое относится ко 2-му (высокоопасному) классу веществ. Особенно опасно смешивать оксид с водой. Во-первых, можно обжечься; во-вторых, образующаяся щелочь разъедает кожу. Но даже без воды оксид действует на кожу как щелочь: вытягивает влагу из кожи, разрушает белки, омыляет жиры, вызывает химический ожог.
Опасность представляют известковая пыль, ее пары и аэрозольные частицы. Они попадают в органы дыхания, вызывая раздражение и кашель. При попадании в легкие могут вызвать пневмонию. Проглатывание оксида кальция вызывает ожог пищевода и желудка.
Очень опасен реактив для слизистых носа и особенно глаз. Способен вызвать язвы слизистой носа и даже прободение носовой перегородки.
Пострадавшему от контакта с химикатом обязательно следует вызвать скорую помощь. До приезда скорой нужно хорошо промыть место поражения: кожу, глаза, пищевод.
При работе с оксидом кальция (как на производствах, так и в быту) следует использовать защитную одежду; респиратор; очки; перчатки, стойкие к щелочам. На предприятиях обязательно контролируют ПДК реактива в воздухе. Рабочее место должно располагаться в помещении с общей принудительной вентиляцией. Места высокого риска пыления дополнительно снабжаются локальной вытяжной вентиляцией.
Хранят реактив в герметичной упаковке 
В лабораториях работы следует проводить в вытяжном шкафу. Хранят реактив в герметичных стеклянных или пластиковых сосудах с обязательными предупреждающими этикетками.
кальция оксид
КАЛЬЦИЯ ОКСИД CaO
бесцветные кристаллы с кубич. решеткой (а = 0,4812 нм, z = 4, пространственная группа Fm3m); т. пл. 2627 °C, т. кип. 2850 °C; плотн. 3,37 г/см 3 ; С°з 42,05 Дж/(моль∙К); ΔH 0 обр −635,09 кДж/моль, ΔH 0 пл 52 кДж/моль; S 0 298 38,10 Дж/(моль∙К). Техн. продукт наз. негашеной известью. Энергично взаимод. с водой, образуя гидроксид Ca (OH)2 ( техн. продукт — гашеная известь, пушонка), метанолом (при 80 °C) и глицерином (при 100 °C). При нагр. реагирует с SiO2, Al2O3, Fe2O3 и др. оксидами. С кислотами образует соли. Восстанавливается до металла натрием, К, Mg, Al и др. при высокой температуре. С Cl2 и Br2 образует соотв. CaCl2 и СаBr2. При нагр. реагирует также с S, Р, С и др. элементами. К. о. получают обжигом известняка при 900–1000 °C, особо чистый — разложением Ca(NO3)2. Применяют для получения вяжущих материалов, хлорной извести, соды, гидроксида, карбида и др. соед. Са; в качестве флюса в металлургии; как катализатор в орг. синтезе. Гидроксид Ca(OH)2 — бесцветные кристаллы с гексагон. решеткой (а = 0,35853 нм, с = 0,4895 нм, z = 1, пространственная группа 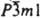
Лит.: Рипан Р., Четяну И., Неорганическая химия, пер. с рум., т. 1, М., 1971. с. 202–05.
Кальция оксид
Кальция оксид
| Оксид кальция | |
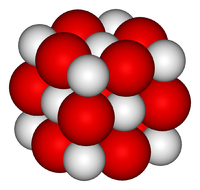 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид кальция |
| Химическая формула | CaO |
| Молярная масса | 56.077 г/моль |
| Физические свойства | |
| Плотность вещества | 3.37 г/см³ |
| Состояние (ст. усл.) | твердое |
| Термические свойства | |
| Температура плавления | 2627 °C |
| Температура кипения | 2850 °C |
| Молярная теплоёмкость (ст. усл.) | 42.05 Дж/(моль·К) |
| Энтальпия (ст. усл.) | -635,09 кДж/моль |
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ:
И при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Химические свойства
Оксид кальция относится к основным оксидам. Растворяется в воде с выделением энергии, образуя гидроксид кальция:
Как основной оксид реагирует с кислотными оксидами и кислотами, образуя соли:
Применение
Полезное
Смотреть что такое «Кальция оксид» в других словарях:
КАЛЬЦИЯ ОКСИД — СаО, бесцветные кристаллы. Технический продукт (известь негашеная) порошкообразный. Энергично реагирует с водой с выделением большого количества тепла (процесс гашения): СаО + Н2О = Са(ОН)2. Применяют в строительстве, в химической промышленности … Большой Энциклопедический словарь
кальция оксид — CaO, бесцветные кристаллы. Технический продукт (известь негашёная) порошкообразный. Энергично реагирует с водой с выделением большого количества тепла (процесс гашения): СаО+Н2О=Ca(ОН)2. Применяют в строительстве, в химической промышленности,… … Энциклопедический словарь
кальция оксид — kalcio oksidas statusas T sritis chemija formulė CaO atitikmenys: angl. burnt lime; calcium oxide; calx; caustic lime; lime; quicklime rus. жженая известь; кальция оксид; негашеная известь; обожженная известь ryšiai: sinonimas – degtos kalkės… … Chemijos terminų aiškinamasis žodynas
КАЛЬЦИЯ ОКСИД — СаО, бесцв. кристаллы с кубич. решеткой ( а =0,4812 нм, z = 4, пространств. группа Fm3m); т. пл. 2627 °С, т. кип. 2850 °С; плотн. 3,37 г/см 3; С° з 42,05 Дж/(моль. К); DH0 обр 635,09 кДж/моль, DH0 пл 52 кДж/моль; S0298 38,10 Дж/(моль … Химическая энциклопедия
КАЛЬЦИЯ ОКСИД — СаО, бесцв. кристаллы. Техн. продукт (известь негашёная) порошкообразный. Энергично реагирует с водой с выделением большого кол ва теплоты (процесс гашения): СаО+ Н2О = Са(ОН)2. Применяют в стр ве, в хим. пром сти, металлургии, с. х ве, при… … Естествознание. Энциклопедический словарь
Оксид кальция — Общие … Википедия
Оксид кальция(II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Оксид кальция (II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Кальция окись — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
КАЛЬЦИЯ ГИДРОКСИД — см. Кальция оксид, Известь … Химическая энциклопедия