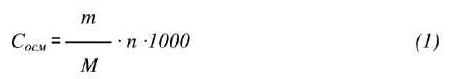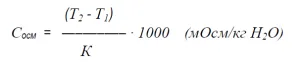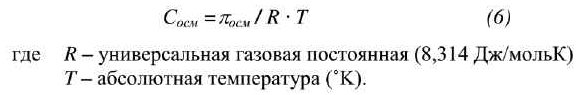Что такое осмолярность раствора
Нарушения метаболизма. Биохимия специализированных тканей. (Для клин.ордов КЛД)
Вода и электролиты
Растворителем, в котором работают почти все известные живые системы, служит окись водорода, или вода (H 2O). В молекуле воды атом кислорода соединен с двумя атомами водорода одинарными ковалентными связями.
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Электроотрицательность — сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Это понятие ввел Лайнус Полинг (Linus Carl Pauling). Самый электроотрицательный элемент — фтор, за ним на шкале электроотрицательности следует кислород. Иными словами, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора (который в биологической химии практически не встречается). Запомним этот факт.
Электроотрицательность одинаковых атомов по определению равна. Если между двумя одинаковыми атомами есть ковалентная связь, то образующие ее электроны никуда не смещены (в рамках старинной планетарной модели атома можно сказать, что они находятся точно посредине между атомами, как на картинке). Такая ковалентная связь называется неполярной.
Если ковалентную связь образуют два разных атома, то общие электроны смещаются к тому из них, у которого выше электроотрицательность. Такая связь называется полярной. При очень большой разнице в электроотрицательности она может даже стать ионной — это случится, если один атом полностью “отберет” у другого общую пару электронов.
Связь между водородом и кислородом в молекуле воды — типичный пример ковалентной полярной связи. Электроотрицательность кислорода намного выше, поэтому общие электроны смещены к нему. В результате на кислороде возникает маленький отрицательный заряд, а на водороде маленький положительный; эти заряды принято обозначать буквой δ (“дельта”).
Связи кислорода с водородом или углеродом (H-O или C-O) — всегда полярные. Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде. В то же время связь между углеродом и водородом (C-H) считается неполярной: разница в электроотрицательности между этими элементами так мала, что смещение электронов незаметно. Например, молекулы углеводородов в силу этого полностью неполярны, они не несут никаких частичных зарядов ни на каких атомах.
При наличии полярных связей между водородом и кислородом частичные заряды на этих атомах (отрицательные на кислороде и положительные на водороде) притягиваются друг к другу, образуя водородные связи. Эти связи гораздо слабее ковалентных, но могут давать сильный эффект, если их много. Например, именно из-за колоссального количества водородных связей у воды очень высокая теплоемкость — ее трудно нагреть и трудно остудить. Строго говоря, водородная связь может образоваться не только с кислородом, но и с другими электроотрицательными атомами (например, с азотом или фтором).
Любые заряженные частицы в водном растворе гидратируются, то есть окружаются молекулами воды — конечно, по-разному ориентированными в зависимости от того, положительная это частица или отрицательная. Любые ионы, растворенные в воде, на самом деле присутствуют там в гидратированном состоянии, то есть с водной оболочкой. На картинке для примера показана растворенная поваренная соль (NaCl) — образец чисто ионного вещества.
Полярные молекулы (а тем более ионы) хорошо взаимодействуют с водой, образуя с ней водородные связи и (или) подвергаясь гидратации. Такие вещества хорошо растворяются в воде и называются гидрофильными. Неполярные молекулы взаимодействуют с водой гораздо слабее, чем друг с другом. Такие вещества плохо растворяются в воде и называются гидрофобными. Типичные гидрофобные вещества — углеводороды. Типичные гидрофильные вещества — спирты, такие как этанол или показанный на картинке глицерин. Вообще кислородсодержащие соединения углерода, как правило, гидрофильны, если только в них нет совсем уж огромных углеводородных радикалов.
Могут ли подойти для жизни другие растворители, кроме воды? Ответ — да. Например, двуокись углерода (CO 2) при более высоких давлениях, чем наше атмосферное, становится жидкостью и представляет собой хороший гидрофильный растворитель, в котором успешно идут многие биохимические реакции. В этом растворителе могут жить даже земные микроорганизмы: например, на дне Окинавского желоба в Восточно-Китайском море обнаружено целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии (Inagaki et al., 2006).
Некоторые исследователи предполагают, что океаны жидкой двуокиси углерода могут существовать на планетах-“суперземлях” с массой, в несколько раз превосходящей массу Земли (Budisa, Schulze-Makuch, 2014). На картинке — художественное изображение планеты GJ1214b в созвездии Змееносца.
На крупнейшем спутнике Сатурна — Титане — есть углеводородные озера и даже моря, состоящие из метана (CH 4), этана (C 2H 6) и пропана (C 3H 8). Это гидрофобный растворитель, в котором тоже иногда предполагают существование жизни, хотя прямых подтверждений тому пока нет. На картине — пейзаж Титана. Жидкой воды на поверхности Титана нет, там слишком холодно.
Аммиак (NH 3) — гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом, и напоминающий воду по физико-химическим свойствам. На более холодных планетах, чем Земля, аммиак находится в жидком состоянии и вполне может быть средой для жизни.
Теоретически возможно существование холодных землеподобных планет с аммиачными океанами (на картинке художественное изображение такой планеты). Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть сомнения, то углеродную жизнь в неводном растворителе представить гораздо легче.
Можно придумать и другие экзотические варианты — например, океан из плавиковой кислоты (HF) на планете, описанной в фантастической повести Ивана Ефремова “Сердце Змеи”. “Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…” Возвращаясь к земной биохимии, будем помнить, что она — не единственная теоретически возможная.
ОФС.1.2.1.0003.15 Осмолярность
Содержимое (Table of Contents)
ОФС.1.2.1.0003.15 Осмолярность
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ГФ XII, ч. 1, ОФС 42-0047-07
Осмолярность – это характеристика растворов, выражающая их осмотическое давление через суммарную концентрацию кинетически активных частиц в единице объема раствора (мОсм/л).
Существующие инструментальные методы позволяют определять не осмолярность, а осмоляльность – концентрацию кинетически активных частиц на килограмм растворителя (мОсм/кг).
Кинетически активные частицы – это молекулы, ионы или ионные комплексы одного или нескольких растворенных веществ, свободно распределенные во всем объеме растворителя и обладающие способностью к хаотическому перемещению внутри раствора.
Осмолярность и осмоляльность характеризуют создаваемое растворами осмотическое давление.
Осмолярность является одной из важнейших характеристик инфузионных растворов. На этикетках растворов для инфузий должно быть указано теоретическое значение их осмолярности. В случае, когда теоретическая осмолярность не может быть рассчитана, указывают среднее значение осмоляльности для данного лекарственного средства.
Теоретическая осмолярность может быть рассчитана по формуле:
Сосм – осмолярность раствора, миллиосмоль на литр (мОсм/л);
m – содержание вещества в растворе, г/л;
M – молярная масса вещества, г;
n – суммарное число ионов, образующихся из одной молекулы растворенного вещества в результате диссоциации (n = 1 для недиссоциирующих веществ, n = 2, 3 для веществ, образующих при растворении соответствующее количество ионов).
На практике, количество частиц (n) несколько меньше теоретически рассчитанного и приближенно может быть описано формулой:

n — реальное количество частиц, образующихся при растворении данного вещества;
nо — теоретически рассчитанное количество частиц (n=1,2,3…);

Коэффициент 
Растворы, равные по осмолярности 0,9 % раствору натрия хлорида, называют изотоническими. Для изотонических растворов теоретически рассчитанные значения осмолярности находятся в пределах 239 – 376 мОсм/л.
Осмолярность растворов, состоящих из нескольких компонентов, может быть определена как сумма осмолярностей всех компонентов.
Концентрацию инфузионных растворов принято выражать как массо-объемную (в г/л), поэтому удобным представляется рассчитывать содержание кинетически активных частиц в миллиосмолях на литр (осмолярность), а не на килограмм (осмоляльность) раствора.
Различиями между значениями осмолярности и осмоляльности растворов с осмолярностью, близкой к осмолярности 0,7-1,1 % раствора натрия хлорида или ниже, можно пренебречь (теоретическое значение осмотического давления 0,9 % раствора натрия хлорида – 308 мОсм/л; экспериментальное значение – 286 мОсм/л); для более концентрированных растворов (например, 10 % раствора натрия хлорида) осмолярность может быть определена по формуле:
С(мОсм/л) = С(мОсм/кг) ∙ ρ (3)
где: ρ – плотность раствора, кг/л.
Примечания. 1. Расчет теоретических границ осмолярности проводят следующим образом: минимальное значение – осмолярность раствора, содержащего минимально допустимые количества ингредиентов; максимальное значение – осмолярность раствора, содержащего максимально допустимые количества ингредиентов.
Определение осмоляльности водных растворов
Для определения осмоляльности могут быть использованы следующие методы: криоскопический, мембранная и паровая осмометрия.
Криоскопический метод
Метод основан на понижении точки замерзания растворов по сравнению с точкой замерзания чистого растворителя.
1 осмоль на килограмм воды понижает точку замерзания на 1,86 °С. Измерение этих изменений лежит в основе криоскопического метода.
Данная зависимость может быть выражена следующей формулой:
Сосм — осмоляльность раствора (мОсм/кг)
Т2 — температура замерзания чистого растворителя (˚С);
Т1 — температура замерзания испытуемого раствора (˚С);
К — криометрическая постоянная растворителя (для воды: 1,86).
В настоящее время определение осмоляльности растворов проводится с использованием автоматических криоскопических осмометров.
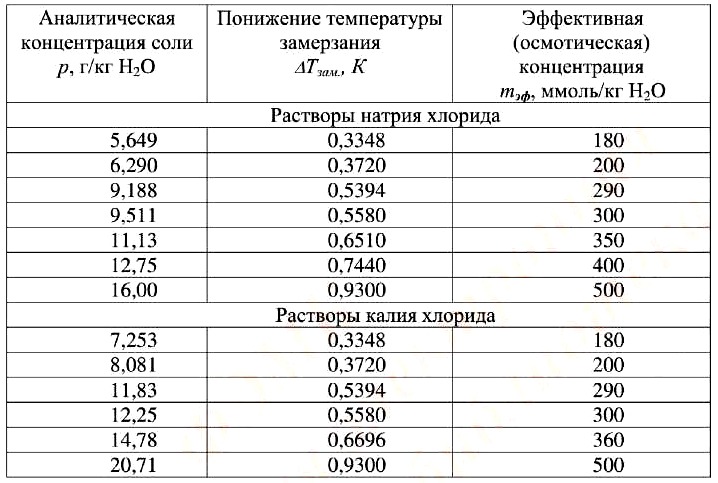
Необходимое количество испытуемого раствора помещают в ячейку прибора. Далее проводят измерение согласно инструкции, прилагаемой к прибору. При необходимости прибор калибруют с помощью стандартных растворов натрия или калия хлорида, которые перекрывают определяемый диапазон осмоляльности (таблица 1).
Таблица 1 – Стандартные справочные значения понижения температуры замерзания и эффективности осмотической концентрации водных растворов натрия и калия хлоридов
| Аналитическая концентрация соли р, г/кг Н2O | Понижение температуры замерзания DТзам., К | Эффективная (осмотическая) концентрация mэф, ммоль/кг Н2O |
| Растворы натрия хлорида | ||
| 5,649 | 0,3348 | 180 |
| 6,290 | 0,3720 | 200 |
| 9,188 | 0,5394 | 290 |
| 9,511 | 0,5580 | 300 |
| 11,13 | 0,6510 | 350 |
| 12,75 | 0,7440 | 400 |
| 16,00 | 0,9300 | 500 |
| Растворы калия хлорида | ||
| 7,253 | 0,3348 | 180 |
| 8,081 | 0,3720 | 200 |
| 11,83 | 0,5394 | 290 |
| 12,25 | 0,5580 | 300 |
| 14,78 | 0,6696 | 360 |
| 20,71 | 0,9300 | 500 |
Метод мембранной осмометрии
Метод основан на использовании свойства полупроницаемых мембран избирательно пропускать молекулы веществ.
Движущей силой процесса является процесс осмоса. Растворитель проникает в испытуемый раствор до установления равновесия; возникающее при этом дополнительное гидростатическое давление приближенно равно осмотическому давлению и может быть рассчитано по формуле:

Осмоляльность может быть рассчитана по формуле:
где R – универсальная газовая постоянная (8,314 Дж/мольК)
T – абсолютная температура (˚K).
Примечание. Данный метод применим только для растворов высокомолекулярных веществ (10 4 – 10 6 г/моль). При анализе растворов, содержащих электролиты и другие низкомолекулярные вещества, будет определяться только осмотическое давление, создаваемое высокомолекулярными компонентами раствора.
Определение осмоляльности испытуемого раствора проводят с помощью мембранного осмометра. Предварительную калибровку прибора и измерения проводят в соответствии с инструкцией к прибору.
Метод паровой осмометрии
1 осмоль на килограмм воды понижает давление пара на 0,3 мм рт. ст. при температуре 25 °С. Измерение этих изменений лежит в основе метода паровой осмометрии.
Метод основан на измерении разности температур, которая возникает на термисторах, помещенных в измерительную ячейку, насыщенную парами растворителя в случае, если на один из них нанесена капля чистого растворителя, а на другой — испытуемого раствора. Разница температур возникает по причине конденсации паров растворителя на капле раствора, так как давление пара растворителя над этой поверхностью меньше. При этом температура капли раствора повышается за счет экзотермического процесса конденсации до тех пор, пока давление пара над каплей раствора и давление чистого растворителя в ячейке не сравняются. При нанесении на оба термистора чистого растворителя разность температур равна нулю. Разность температур практически пропорциональна моляльной концентрации раствора.
Определение осмоляльности испытуемого раствора проводят с помощью парового осмометра. Предварительную калибровку прибора и измерения проводят в соответствии с инструкцией к прибору.
Что такое осмолярность раствора
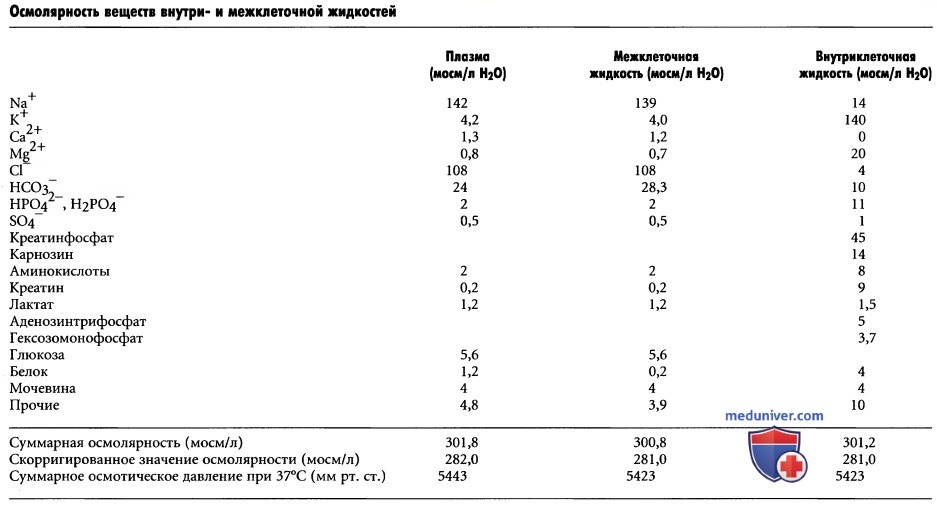
Осмотическое давление раствора прямо пропорционально концентрации растворенных в нем частиц. Это справедливо для растворенных веществ как с большим, так и малым размером молекул. Например, одна молекула альбумина с молекулярной массой 70000 создает такой же осмотический эффект, как одна молекула глюкозы, молекулярная масса которой равна 180. Одна молекула NaCl, однако, обладает двумя осмотически активными частицами: ионами Na+ и Cl-, осмотический эффект которых (по сравнению с альбумином или глюкозой) в 2 раза выше, поэтому осмотическое давление раствора пропорционально его осмолярности — мере концентрации растворенных частиц.
В соответствии с правилом Вант-Гоффа осмотическое давление (π) можно рассчитать по формуле: π = CRT, где С — концентрация растворенного вещества в осмолях на литр, R — универсальная газовая постоянная и Т — температура в градусах по Кельвину (273° + температура по Цельсию). Если π выражается в общепринятых для биологических жидкостей единицах — миллиметрах ртутного столба, Т соответствует нормальной температуре тела (273° + 37° = 310° по Кельвину), рассчитанное значение π для раствора 1 осм/л составит 19300 мм рт. ст. Это значит, что для концентрации 1 мосм/л π равно 19,3 мм рт. ст. Таким образом, каждый миллиосмоль трансмембранного градиента концентрации создает осмотическое давление 19,3 мм рт. ст.
а) Расчет осмолярности и осмотического давления раствора. Предполагая, что мембрана непроницаема для растворенного вещества, можно рассчитать возможное осмотическое давление раствора, используя правило Вант-Гоффа. Например, осмотическое давление 0,9% раствора NaCl рассчитывают следующим образом: 0,9% означает, что 100 мл раствора содержит 0,9 г NaCl, или 9 г/л. Поскольку молекулярная масса NaCl составляет 58,5 г/моль, молярность раствора составит: 9 г/л разделить на 58,5 г/моль, или 0,154 моль/л. Поскольку каждая молекула NaCl эквивалентна 2 осмолям, осмолярность раствора составит: 0,154×2, или 308 мосм/л. Следовательно, осмолярность раствора равна 308 мосм/л. Возможное осмотическое давление раствора составит: 308 мосм/л х 19,3 мм рт. ст., или 5944 мм рт. ст.
Данный расчет является приблизительным, поскольку в растворе вследствие сил межионного взаимодействия между ионами Na+ и Сl- нет полной независимости. Теоретически рассчитанное с помощью правила Вант-Гоффа значение следует скорректировать с учетом поправки, носящей название осмотического коэффициента. Для NaCl он равен 0,93. Следовательно, реальное значение осмолярности 0,9% раствора NaCI составит 308×0,93, или 286 мосм/л. На практике при определении осмолярности и осмотического давления растворов, используемых для инфузий, поправкой на осмотический коэффициент иногда пренебрегают.
б) Осмолярность жидких сред организма. В таблице выше, обратим внимание на приблизительные значения осмолярности различных веществ, растворенных в плазме, межклеточной и внутриклеточной жидкостях. Отметим, что около 80% всей осмолярности межклеточной жидкости обусловлены ионами Na+ и Cl-, тогда как во внутриклеточной жидкости почти половина осмолярности создается ионами К+, а оставшаяся часть распределена между ионами других веществ.
Как видно из таблицы выше, суммарная осмолярность каждой из трех основных жидкостей организма составляет около 300 мосм/л. По сравнению с межклеточной и внутриклеточной жидкостями осмолярность плазмы на 1 мосм/л выше. Это небольшое различие обусловлено белками, которые поддерживают в просвете капилляров более высокое давление (выше на 20 мм рт. ст.), чем в окружающей межклеточной жидкости.
в) Скорригированное значение осмолярности жидких сред организма. В нижней строке таблицы выше приведено скорригированное значение осмолярности плазмы, межклеточной и внутриклеточной жидкостей. Причиной введения поправок являются силы притяжения и отталкивания между ионами или молекулами в растворе, которые вызывают, соответственно, небольшое увеличение или небольшое снижение осмотической «активности» растворенного вещества.
г) Суммарное осмотическое давление жидких сред организма. В таблице выше также приведены суммарные значения осмотического давления различных жидкостей, измеренные по разные стороны мембраны, при этом одна ее сторона погружалась в дистиллированную воду. Отметим, что суммарное давление в плазме равно произведению скорригированной осмолярности плазмы (282 мосм/л) на коэффициент 19,3. В итоге получим 5443 мм рт. ст.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Осмолярность (ОФС.1.2.1.0003.15). Методика определения
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Осмолярность (ОФС.1.2.1.0003.15)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ГФ XII, ч. 1, ОФС 42-0047-07
Осмолярность – это характеристика растворов, выражающая их осмотическое давление через суммарную концентрацию кинетически активных частиц в единице объема раствора (мОсм/л).
Существующие инструментальные методы позволяют определять не осмолярность, а осмоляльность – концентрацию кинетически активных частиц на килограмм растворителя (мОсм/кг).
Кинетически активные частицы – это молекулы, ионы или ионные комплексы одного или нескольких растворенных веществ, свободно распределенные во всем объеме растворителя и обладающие способностью к хаотическому перемещению внутри раствора.
Осмолярность и осмоляльность характеризуют создаваемое растворами осмотическое давление.
Осмолярность является одной из важнейших характеристик инфузионных растворов. На этикетках растворов для инфузий должно быть указано теоретическое значение их осмолярности. В случае, когда теоретическая осмолярность не может быть рассчитана, указывают среднее значение осмоляльности для данного лекарственного средства.
Теоретическая осмолярность может быть рассчитана по формуле:
Сосм – осмолярность раствора, миллиосмоль на литр (мОсм/л);
m – содержание вещества в растворе, г/л;
M – молярная масса вещества, г;
n – суммарное число ионов, образующихся из одной молекулы растворенного вещества в результате диссоциации (n = 1 для недиссоциирующих веществ, n = 2, 3 для веществ, образующих при растворении соответствующее количество ионов).
На практике, количество частиц (n) несколько меньше теоретически рассчитанного и приближенно может быть описано формулой:
n — реальное количество частиц, образующихся при растворении данного вещества;
nо — теоретически рассчитанное количество частиц (n=1,2,3…);
φ— молярный осмотический коэффициент, учитывающий взаимодействие между частицами в растворе и зависящий только от количества растворенного вещества.
Коэффициент φ определяется экспериментально.
Растворы, равные по осмолярности 0,9 % раствору натрия хлорида, называют изотоническими. Для изотонических растворов теоретически рассчитанные значения осмолярности находятся в пределах 239 – 376 мОсм/л.
Осмолярность растворов, состоящих из нескольких компонентов, может быть определена как сумма осмолярностей всех компонентов.
Концентрацию инфузионных растворов принято выражать как массо-объемную (в г/л), поэтому удобным представляется рассчитывать содержание кинетически активных частиц в миллиосмолях на литр (осмолярность), а не на килограмм (осмоляльность) раствора.
Различиями между значениями осмолярности и осмоляльности растворов с осмолярностью, близкой к осмолярности 0,7-1,1 % раствора натрия хлорида или ниже, можно пренебречь (теоретическое значение осмотического давления 0,9 % раствора натрия хлорида – 308 мОсм/л; экспериментальное значение – 286 мОсм/л); для более концентрированных растворов (например, 10 % раствора натрия хлорида) осмолярность может быть определена по формуле:
С(мОсм/л) = С(мОсм/кг) ∙ ρ (3)
где: ρ – плотность раствора, кг/л.
Примечания.
Определение осмоляльности водных растворов
Для определения осмоляльности могут быть использованы следующие методы: криоскопический, мембранная и паровая осмометрия.
Криоскопический метод
Метод основан на понижении точки замерзания растворов по сравнению с точкой замерзания чистого растворителя.
1 осмоль на килограмм воды понижает точку замерзания на 1,86 °С. Измерение этих изменений лежит в основе криоскопического метода.
Данная зависимость может быть выражена следующей формулой:
Сосм — осмоляльность раствора (мОсм/кг)
Т2 — температура замерзания чистого растворителя (˚С);
Т1 — температура замерзания испытуемого раствора (˚С);
К — криометрическая постоянная растворителя (для воды: 1,86).
В настоящее время определение осмоляльности растворов проводится с использованием автоматических криоскопических осмометров.
Необходимое количество испытуемого раствора помещают в ячейку прибора. Далее проводят измерение согласно инструкции, прилагаемой к прибору. При необходимости прибор калибруют с помощью стандартных растворов натрия или калия хлорида, которые перекрывают определяемый диапазон осмоляльности (таблица 1).
Таблица 1. Стандартные справочные значения понижения температуры замерзания и эффективности осмотической концентрации водных растворов натрия и калия хлоридов
Метод мембранной осмометрии
Метод основан на использовании свойства полупроницаемых мембран избирательно пропускать молекулы веществ.
Движущей силой процесса является процесс осмоса. Растворитель проникает в испытуемый раствор до установления равновесия; возникающее при этом дополнительное гидростатическое давление приближенно равно осмотическому давлению и может быть рассчитано по формуле:
Осмоляльность может быть рассчитана по формуле:
Примечание. Данный метод применим только для растворов высокомолекулярных веществ (10 4 – 10 6 г/моль). При анализе растворов, содержащих электролиты и другие низкомолекулярные вещества, будет определяться только осмотическое давление, создаваемое высокомолекулярными компонентами раствора.
Определение осмоляльности испытуемого раствора проводят с помощью мембранного осмометра. Предварительную калибровку прибора и измерения проводят в соответствии с инструкцией к прибору.
Метод паровой осмометрии
1 осмоль на килограмм воды понижает давление пара на 0,3 мм рт. ст. при температуре 25 °С. Измерение этих изменений лежит в основе метода паровой осмометрии.
Метод основан на измерении разности температур, которая возникает на термисторах, помещенных в измерительную ячейку, насыщенную парами растворителя в случае, если на один из них нанесена капля чистого растворителя, а на другой — испытуемого раствора. Разница температур возникает по причине конденсации паров растворителя на капле раствора, так как давление пара растворителя над этой поверхностью меньше. При этом температура капли раствора повышается за счет экзотермического процесса конденсации до тех пор, пока давление пара над каплей раствора и давление чистого растворителя в ячейке не сравняются. При нанесении на оба термистора чистого растворителя разность температур равна нулю. Разность температур практически пропорциональна моляльной концентрации раствора.
Определение осмоляльности испытуемого раствора проводят с помощью парового осмометра. Предварительную калибровку прибора и измерения проводят в соответствии с инструкцией к прибору.