Что такое рост и дифференцировка клеток
Что такое рост и дифференцировка клеток
Синтетическая деятельность клеток проявляется в изменении их величины. При усилении синтеза наблюдается увеличение клеточных размеров и, наоборот, при снижении синтетической активности может происходить их уменьшение. Все клетки в той или иной степени способны к росту. Однако их рост ограничен определенными рамками. Некоторые клетки, например яйцевые, благодаря накоплению в них желтка, могут достигать огромной величины. Значительно превышают обычные размеры гигантские клетки, образующиеся особенно часто в опухолевых тканях. Вместе с тем, для клеток некоторых типов (например, для клеток крови) характерна стабильность средних размеров.
Обычно клеточный рост сопровождается преимущественным увеличением объема цитоплазмы, тогда как величина ядра изменяется в меньшей степени. На протяжении онтогенеза строение клеток непрерывно изменяется. Прогрессирующие изменения клеток, связанные с появлением морфологических и функциональных различий между ранее индифферентными (однородными) клетками и обусловленные их специализацией в процессе развития, называют диф-ференцировкой клеток. Биохимической основой этого процесса является синтез специфических белков и других веществ. Молекулярные основы синтеза белков складываются из транскрипции первичной структуры матричной РНК на основе информации ДНК-гена, кодирующей области генов — экзонные области; процессинга мРНК, в результате которого из новообразованной цепи удаляются несмысловые последовательности нуклеотидов (интроны), перехода новообразованной мРНК в цитоплазму и трансляции — синтеза белка на аппарате синтеза белков клетки.
Дифференцировка сопровождается качественными, количественными и временными параметрами, т. е. характеризуется изменениями клеточной структуры, темпом развития (ускоренная или замедленная) и степенью (малодифференцированные — высокодифференцированные клетки). Усложнение структуры клетки сопровождается следующими изменениями: приобретением определенной формы и размеров ядра и клетки; сдвигом ядерно-цитоплазменного отношения в связи с более значительным ростом цитоплазмы по сравнению с ядром; развитием орга-нелл; образованием специализированных клеточных структур; синтезом специфических включений; образованием межклеточного вещества; появлением межклеточных взаимодействий и установлением межклеточных и специализированных контактов. Так, эпителиальные клетки приобретают кубическую, призматическую или плоскую форму. Клетки тканей внутренней среды более разнообразны по форме.
Некоторые соединительнотканные клетки вырабатывают межклеточное вещество. Мышечные клетки содержат миофибриллы. Между нейронами формируются синаптические контакты (подробно — см. соответствующие главы).
Для разных тканевых клеток характерны определенные взаимоотношения между процессами дифференцировки и деления. Однако в целом по мере повышения степени дифференцировки способность клеток к делению закономерно уменьшается.
В гистогенезе клетки определенного цитотипа интегрируются, частично теряя автономность, присущую ранней стадии (пролиферативной), вследствие формирования регуляторных механизмов, оказывающих влияние на цитодифференцировку.
Клетки в составе тканей многоклеточных организмов имеют различную продолжительность жизни. В некоторых тканях, например в эпителиях, смена клеточного состава происходит довольно быстро. По данным ряда исследователей, жизнь эпителиальных клеток (в частности, в кишечном эпителии) измеряется несколькими сутками. В других тканях (например, в мышечной и нервной) продолжительность жизни клеток сравнима с продолжительностью жизни организма. Так или иначе, клеточный состав организма не остается постоянным, он непрерывно изменяется в результате гибели части клеток и замены их новыми клеточными поколениями. В нормальных физиологических условиях гибели клеток предшествуют процессы старения. Они сопровождаются снижением функциональной активности, а также появлением ряда дистрофических изменений. В общих чертах гибель клеток характеризуется сморщиванием ядра и клетки в целом, диффузной окрашиваемостью и исчезновением специализированных структур, распадом клетки на фрагменты, которые фагоцитируются соседними клетками или макрофагами.
7 основных причин старения
Старение есть сумма всех механизмов, которые изменяют функции живого существа, препятствуют поддержанию физиологического баланса и в конечном итоге приводят к смерти. Процесс старения это процесс сложный, постепенный, зависящий от многих биологических факторов. Ученые всегда проявляли особый интерес к старению и поиску подходов к изучению этого феномена.
Исследования показали, что старение контролируется генетическими факторами и биологическими процессами, присущими человечеству.
Чтобы замедлить этот естественный процесс и увеличить продолжительности жизни, первым шагом является понимание причин старения: как оно действует на живые организмы, и какие факторы влияют на продолжительность жизни.
Существует 7 основных причин: повреждение генома, эпигенетические факторы, укорочение теломер, развернутая реакция белка, дисфункция митохондрий, клеточное старение и истощение стволовых клеток.
Ошибки репарации ДНК
Геном — это сумма генетической информации человека или вида. Геном является картой для построения всего организма. Генетическая информация, в основном, хранится в ядре клетки в виде молекул ДНК. Участок ДНК, задающий последовательность определённого полипептида, либо функциональной РНК, представляет ген. Геном человека содержит от 25 000 до 30 000 генов.
Но молекулы ДНК не лежат в свободном виде в ядре клетки, они упакованы вместе с белками-гистонами в хромосомы. Хромосомы содержат всю генетическую информацию и реплицируются с каждым клеточным делением.
На протяжении всей жизни клетки делятся множество раз, в результате генетический материал постоянно воспроизводится в живых системах и передается вновь созданным дочерним клеткам. Во время клеточного деления довольно часто наблюдаются генетические ошибки, которые образуются во время репликации ДНК. Они называются ошибками репликации ДНК. Ошибки репликации приводят к нарушению функционирования клетки и могут повлиять на оставшуюся ткань, если клетка не будет устранена в результате запуска апоптоза (гибели клеток) или старения (ухудшения функций клетки).
В организме также существует система, которая восстанавливает молекулу ДНК, модифицированную во время репликации. Система использует белки и ферменты. PARP1 — участвует в репарации ДНК и сиртуинов, а также в регуляции экпрессии генов, ремоделировании хроматина и функционировании митохондрий. NAD+ является косубстратом PARP. С возрастом происходит увеличение экспрессии белков PARP, что говорит о частых ошибках репликации и необходимости их устранения. В ответ на повреждения ДНК из-за работы PARP в клетке также очень быстро истощаются запасы NAD+, что приводит к клеточной гибели.
Активация фермента PARP может индуцировать сверхэкспрессию белка P53. Белок Р53 представляет другую систему контроля жизненного цикла клетки. Р53 отвечает за элиминацию канцерогенных клеток и позволяет продлить жизнь органов, предотвращая развитие раковых клеток. Однако, чем больше белка активируется, тем больше он ускоряет процесс старения, приводя к усиленному разрушению клеток и потери гомогенности тканей.
Механизм укорочения теломерных повторов
Способность диплоидных клеток к пролиферации ограничена. Этот процесс регулируется теломерами. Теломеры оказывают защитное действие на ДНК. Теломеры являются той частью хромосомы, которая не содержит генетической информации, и разрушаются на протяжении всей жизни при каждой репликации до тех пор пока полностью не исчезнут. Поскольку ДНК больше не защищена, при репликации важная информация «разжевывается», что приводит к апоптозу клетки или созданию раковой клетки. Фермент теломераза обеспечивает полную репликацию теломер. Он обнаружен только в стволовых, эмбриональных и раковых клетках. Присутствие этого фермента в раковых клетках объясняет, почему они бессмертны: они могут делиться бесконечно, не останавливаясь на своих «биологических часах». Работа этого фермента представляет большой научный интерес, однако, его активация может быть связана с виндукцией злокачественной трансформации.
Сокращение теломер можно сравнить с биологическими часами, которые активируют старение клеток, как только время истекает. Этот механизм ограничивает продолжительность жизни всех клеток, поэтому является центральным.
Эпигенетические механизмы и старение
Эпигенетика занимается изучением механизмов, управляющих экспрессией генома. Экспрессия генов может варьировать в зависимости от факторов окружающей среды. Органы демонстрируют эту изменчивость: каждая клетка имеет сходную генетическую информацию, но разные функции, что показывает разницу в экспрессии генов в зависимости от окружающей среды.
Белки представлены полипептидной цепью, состоящей из последовательности аминокислот. Работают белки благодаря своей конформационной структуре: вторичной, третичной, четвертичной. Складывание белка представляет физический процесс-фолдинг, посредством которого белок становится функционально активным.
Исследования показали, что нарушение процесса фолдинга белка составляет патофизиологическую основу многих возрастных заболеваний различной этиологии, в том числе болезни Альцгеймера, болезнь Паркинсона и прочих.
Последствия нарушения конформационных структур связаны с накоплением агрегатов белков неправильной конформации.
Митохондриальная дисфункция и возраст
Митохондрии — это клеточные органеллы, ответственные за поддержание клеточного дыхания и синтез АТФ — основного источника энергии. Митохондрии обладают собственной ДНК, называемой мтДНК.
Дисфункция митохондрии является основной причиной старения из-за жизненно важной роли митохондрий в клетках. Возрастная дисфункция наблюдается с возрастом, может привести к гибели клетки. Ее причиной служит окислительный стресс, нарушение клеточно-митохондриальной связи.
Клеточное старение происходит, когда возраст клетки увеличивается и ее функция уменьшается. Клетка прекращает делиться и меняет свою активность. Стареющие клетки можно увидеть на всех этапах жизни. С возрастом их число увеличивается в некоторых тканях, вызывая их гетерогенность.
Механизм клеточного старения полезен в молодости. Он защищает организм от пролиферации раковых клеток, но требует эффективной работы иммунной системы для устранения стареющих клеток. При старении эффективность иммунной системы снижается, обновления стволовых клеток происходит реже.
Стволовые клетки — это недифференцированные клетки, которые не принадлежат к какому-либо конкретному органу и поэтому могут генерировать специализированные клетки посредством «клеточной дифференцировки».
Стволовые клетки позволяют обновлять клетки в органе, они хранятся в организме и используются при необходимости.
Некоторые клетки стареют и умирают регулярно и требуют замены. Срок жизни эритроцита в среднем 120 дней. Другие органы могут расти и требовать больше ткани (например, матка во время беременности). Некоторые органы не имеют стволовых клеток и поэтому не могут быть обновлены при повреждении, например, сердце, поджелудочная железа.
При старении ткани также не восстанавливаются из-за замедления деления клеток и отсутствия замены стволовых клеток. Это объясняется избыточной экспрессией белков, блокирующих клеточный цикл, или накоплением повреждений ДНК на стволовых клетках.
Истощение стволовых клеток является одной из основных причин старения, поскольку препятствует обновлению клеток и является причиной старения органов. Понимание работы стволовых клеток будет жизненно важным для регенеративной медицины в будущем.
Вышеуказанные причины потенциально ответственны за изменение функций организма. Некоторые из них лежат в основе полезных механизмов, которые становятся вредными с возрастом, как в случае с клеточным старением и системой репарации ДНК. Механизмы предотвращают развитие рака, но по мере того, как их активность становится слишком высокой, происходит сбой, дегенерация тела ускоряется.
Другими причинами являются простые механизмы, которые медленно развиваются во времени (митохондриальная дисфункция, укорочение теломер). Необходимо понимать их, если мы когда-нибудь захотим поработать над этим, чтобы потенциально замедлить старение, и увеличить продолжительность жизни человека.
Публикации в СМИ
Лейкоз острый
Острый лейкоз — злокачественное заболевание кроветворной системы; морфологический субстрат — бластные клетки.
Частота. 13,2 случаев на 100 000 населения среди мужчин и 7,7 случаев на 100 000 населения среди женщин.
КЛАССИФИКАЦИЯ
FAB классификация (франко американо британская) основана на морфологии лейкемических клеток (строение ядра, соотношение размеров ядра и цитоплазмы) • Острый миелобластный (нелимфобластный) лейкоз (ОМЛ) •• М0 — без созревания клеток, миелогенная дифференцировка доказывается только иммунологически •• М1 — без созревания клеток •• М2 — ОМЛ с дифференцировкой клеток, •• М3 — промиелоцитарный •• М4 — миеломоноцитарный •• М5 — монобластный лейкоз •• М6 — эритролейкоз •• М7 — мегакариобластный лейкоз • Острый лимфобластный лейкоз (ОЛЛ): •• L1 — без дифференцировки клеток (морфологически гомогенные клетки) •• L2 — с дифференцировкой клеток (морфологически гетерогенная популяция клеток) •• L3 — беркеттоподобные лейкозы • Недифференцируемый лейкоз — к этой категории относят лейкозы, клетки которых невозможно идентифицировать как миелобластные или лимфобластные (ни химическими, ни иммунологическими методами) • Миелопоэтическая дисплазия •• Рефрактерная анемия без бластоза (в костном мозге бласты и промиелоциты
Код вставки на сайт
Лейкоз острый
Острый лейкоз — злокачественное заболевание кроветворной системы; морфологический субстрат — бластные клетки.
Частота. 13,2 случаев на 100 000 населения среди мужчин и 7,7 случаев на 100 000 населения среди женщин.
КЛАССИФИКАЦИЯ
FAB классификация (франко американо британская) основана на морфологии лейкемических клеток (строение ядра, соотношение размеров ядра и цитоплазмы) • Острый миелобластный (нелимфобластный) лейкоз (ОМЛ) •• М0 — без созревания клеток, миелогенная дифференцировка доказывается только иммунологически •• М1 — без созревания клеток •• М2 — ОМЛ с дифференцировкой клеток, •• М3 — промиелоцитарный •• М4 — миеломоноцитарный •• М5 — монобластный лейкоз •• М6 — эритролейкоз •• М7 — мегакариобластный лейкоз • Острый лимфобластный лейкоз (ОЛЛ): •• L1 — без дифференцировки клеток (морфологически гомогенные клетки) •• L2 — с дифференцировкой клеток (морфологически гетерогенная популяция клеток) •• L3 — беркеттоподобные лейкозы • Недифференцируемый лейкоз — к этой категории относят лейкозы, клетки которых невозможно идентифицировать как миелобластные или лимфобластные (ни химическими, ни иммунологическими методами) • Миелопоэтическая дисплазия •• Рефрактерная анемия без бластоза (в костном мозге бласты и промиелоциты Copy
Гормоны в организме человека. За что они отвечают
Гормоны – биологически активные вещества, вырабатывающиеся клетками эндокринных желез (желез внутренней секреции). Оттуда они поступают в кровь и с кровотоком попадают в клетки и ткани-мишени.
Там они связываются со специфическими рецепторами и таким образом регулируют обмен веществ и множество физиологических функций. Так, они отвечают:
Как работает эндокринная система
Разные внешние или внутренние раздражители действуют на чувствительные рецепторы. В результате формируются импульсы, которые действуют на гипоталамус (отдел головного мозга). В ответ на них в гипоталамусе вырабатываются биоактивные вещества, поступающие по локальным сосудам в другой отдел головного мозга – гипофиз.
В ответ на их поступление в гипофизе вырабатываются гормоны гипофиза. Они попадают в кровь и, достигнув с кровотоком конкретной эндокринной железы, стимулируют в ней синтез того или иного гормона. А затем уже этот гормон поступает с кровью к гормональным рецепторам органов-мишеней, как описано выше.
По химическому строению гормоны делят на 4 вида
Стероиды – производные холестерина. Вырабатываются в коре надпочечников (кортикоиды) и половых железах (андрогены, эстрогены). В эту же группу входит кальцитриол.
Производные жирных кислот– эйкозаноиды. К ним относятся простагландины – повышают чувствительность рецепторов к боли и воспалительным процессам, тромбоксаны – участвуют в процессах свертывания крови, лейкотриены – участвуют в патогенезе бронхоспазма.
Производные аминокислот, преимущественно тирозина – гормон стресса адреналин, предшественник адреналина норадреналин и гормоны щитовидной железы.
Белково-пептидные соединения – гормоны поджелудочной железы инсулин и глюкагон, а также гормон роста соматотропин и кортикотропин – стимулятор синтеза гормонов коры надпочечников. В эту же группу входит антидиуретический гормон вазопрессин, «гормон материнства» окситоцин и ТТГ и АКТГ.
По месту образования выделяют гормоны:
По механизму действия различают гормоны:
По биологическим функциям различают гормоны, регулирующие:
Функции основных гормонов в организме
Список по названиям
Тестостерон — вырабатывается и у мужчин, и у женщин. Отвечает:
Эстрогены – женские половые гормоны. Отвечают за формирование первичных половых признаков у женщин. Обеспечивают репродуктивные функции и эмоциональное состояние. У мужчин вырабатываются в жировой ткани живота из тестостерона. Стимулируют синтез коллагена и обеспечивают эластичность кожи. Принимают участие в работе кровеносной системы.
Прогестерон – сохраняет беременность и обеспечивает менструальный цикл у женщин. Кроме этого, и у женщин, и у мужчин он:
Дигидроэпиандростерон – вырабатывается в головном мозге и надпочечниках.
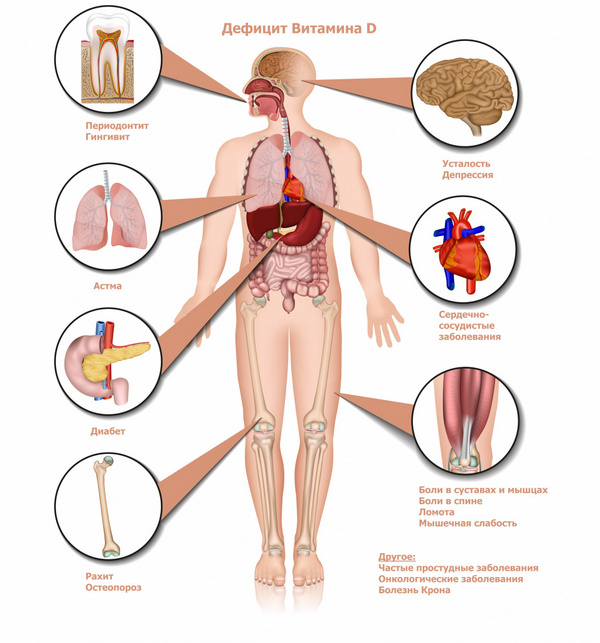
Д-гормон (так называемый витамин Д):
ТТГ — тиреотропный гормон гипофиза. Регулирует выработку гормонов щитовидной железы трийодтиронина Т3 и тироксина Т4. При дисбалансе гормонов щитовидной желез развиваются гипер- и гипотиреоз.
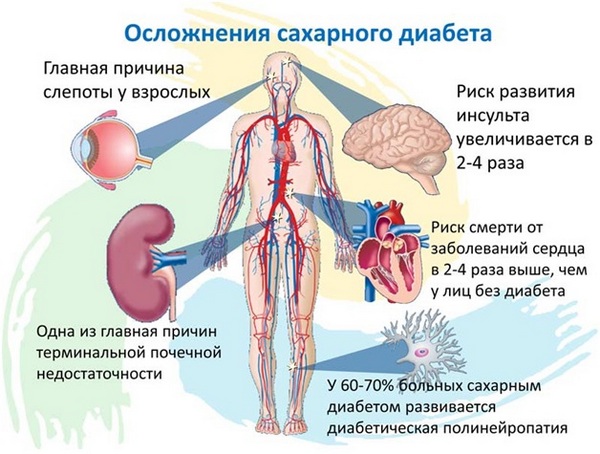
Инсулин – отвечает за усвоение глюкозы клетками. Стимулирует мышечный рост и аппетит. При нехватке инсулина развивается сахарный диабет. Избыток инсулина приводит к инсулинорезистентности (снижение чувствительности инсулинозависимых клеток к действию инсулина с последующим нарушением метаболизма глюкозы и поступления ее в клетки), что ведет к ожирению и развитию сахарного диабета 2 типа.
Дигидротестостерон – влияет на рост волос, образование акне, увеличение простаты у мужчин.
Кортизол – образуется из прогестерона. Адаптирует организм к влиянию стресса, защищает от воспалений, аллергических реакций, поддерживает в норме артериальное давление.
Альдостерон – гормон коры надпочечников; образуется из прогестерона. Отвечает за обмен солей и воды в организме.
СТП (соматотропный гормон) – гормон роста, избыток которого ведет к развитию акромегалии.
В каких случаях нужно сдавать анализы на гормоны
Если баланс эндокринной системы нарушается, в организме развиваются изменения. Нередко достаточно предельно малых отклонений от нормы, чтобы запустить патологический процесс.
Достаточно долго такие патпроцессы могут протекать бессимптомно. Когда же появляется симптоматика, то нередко патогенез уже необратим. Чтобы выявлять бессимптомные гормональные нарушения на ранних стадиях современная доказательная медицина настоятельно рекомендует пакетные проверки. Один раз в 6-12 месяцев достаточно сдать кровь на анализ, чтобы оценить состояние эндокринной системы и не допустить развития гормональных заболеваний.
Кроме этого, о необходимости сдать анализ на гормоны может свидетельствовать ряд признаков:
Также обязательно контролировать уровень гормонов при беременности, чтобы не допустить аномалий развития плода.
При планировании беременности необходимо пройти обследование щитовидной железы: сделать УЗИ щитовидной железы, пройти исследования гормонов ТТГ, Т4 свободный (свободный тироксин) и АТ к ТПО (антитела к тиреопероксидазе)
Во время беременности, если есть нарушение функций щитовидной железы, необходимо 1 раз в триместр проводить скрининг гормона ТТГ и консультироваться у эндокринолога.