Что такое ртуть в физике
РТУТЬ
В хим. соединениях проявляет степени окисления +1 и +2. Химически малоактивна, 203 Hg( 
Лит.: Пугачевич П. П., Работа со ртутью в лабораторных и производственныхусловиях, М., 1972. С. С. Бердоносов.
Полезное
Смотреть что такое «РТУТЬ» в других словарях:
ртуть — ртуть, и … Русский орфографический словарь
ртуть — ртуть/ … Морфемно-орфографический словарь
ртуть — и; ж. Химический элемент (Hg), жидкий тяжёлый металл серебристо белого цвета (широко применяется в химии и электротехнике). Живой, как ртуть. (очень подвижный). ◊ Гремучая ртуть Взрывчатое вещество в виде белого или серого порошка. * * * ртуть… … Энциклопедический словарь
РТУТЬ — РТУТЬ, Hydrargyrum (от греч. hydor вода и argyros серебро), Mercurium, Hydrargyrum VІvum, s. metallicum, Mercurius VІvus, Argentum VІvum, серебристо белый жидкий металл, симв. Hg, ат. в. 200,61; уд. в. 13,573; ат. объем 15,4; t° замерз.… … Большая медицинская энциклопедия
РТУТЬ — см. РТУТЬ (Hg) содержится в сточных водах химических заводов по производству красок, хлора и каустической соды, фармацевтических препаратов, взрывчатых веществ, приборостроительных и электротехнических предприятий, горнодобывающих и целлюлозно… … Болезни рыб: Справочник
Ртуть — является единственным металлом, который при комнатной температуре находится в жидком состоянии. Ее получают путем обжига природного сульфида ртути (киновари) и отделяют от других металлов, содержащихся в руде (свинец, цинк, олово, висмут), путем… … Официальная терминология
РТУТЬ — (символ Hg), жидкий металлический химический элемент, известный с давних времен. Основной рудой ртути является киноварь (сульфид), из которого ртуть получается посредством обжига. Этот серебристый элемент является единственным металлом, имеющим… … Научно-технический энциклопедический словарь
РТУТЬ — (лат. Hydrargyrum) Hg, химический элемент II группы периодической системы, атомный номер 80, атомная масса 200,59. Серебристый жидкий металл (отсюда латинское название; от греч. hydor вода и argyros серебро). Плотность 13,5 г/м² (тяжелее всех … Большой Энциклопедический словарь
ртуть — живой металл, меркурий, сулема, гигрол, ступпа, каломель, (гремучее, живое) серебро Словарь русских синонимов. ртуть живое (или гремучее) серебро (устар.); Меркурий (устар. книжн.) Словарь синонимов русского языка. Практический справочник. М.:… … Словарь синонимов
РТУТЬ — (Hydrargyrum), Hg, химический элемент II группы периодической системы, атомный номер 80, атомная масса 200,59; единственный из металлов жидкий при комнатной температуре, температура плавления 38,87 шC, температура кипения 356,58 шC, очень летуча … Современная энциклопедия
Ртуть — Hg (лат. hydrargyrum, от греч. hydor вода и argyros серебро * a. mercury; н. Quecksilber; ф. mercure; и. mercurio), хим. элемент II группы периодич. системы Менделеева, ат. н. 80, ат. м. 200,59. В природе 7 стабильных изотопов: 196Нg… … Геологическая энциклопедия
Ртуть
(молярная масса)
(первый электрон)
Содержание
История
Ртуть известна с древних времён. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом природной киновари. Древние греки и римляне использовали ртуть для очистки золота (амальгамирование), знали о токсичности самой ртути и её соединений, в частности сулемы. Много веков алхимики считали ртуть главной составной частью всех металлов и полагали, что если жидкой ртути возвратить твёрдость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 году. Для представления элемента как у алхимиков, так и в настоящее время используется символ планеты Меркурий. Но принадлежность ртути к металлам была доказана только трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства в твёрдом состоянии: ковкость, электропроводность и др.
Происхождение названия
Нахождение в природе
Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В обычных условиях киноварь и металлическая ртуть не растворимы в воде, но в присутствии некоторых веществ (Fe2(SO4)3, озон, пероксид водорода) растворимость в воде этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах щелочных металлов с образованием, например, комплекса HgS•nNa2S. Ртуть легко сорбируется глинами, гидроксидами железа и марганца, глинистыми сланцами и углями.
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg4Cl.
Месторождения
Ртуть считается редким металлом.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен), Донбассе (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
В окружающей среде
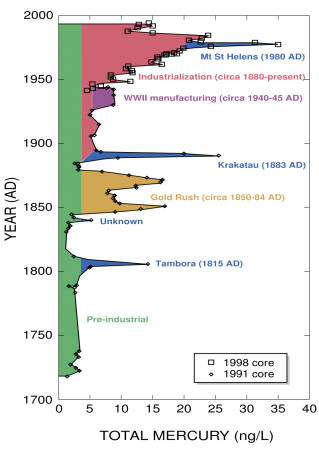
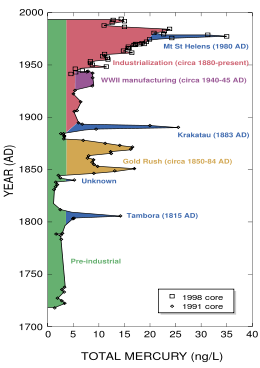
До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограммов на 1 кубический дециметр льда. Природные источники, такие, как вулканы, составляют примерно половину всех выбросов атмосферной ртути. Причиной появления остальной половины является деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля (главным образом в тепловых электростанциях) — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6,8 %, производство цемента — 6,4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1,4 %, ртути (в основном для батареек) — 1,1 %, остальное — 2 %.
Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
Изотопы
Природная ртуть состоит из смеси 7 стабильных изотопов: 196 Hg (распространённость 0,155 %), 198 Hg (10,04 %), 199 Hg (16,94 %), 200 Hg (23,14 %), 201 Hg (13,17 %), 202 Hg (29,74 %), 204 Hg (6,82 %). Искусственным путём получены радиоактивные изотопы ртути с массовыми числами 171—210.
Получение
Ртуть получают обжигом киновари (сульфида ртути II) или металлотермическим методом:
HgS + O2 ⟶ Hg + SO2↑ HgS + Fe ⟶ FeS↓ + Hg
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
На протяжении многих столетий в Европе основным и единственным месторождением ртути был Альмаден в Испании. В Новое время с ним стала конкурировать Идрия во владениях Габсбургов (современная Словения). Там же появилась первая лечебница для поражённых отравлением парами ртути рудокопов. В 2012 г. ЮНЕСКО объявило промышленную инфраструктуру Альмадена и Идрии памятником Всемирного наследия человечества.
В надписях во дворце древнеперсидских царей Ахеменидов (VI—IV века до н. э.) в Сузах упоминается, что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в качестве краски.
Ртуть
Ртуть (лат. hydrargyrum ) — химический элемент II группы дополнительной подгруппы периодической системы элементов Менделева с атомным номером 80 и атомной массой 200,59, обозначается символом Hg. Простое вещество при комнатной температуре представляет собой тяжёлую серебристо-белую заметно летучую жидкость, пары которой чрезвычайно ядовиты. Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии. В природе находится как в самородном виде, так и образует ряд минералов. Чаще всего ртуть получают путём восстановления из её наиболее распространённого минерала — киновари. Применятся для изготовления измерительных приборов, вакуумных насосов, источников света и в других областях науки и техники.
| Ртуть / Hydrargyrum (Hg) | |
|---|---|
| Атомный номер | 80 |
| Внешний вид | тяжёлая жидкость серебристо-белого цвета |
| Свойства атома | |
| Атомная масса (молярная масса) | 200,59 а. е. м. (г/моль) |
| Радиус атома | 157 пм |
| Энергия ионизации (первый электрон) | 1 006,0 (10,43) кДж/моль (эВ) |
| Электронная конфигурация | [Xe] 4f 14 5d 10 6s 2 |
| Химические свойства | |
| Ковалентный радиус | 149 пм |
| Радиус иона | (+2e) 110 (+1e) 127 пм |
| Электроотрицательность (по Полингу) | 2,00 |
| Электродный потенциал | Hg←Hg 2+ 0,854 В |
| Степени окисления | 2, 1 |
| Термодинамические свойства | |
| Плотность | 13,546 (@ +20 °C) г/см³ |
| Удельная теплоёмкость | 0,138 Дж/(K·моль) |
| Теплопроводность | 8,3 Вт/(м·K) |
| Температура плавления | 234,28 K |
| Теплота плавления | 2,295 кДж/моль |
| Температура кипения | 629,73 K |
| Теплота испарения | 58,5 кДж/моль |
| Молярный объём | 14,8 см³/моль |
| Кристаллическая решётка | |
| Структура решётки | ромбоэдрическая |
| Период решётки | 2,990 Å |
| Отношение c/a | n/a |
| Температура Дебая | 100,00 K |
Содержание
История
Происхождение названия
Русское название ртути, по одной из версий, — это заимствование из арабского (через тюркские языки); по другой версии, «ртуть» связана с литовским ritu — качу, катаю, происшедшим от индоевропейского рет (х) — бежать, катиться. Литва и Русь были тесно связаны, а во 2-й половине XIV века русский язык был языком делопроизводства Великого Княжества Литовского, а также языком первых письменных памятников Литвы.
Латинское hydrargirum произошло от греческих слов hýdor — вода и árgyros — серебро. «Жидким» (или живым, быстрым) серебром ртуть называется также в немецком (Quecksilber) и в староанглийском (quicksilver) языках, а по-болгарски ртуть — живак: действительно, шарики ртути блестят, как серебро, и очень быстро «бегают» — как живые.
Соединения ртути
Ртуть и её соединения применяются в технике, химической промышленности, медицине. Жёлтый оксид ртути(II) входит в состав глазной мази и мазей для лечения кожных заболеваний. Красный оксид ртути(II) применяется для получения красок. Хлорид ртути(I), который называется каломель, используется в пиротехнике, а также в качестве фунгицида. В ряде стран каломель используется в качестве слабительного. Токсическое действие каломели проявляется особенно тогда, когда после приема её внутрь не наступает слабительное действие и организм долгое время не освобождается от этого препарата.
Хлорид ртути(II), который называется сулема, является очень токсичным. Сулема применялась в медицине как дезинфицирующее средство, в технике она используется для обработки дерева, получения некоторых видов чернил, травления и чернения стали. В сельском хозяйстве сулема применяется как фунгицид.
Амидохлорид ртути (белый преципитат ртути) входит в состав некоторых мазей. В ветеринарии амидохлорид ртути применяется как средство против паразитарных заболеваний кожи.
Нитрат ртути(II) применяется для отделки меха и получения других соединений этого металла. Токсичность нитрата ртути(II) примерно такая же, как и токсичность сулемы. Многие органические соединения ртути используются в качестве пестицидов и средств для обработки семян. Отдельные органические соединения ртути применяются как диуретические средства.
Получение
В России известны 23 месторождения ртути, промышленные запасы составляют 15,6 тыс.тонн (на 2002 год).
Физические свойства
Ртуть — единственный металл, жидкий при комнатной температуре. Ртуть не обладает магнитными свойствами.
Химические свойства
Ртуть — малоактивный металл (см. ряд напряжений ).
Применение
Сплав ртути с таллием используется для низкотемпературных термометров.
Ртуть используется для переработки вторичного алюминия и добычи золота (см. Амальгамная металлургия ).
Ртуть входит в состав некоторых биоцидных красок для предотвращения обрастания корпуса судов в морской воде.
Также используются и соли ртути:
Биологическая роль
Ртуть
Ртуть / Hydrargyrum (Hg), 80
[Xe] 4f 14 5d 10 6s 2
Ртуть — элемент побочной подгруппы второй группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80. Обозначается символом Hg (лат. Hydrargyrum ). Простое вещество ртуть (CAS-номер: 7439-97-6) — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты. Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй элемент — бром).
Содержание
История
Ртуть известна с древних времен. Нередко ее находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом природной киновари. Древние греки и римляне использовали ртуть для очистки золота (амальгамирование), знали о токсичности самой ртути и ее соединений, в частности сулемы. Много веков алхимики считали ртуть главной составной частью всех металлов и полагали, что если жидкой ртути возвратить твердость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 г. Для представления элемента как у алхимиков, так и в нынешнее время используется символ планеты Меркурий.
Происхождение названия
Нахождение в природе
Ртуть — относительно редкий элемент в Земной коре со средней концентрацией 83 мг/т. Однако в виду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся прежде всего самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg4Cl.
Месторождения
Ртуть считается редким металлом.
Известны месторождения ртути в Закавказье (Дагестан, Армения), Таджикистане, Словении, Киргизии, Украине (Горловка, Никитовский ртутный комбинат).
В окружающей среде
До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограмма на литр льда. Природные источники, такие как вулканы, составляют примерно половину всех выбросов атмосферной ртути. За оставшуюся половину ответственна деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля главным образом в тепловых электростанциях — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6,8 %, производство цемента — 6,4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1,4 %, ртути (в основном для батареек) — 1,1 %, остальное — 2 %.
Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
Изотопы ртути
| Изотоп | 196 | 198 | 199 | 200 | 201 | 202 | 204 |
|---|---|---|---|---|---|---|---|
| Концентрация, (%) | 0,146 | 10,02 | 16,84 | 23,13 | 13,22 | 29,80 | 6,85 |
Получение
Ртуть получают обжигом киновари (cульфида ртути(II)): Уравнение реакции:
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
В России известны 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год).
Физические свойства
| Температура в °С | ρ, 10 3 кг/м 3 | Температура в °С | ρ, 10 3 кг/м 3 |
| 0 | 13,5951 | 50 | 13,4723 |
| 5 | 13,5827 | 55 | 13,4601 |
| 10 | 13,5704 | 60 | 13,4480 |
| 15 | 13,5580 | 65 | 13,4358 |
| 20 | 13,5457 | 70 | 13,4237 |
| 25 | 13,5335 | 75 | 13,4116 |
| 30 | 13,5212 | 80 | 13,3995 |
| 35 | 13,5090 | 90 | 13,3753 |
| 40 | 13,4967 | 100 | 13,3514 |
| 45 | 13,4845 | 300 | 12,875 |
Химические свойства
Характерные степени окисления
| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
|---|---|---|---|---|
| +1 | Не получен | * | Слабоосновный | Склонность к диспропорционированию |
| +2 | HgO | ** | Очень слабое основание, иногда — амфотерный |
‘*Гидроксид не получен, существуют только соответствующие соли
‘**Гидроксид существует только в очень разбавленных ( −4 моль/л) растворах.
Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть представляет собой двухъядерный катион Hg2 2+ со связью металл-металл. Ртуть — один из немногих металлов, способных формировать такие катионы, и у ртути они — самые устойчивые.
В степени окисления +1 ртуть склонна к диспропорционированию. Оно протекает при нагревании:
добавлении лигандов, стабилизирующих степень окисления ртути +2.
Из-за диспропорционирования ни оксид, ни гидроксид ртути (I) получить не удаётся.
На холоду ртуть +2 и металлическая ртуть, наоборот, конпропорционируют. Поэтому, в частности, при реакции нитрата ртути (II) со ртутью получается нитрат ртути (I):
В очень концентрированной щелочи оксид ртути частично растворяется с образованием гидроксокомплекса:
Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жесткими, так и мягкими по теории ЖМКО. С иодом (-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений.
Свойства простого вещества [8]
Ртуть — малоактивный металл (см. ряд напряжений). Она не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке:
Также с трудом растворяется в серной кислоте при нагревании, с образованием сульфата ртути:
При растворении избытка ртути в азотной кислоте на холоде образуется нитрат Hg2(NO3)2.
При нагревании до 300 °C ртуть вступает в реакцию с кислородом:
При этом образуется оксид ртути(II) красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ.

Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода.
При нагревании ртути с серой образуется сульфид ртути(II):
Ртуть также реагирует с галогенами (причём на холоду — медленно).
Ртуть можно окислить также щелочным раствором перманганата калия:
и различными хлорсодержащими отбеливателями. Эти реакции используют для удаления металлической ртути.
Применение
Применение ртути и её соединений
Медицина
Амальгаму серебра применяют в стоматологии в качестве материала зубных пломб.
Ртуть-203 (T1/2 = 53 сек) используется в радиофармакологии.
Техника
Металлургия
Химическая промышленность
Сельское хозяйство
Высокотоксичные соединения ртути, такие как хлорид ртути(I) (каломель), хлорид ртути (II) (сулема), мертиолят и другие используют для протравливания семенного зерна и в качестве пестицидов.
Токсикология ртути
Ядовиты только пары́ и растворимые соединения ртути. Металлическая ртуть не оказывает существенного воздействия на организм. Пары могут вызвать тяжёлое отравление. Ртуть и её соединения (сулема, каломель, цианид ртути) поражают нервную систему, печень, почки, желудочно-кишечный тракт, при вдыхании — дыхательные пути (а проникновение ртути в организм чаще происходит именно при вдыхании её паров, не имеющих запаха). По классу опасности ртуть относится к первому классу (чрезвычайно опасное химическое вещество). Опасный загрязнитель окружающей среды, особенно опасны выбросы в воду, поскольку в результате деятельности населяющих дно микроорганизмов происходит образование растворимой в воде и токсичной метилртути. Ртуть — типичный представитель кумулятивных ядов.
Гигиеническое нормирование концентраций ртути
Демеркуризация
Очистка помещений и предметов от загрязнений металлической ртутью и источников ртутных паров называется демеркуризацией. В быту широко применяется демеркуризация с помощью серы. Так, например, если разбился градусник, раньше предлагали тщательно собрать все шарики ртути медицинской клизмой в стеклянную банку с герметичной крышкой, а щели и неровности засыпать порошком серы (S). Сера вступает в химическую реакцию со ртутью при комнатной температуре, образуя нерастворимое и потому не ядовитое твердое вещество — сульфид ртути. Однако этот метод исключительно малоэффективен. Сера со ртутью легко реагирует только при тщательном растирании в ступке. Если насыпать на тяжелую ртуть легкий порошок серы, реакция практически не будет идти. Или пойдет чрезвычайно медленно. На самом деле следует тщательнейшим образом собрать все видимые (при ярком свете лампы!) капельки ртути в герметично закрывающуюся емкость. Для сбора крупных капель можно использовать пипетку с тонким носиком, а более мелкие капли нужно собрать амальгамированной (покрытой тончайшим слоем ртути) медной проволокой, которую нужно перед этим тщательно зачистить, чтобы ртуть смочила медь (лучше всего для этой цели подходит азотная кислота, в которую нужно на одну — две секунды опустить конец проволоки). Подойдет и оловянный припой. Налипшую ртуть следует стряхивать в ту же емкость, которую потом нужно сдать на утилизацию — туда же, куда сдают перегоревшие люминесцентные и энергосберегающие лампы, которые тоже содержат ртуть. Невидимые глазом, а также попавшие в щели капельки следует залить раствором хлорного железа FeCl3, который превратит ртуть в неиспаряющуюся и малоядовитую каломель Hg2Cl2. В крайнем случае следует залить это место раствором «марганцовки» или йодной настойкой. Пол на следующий день нужно тщательно вымыть. Ни в коем случае нельзя убирать частицы ртути при помощи пылесоса, так как это вызывает рассеивание на более мелкие частицы через выход воздуха из пылесоса, а это повлечет за собой увеличение концентрации паров ртути и усложнит процесс очистки помещений.