Что такое соли и какие они бывают
Что такое соли и какие они бывают
3. Взаимодействие с металлами CuSO4 + Fe = FeSO4 + Cu;
Но, если металл взаимодействует с водой, то CuCl 2 + 2К + 2 H 2 O = 2К Cl + Cu (ОН)2↓+ Н2↑;
Растворимые соли взаимодействуют с щелочами, если в результате образуется нерастворимое соединение
4. Взаимодействие с сильными и менее летучими кислотами:
Соли слабых кислот взаимодействуют с более сильными, менее летучими кислотами
5. Взаимодействие с солями
Растворимые соли взаимодействуют между собой, если образуется нерастворимая соль:
6. Нерастворимые соли и соли летучих кислот разлагаются при нагревании:
2 С u(NO3)2 = 2 CuO+ 4 NO2↑+ O2↑ (продукты разложения нитратов определяются активностью металла см. разложение нитратов)
2BaSO 4 → 2BaO + 2SO 2 + O 2
Под действием электрического тока соли в растворах и расплавах подвергаются разложению см. электролиз
В расплаве: 2 NaCl = 2 Na + Cl 2;
В растворе: 2 NaCl + 2 H 2 O = 2 Na ОН + Cl 2 ↑ + Н2↑
Металл с неметаллом : Fe + S = FeS (нагревание)
Металл с кислотой: Zn +2 HCl = Zn Cl 2 + H 2 ↑
Металл с солью: CuSO 4 + Fe = Fe SO 4 + Cu
Металл со щелочью: 2 NaOH + Zn = Na 2 ZnO 2 + H 2 ↑
Основные оксиды с кислотными и амфотерными оксидами:
Основные оксиды с кислотой: CaO + 2 HCl = CaCl 2 + H 2 O
Соль с неметаллом: KI + Cl 2 = KCl + I 2
Основание с кислотой: HCl + NaOH = NaCl + H 2 O – р-я нейтрализации
Кислоты с солями слабых и летучих кислот: BaCl 2 + Н2 SO 4 = BaSO 4 ↓+ 2Н Cl
Щелочи с растворимыми солями: 3 NaOH + FeCl 3 = Fe ( OH )3 ↓ + 3 NaCl
Растворимые соли друг с другом: BaCl 2 (р) + Na 2 SO 4 (р) = BaSO 4 ↓+ 2 NaCl
Соли с кислотными оксидами: Na 2 CO 3 + SiO 2 = Na 2 SiO 3 + CO 2
Кислотные оксиды со щелочами: SO 3 + 2 NaOH = Na 2 SO 4 + H 2 O ;
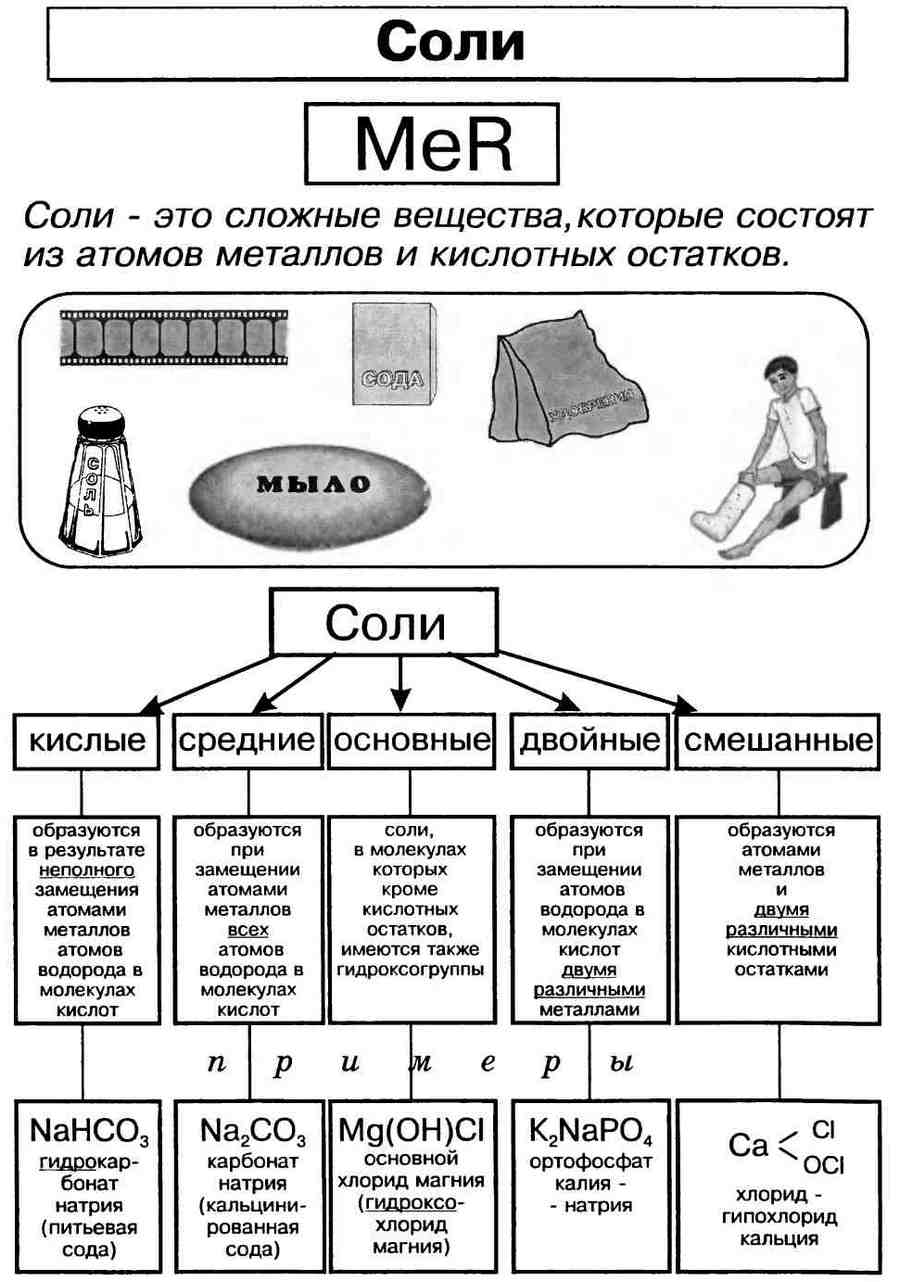
Соли: виды, свойства и применение
Соли — органические и неорганические химические вещества сложного состава. 
— состоящие из анионов и катионов;
— получаемые в результате взаимодействия кислот и оснований;
— состоящие из кислотных остатков и ионов металлов.
Кислотные остатки могут быть связаны не с атомами металлов, а с ионами аммония (NH4)+, фосфония (РН4)+, гидроксония (Н3О)+ и некоторыми другими.
Виды солей
— Кислотные, средние, оснóвные. Если в кислоте все протоны водорода заменены ионами металла, то такие соли называют средними, например, NaCl. Если водород замещен лишь частично, то такие соли — кислые, напр. KHSO4 и NaH2PO4. Если гидроксильные группы (OH)– основания замещены кислотным остатком не полностью, то тогда соль — оснóвная, напр. CuCl(OH), Аl(OH)SO4.

— Органические и неорганические.
— Комплексные соли с комплексным ионом: K2[BeF4], [Zn(NH3)4]Cl2 и другие.
— Кристаллогидраты и кристаллосольваты.
— Кристаллогидраты с молекулами кристаллизационной воды. CaSO4*2H2O.
— Кристаллосольваты с молекулами растворителя. Например, LiCl в жидком аммиаке NH3 дает сольват LiCl*5NH3.
— Кислородосодержащие и не содержащие кислород.
— Внутренние, иначе называемые биполярными ионами.
Свойства
Большинство солей — твердые вещества с высокой температурой плавления, не проводящие ток. Растворимость в воде — важная характеристика, на ее основании реактивы делят на водорастворимые, малорастворимые и не растворимые. Многие соли растворяются в органических растворителях.
Соли реагируют:
— с более активными металлами;
— с кислотами, основаниями, другими солями, если в ходе взаимодействия получаются вещества, в дальнейшей реакции не участвующие, например, газ, нерастворимый осадок, вода. Разлагаются при нагревании, гидролизируются в воде.
В природе соли широко распространены в виде минералов, рассолов, залежей солей. Их добывают также из морской воды, горных руд.
Соли необходимы человеческому организму. Соли железа нужны для пополнения гемоглобина, кальция — участвуют в образовании скелета, магния — регулируют деятельность желудочно-кишечного тракта.
Применение солей
Соли активно используются в производстве, быту, сельском хозяйстве, медицине, пищепроме, химическом синтезе и анализе, в лабораторной практике. Вот лишь некоторые сферы их применения:
— Нитраты натрия, калия, кальция и аммония (селитры); кальций фосфорнокислый, 
— Хлорид натрия необходим для получения пищевой поваренной соли, применяется в химпроме для производства хлора, соды, едкого натра.
— Гипохлорит натрия — популярный отбеливатель и средство для обеззараживания воды.
— Соли уксусной кислоты (ацетаты) используются в пищевой индустрии как консерванты (калий и кальций уксуснокислый); в медицине для изготовления лекарств, в косметической отрасли (натрий уксуснокислый), для многих других целей.
— Алюмокалиевые и хромокалиевые квасцы востребованы в медицине, пищепроме; для окрашивания тканей, кож, мехов.
— Многие соли используются в качестве фиксаналов для определения химического состава веществ, качества воды, уровня кислотности и пр.
В нашем магазине в широком ассортименте представлены соли, как органические так и неорганические.
Химические свойства и способы получения солей
Перед изучением этого раздела рекомендую прочитать следующую статью:
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Классификация солей
Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Ca + S → CaS
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
2NaOH + Cl2 0 = NaCl — + NaOCl + + H2O
6NaOH + Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
Химические свойства солей
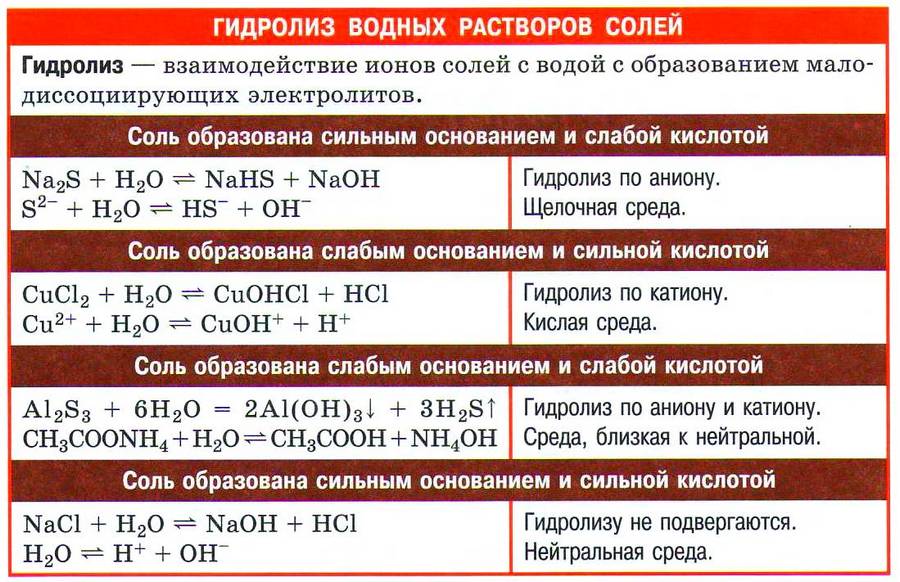
1. В водных растворах соли диссоциируют на катионы металлов Ме + и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
CaCl2 → Ca 2+ + 2Cl –
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
NaHCO3 → Na + + HCO3 –
HCO3 – → H + + CO3 2–
Основные соли также диссоциируют ступенчато.
CuOH + → Cu 2+ + OH –
Двойные соли диссоциируют в одну ступень.
Смешанные соли диссоциируют также одноступенчато.
CaCl(OCl) → Ca 2+ + Cl — + ClO –
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Хлорид аммония взаимодействует с гидроксидом натрия:
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Некоторые кислые соли могут реагировать со своими средними солями.
6. C оли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
7. Некоторые соли при нагревании разлагаются .
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
Что такое соли и какие они бывают
Генетические ряды металла и неметалла завершает класс солей:
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков. Сoли — это вещества немолекулярного строения. Химическая связь между катионами металлов и анионами кислотных остатков в солях ионная. Формулы солей составляют таким образом, чтобы суммарный заряд ионов металлов и соединенных с ними кислотных остатков был одинаков по величине и противоположен по знаку.
Соли — многочисленный класс соединений. Насколько это понятие применимо для органических соединений?
Лабораторный эксперимент.
Соберите прибор для получения газов и проверьте его герметичность. В пробирку налейте 3—4 мл соляной кислоты и опустите в неё 2—3 небольших кусочка мрамора. Закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку объёмом 20 мл с 5—6 мл известковой воды. Пропускайте через известковую воду полученный оксид углерода(IV). Что наблюдаете? Продолжайте пропускать углекислый газ до растворения осадка.
Полученную жёсткую воду разлейте в три пробирки.
К содержимому первой пробирки добавьте немного раствора мыла, закройте её пробкой и сильно встряхните. Что наблюдаете?
Вторую пробирку закрепите в пробиркодержателе и нагрейте до кипения. Прекратите нагревание и рассмотрите содержимое.
В третью пробирку добавьте раствор стиральной соды. Что наблюдаете?
При выполнении этого эксперимента были исследованы свойства солей двух типов: средних и кислых.
К первым относятся карбонат кальция СаСO3 (он составляет химическую основу мрамора), хлорид кальция СаСl2, карбонат натрия Na2CO3 (или стиральная сода) и стеарат натрия С17Н35СОONa (мыло).
Напомним, что мыла — это натриевые и калиевые соли жирных кислот: RCOONa — твёрдое мыло, RCOOK — жидкое мыло.
В эксперименте вы также использовали кислые соли — гидрокарбонат кальция Са(НСO3)2 и гидрокарбонат натрия NaHCO3. Запишем уравнения проделанных реакций.
1) Получение углекислого газа:
СаСO3 + 2НСl = СаСl2 + СO2↑ + Н2O
2) Взаимодействие углекислого газа с известковой водой с образованием нерастворимого карбоната кальция:
СO2 + Са(ОН)2 = СаСO3↓ + Н2O
3) Превращение нерастворимого карбоната в растворимый гидрокарбонат:
СаСO3 + СO2 + Н2O = Са(НСO3)2
4) Диссоциация растворимого гидрокарбоната кальция, обусловливающего жёсткость воды:
Са(НСO3)2 = Са 2+ + 2НСО3 –
Жёсткость воды и способы её устранения.
Вода называется жёсткой, если содержит катионы кальция, магния и железа. В жёсткой воде хуже мылится мыло, увеличивается расход стирального порошка, образуется накипь в системах отопления и горячего водоснабжения и т. д.
Умягчение жёсткой воды проводят разными способами:
Различают временную (устраняется кипячением) и постоянную (устраняется добавкой соды и другими способами) жёсткость воды.
Эксперимент показал различия в свойствах средних и кислых солей: карбонат кальция нерастворим, а гидрокарбонат — растворим. Переход гидрокарбоната кальция в карбонат наблюдается и в природе: рост сталактитов и сталагмитов в пещерах.
В повседневной жизни различия свойств кислых и средних солей мы наблюдаем при использовании стиральной, или технической, соды Na2CO3 (умягчает воду; применяется при стирке белья) и питьевой, или пищевой, соды NaHCO3 (применяется в хлебопечении, изготовлении шипучих напитков, для устранения изжоги).
Классификация солей.
Соли могут быть средними (нормальными), основными, кислыми, двойными и смешанными.
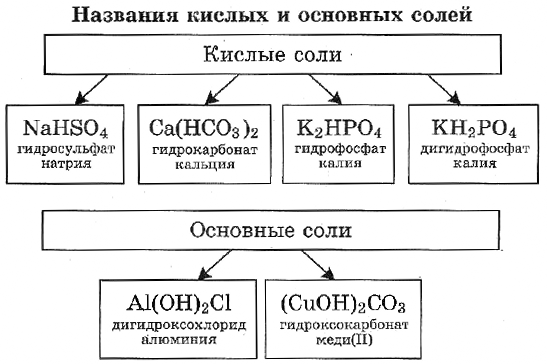
Кислая соль образуется в результате неполного замещения катионов водорода в кислоте на катионы металла.
Однако если в основании, содержащем две или более гидроксогруппы, заменить одну группу на кислотный остаток, получается соль. Такую соль относят к основным солям. Например, гидроксохлорид магния MgOHCl, гидроксобромид цинка ZnOHBr.
Основная соль образуется в результате неполного замещения анионов гидроксогруппы в основании на анионы кислотного остатка.
Самая известная основная соль — гидроксокарбонат меди(II) (СuOН)2СO3, или малахит.
Кислотные остатки солей образуют и амфотерные гидроксиды. Наиболее известная соль такого типа — знаменитая благородная шпинель, венчающая корону Российской империи. Химическую основу этого минерала составляет алюминат магния Mg(AlO2)2, или MgAl2O4.
Несолеобразующие или безразличные оксиды (не образуют солей) — СО, NO, N2O.
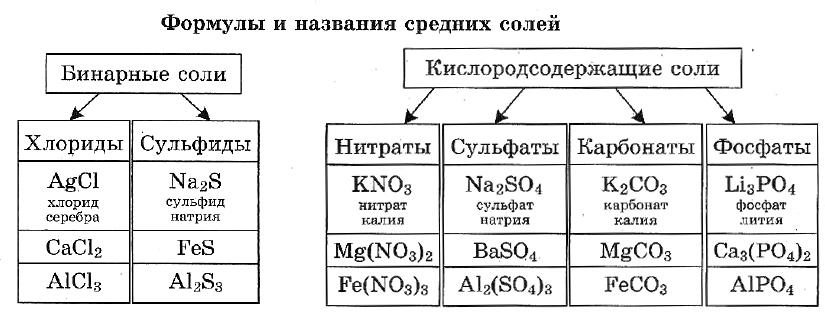
Названия солей.
Названия солей складываются из двух слов: латинского названия кислотного остатка и русского названия металла в родительном падеже. Формулы читают справа налево.
Название бинарной соли содержит суффикс «-ид»: ZnS — сульфид цинка, ВаСl2 — хлорид бария.
Названия кислородсодержащих солей чаще всего имеют в первом слове суффикс «-ат»: Mn(NO3)2 — нитрат марганца(II), Cr2(SO4)3 — сульфат хрома(III), K2SiO3 — силикат калия.
Общие химические свойства солей
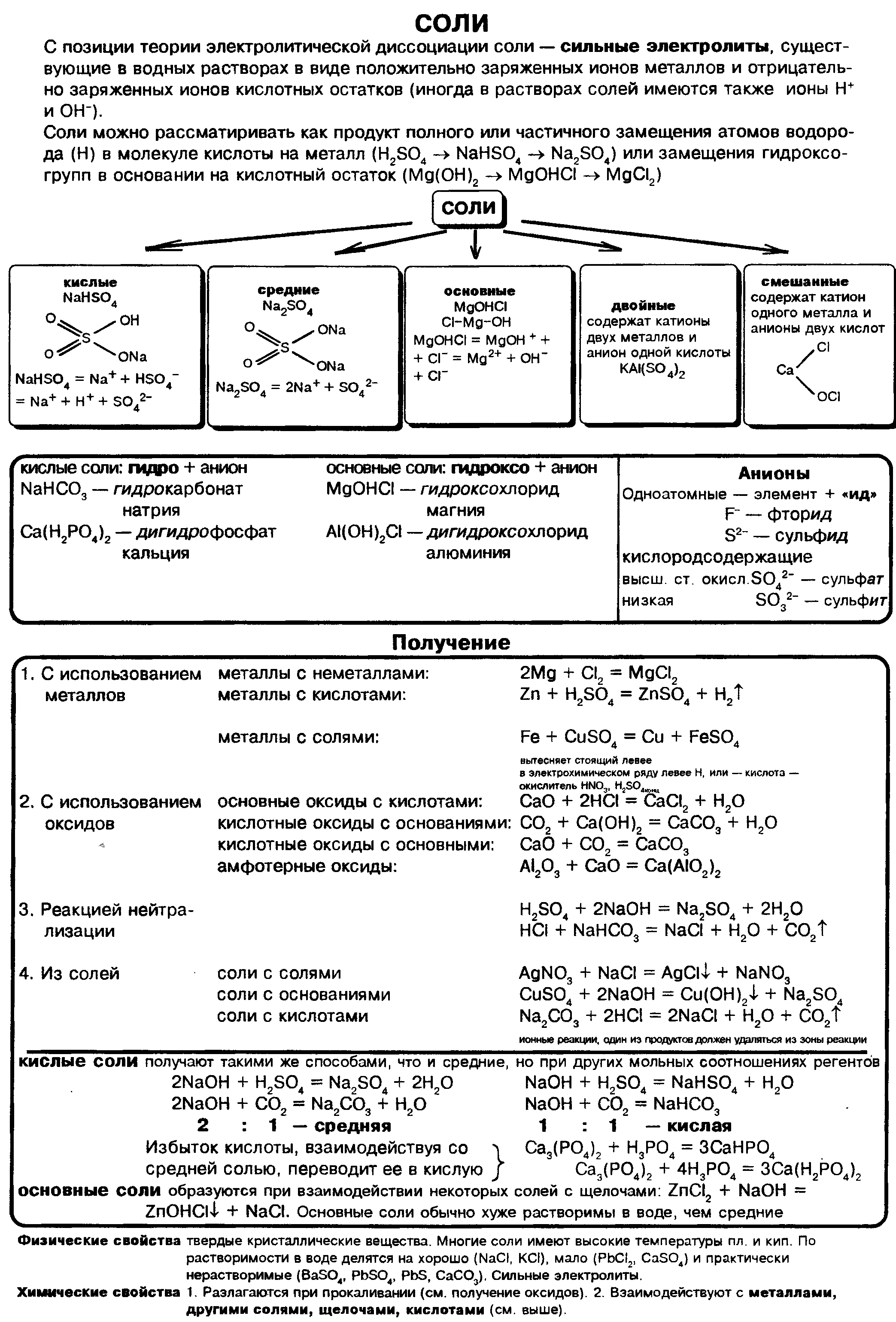
Всё о соли кратко в одной таблице
Конспект урока по химии «Соли». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие: