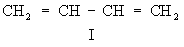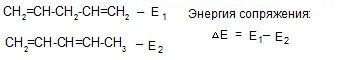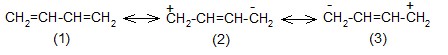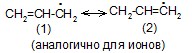Что такое сопряжение в химии простыми словами
Органическая химия
Информативные ответы на все вопросы курса «Органическая химия» в соответствии с Государственным образовательным стандартом.
Оглавление
Приведённый ознакомительный фрагмент книги Органическая химия предоставлен нашим книжным партнёром — компанией ЛитРес.
3. Сопряженные системы
В простейшем случае сопряженные системы —
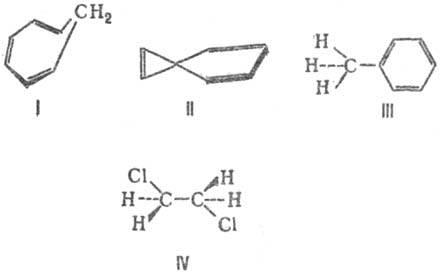
это системы с чередующимися двойными и одинарными связями. Они могут быть открытыми и закрытыми. Открытая система имеется в диеновых углеводородах (УВ).
Все атомы С находятся в состоянии sp-гибридиза-ции. Четыре негибридные р-орбитами, перекрываясь между собой, образуют единую электронную систему. Этот вид сопряжения называется p, p-сопряжением.
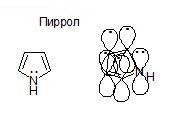
Происходит сопряжение р-электронов с S-электро-нами. Этот вид сопряжения называется р, р-сопряже-нием. Закрытая система имеется в ароматических УВ.
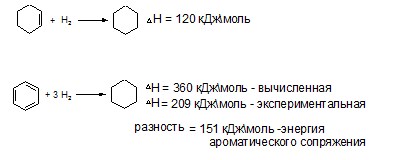
Сопряжение — процесс энергетически выгодный, энергия (Е) при этом выделяется. Энергия сопряжения бутадиена — 1,3 составляет 15 кДж/моль, энергия сопряжения бензола — 228 кДж/моль.
Это понятие, включающее различные свойства ароматических соединений. Условия ароматичности:
1) плоский замкнутый цикл;
2) все атомы С находятся в sp2-гибридизации;
3) образуется единая сопряженная система всех атомов цикла;
4) выполняется правило Хюккеля: в сопряжении участвуют 4n + 2 р-электронов, где n = 1, 2, 3…
Простейший представитель ароматических углеводородов — бензол. Он соответствует всем четырем условиям ароматичности. Правило Хюккеля: 4n + 2 = 6, n = 1.
Нафталин — ароматическое соединение 4n + 2 = 10, n = 2.
Пиридин — ароматическое гетероциклическое соединение. Взаимное влияние атомов в молекуле
В 1861 г. русский ученый A. M. Бутлеров выдвинул положение: «Атомы в молекулах взаимно влияют друг на друга». В настоящее время это влияние передается двумя путями: индуктивным и мезомерным эффектами.
Индуктивный эффект — это передача электронного влияния по цепи р-связи. Известно, что связь между атомами с различной электроотрицательностью (ЭО) поляризована, смещена к более электроотрицательному атому. Это приводит к появлению на атомах эффективных (реальных) зарядов (d). Такое электронное смещение называется индуктивным и обозначается буквой «I» и стрелкой «→».
Индуктивный эффект может быть положительным или отрицательным. Если заместитель X притягивает электроны химической связи сильнее, чем атом Н, то он проявляет — I.I (H) = 0. В нашем примере X проявляет — I.
Если заместитель X притягивает электроны связи слабее, чем атом Н, то он проявляет +I. Все алкилы (R = СН3-, C2H5 — и т. д.), Меп+ проявляют +I.
Сопряжение связей
Полезное
Смотреть что такое «Сопряжение связей» в других словарях:
СОПРЯЖЕНИЕ СВЯЗЕЙ — (конъюгация связей), чередование простых и кратных связей в структурной ф ле соед. (напр., в 1,3 бутадиене СН 2=СНЧСН=СН 2). В широком смысле понятие С. с. охватывает также гомосопряжение (в альтернирующую последовательность простых и двойных… … Химическая энциклопедия
Сопряжение — Сопряжение взаимосвязь чего либо с чем либо, непременное сопутствие, совмещение нескольких объектов, явлений. Математика Комплексное сопряжение операция над комплексным числом (набором комплексных чисел, оператором), при которой… … Википедия
СОПРЯЖЕНИЕ — (1) в машиностроении относительное положение составных частей изделия, характеризуемое соприкосновением их поверхностей млн. зазором между ними, заданными конструкторской документацией; (2) С. контуров обеспечение согласованного изменения… … Большая политехническая энциклопедия
Теория валентных связей — Рис.1. Модель перекрывания атомных орбиталей при образовании сигма связи Теория валентных связей ( … Википедия
Мезомерия — (от Мезо. и греч. méros часть) сопряжение, резонанс в сопряжённых системах, характер распределения электронной плотности в молекулах, который можно трактовать как частичную делокализацию связей и зарядов атомов. Так, в карбоксилат… … Большая советская энциклопедия
Молекула — (новолат. molecula, уменьшительное от лат. moles масса) наименьшая частица вещества, обладающая его химическими свойствами. М. состоит из атомов, точнее из атомных ядер, окружающих их внутренних электронов и внешних валентных электронов,… … Большая советская энциклопедия
Молекула — Схема ковалентных связей между атомами в молекуле кислорода … Википедия
Органическая химия — раздел химии (См. Химия), естественнонаучная дисциплина, предметом изучения которой являются соединения углерода с др. элементами, называемые органическими соединениями, а также законы превращения этих веществ. Углерод образует соединения … Большая советская энциклопедия
Электронные теории в органической химии — теории, рассматривающие строение, физические свойства и реакционную способность (См. Реакционная способность) органических соединений на основе представлений о распределении электронной плотности в атомах и молекулах, а также о смещениях… … Большая советская энциклопедия
Цветности теория — теория о связи Цвета химических соединений с их строением. Ощущение цвета возникает при воздействии на зрительный нерв электромагнитных излучений с энергией в пределах от 2,5․10 12 до 5․10 12 эрг (длины волн от 400 до 760 нм). При этом… … Большая советская энциклопедия
СОПРЯЖЕНИЕ СВЯЗЕЙ
С. с. не обязательно означает неприменимость модели локализованных связей к рассматриваемой молекуле. Так, электронная заселенность локализованных мол. орбиталей вне s-связей не превышает 1%. Так же хорошо локализованы и p-связи в сопряженных неароматич. системах (особенно когда учитывается альтернирование связей). Так, в линейных полиенах заселенность вне двухцентровых связей ок. 2%. Такие сопряженные системы описываются одной резонансной структурой со связями только между соседними атомами и без разделения формальных зарядов (см. Резонанса теория),а их коллективные св-ва удается рассматривать в рамках аддитивных моделей.
В то же время в ароматич. и нек-рых др. системах, к-рые наилучшим образом описываются суперпозицией резонансных структур и где доли локализованных мол. орбиталей имеют большие веса вне связей (напр., в бензоле ок. 13%), С. с. обычно отождествляется с делокализацией связей. Экспериментально наблюдаемые коллективные св-ва таких сопряженных систем в принципе нельзя представить в виде аддитивных ф-ций св-в связей.
Наиб. существенной особенностью сопряженных систем с делокализованными связями является их повыш. термо-динамич. устойчивость. В ароматич. системах теплоты образования значительно выше, чем значения, найденные с учетом аддитивности локальных параметров, а связи характеризуются полной выравненностью длин (см. Ароматичность).Количеств. мера повыш. термодинамич. устойчивости таких систем-энергия резонанса (сопряжения, дело-кализации). В сопряженных системах правилам аддитивности не подчиняются также параметры ЙК спектров, величины дипольных моментов и поляризуемости, диамагнитной восприимчивости и др. В этих случаях при расчете разл. характеристик вводят поправочные члены экзальтации и т. п.
Сопряженные системы с делокализованными связями представляют собой соед. с характсристич. электронными переходами, причем с удлинением цепи сопряжения повышается интенсивность и смещается поглощение в электронных спектрах в сторону больших длин волн (соотв. гипер-хромный эффект и батохромный сдвиг; см. Цветность органических соединений).
Понятие о С. с. используют при рассмотрении реакц. способности. Напр., электроф. присоединение к сопряженным диенам (см. Диеновые углеводороды )приводит к смеси продуктов 1,2- и 1,4-присоединения.
Лит.: Базилевский М. В., Метод молекулярных орбит и реакционная способность органических молекул, М., 1969; Dewar М. I. S., Mc Кее М. L., «J. Amer. Chem. Soc.», 1978, v. 100, № 24, p. 7499-505; Cremer D., «Tetrahedron», 1988, v. 44, № 24, p. 7427-54. М. E. Клецкий.
СОПРЯЖЕНИЕ СВЯЗЕЙ
В то же время в ароматич. и нек-рых др. системах, к-рые наилучшим образом описываются суперпозицией резонансных структур и где доли локализованных мол. орбиталей имеют большие веса вне связей (напр., в бензоле ок. 13%), сопряжение связей обычно отождествляется с делокализацией связей. Экспериментально наблюдаемые коллективные св-ва таких сопряженных систем в принципе нельзя представить в виде аддитивных ф-ций св-в связей.
Наиб. существенной особенностью сопряженных систем с делокализованными связями является их повыш. термо-динамич. устойчивость. В ароматич. системах теплоты образования значительно выше, чем значения, найденные с учетом аддитивности локальных параметров, а связи характеризуются полной выравненностью длин (см. Ароматичность). Количеств. мера повыш. термодинамич. устойчивости таких систем-энергия резонанса (сопряжения, дело-кализации). В сопряженных системах правилам аддитивности не подчиняются также параметры ЙК спектров, величины дипольных моментов и поляризуемости, диамагнитной восприимчивости и др. В этих случаях при расчете разл. характеристик вводят поправочные члены экзальтации и т.п.
Сопряженные системы с делокализованными связями представляют собой соед. с характсристич. электронными переходами, причем с удлинением цепи сопряжения повышается интенсивность и смещается поглощение в электронных спектрах в сторону больших длин волн (соотв. гипер-хромный эффект и батохромный сдвиг; см. Цветность органических соединений).
Понятие о сопряжении связей используют при рассмотрении реакц. способности. Напр., электроф. присоединение к сопряженным диенам (см. Диеновые углеводороды)приводит к смеси продуктов 1,2- и 1,4-присоединения.
Лит.: Базилевский М. В., Метод молекулярных орбит и реакционная способность органических молекул, М., 1969; Dewar М. I. S., Mc Кее М. L., «J. Amer. Chem. Soc.», 1978, v. 100, № 24, p. 7499-505; Cremer D., «Tetrahedron», 1988, v. 44, № 24, p. 7427-54. М. E. Клецкий.
Сопряжение. Ароматичность
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
СОПРЯЖЕНИЕ, АРОМАТИЧНОСТЬ
Некоторые свойства органических соединений не могли быть объяснены в рамках классической теории химической связи. Для их объяснения в теоретической химии было выработано понятие сопряжения.
Сопряжение – это образование в молекуле единого делокализованного электронного облака в результате перекрывания негибридизованных р-орбиталей и образования молекулярной орбитали.
π-π – сопряжение: Делокализованная молекулярная орбиталь образуется за счет взаимодействия двух или более двойных связей:
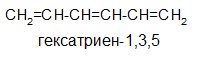
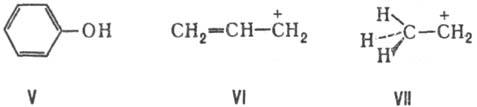
р-π – сопряжение: В сопряжении участвуют соседние с π-связью атомы, имеющие р-орбитали с неподеленной парой электронов:
Энергия сопряжения – это энергия, выделяющаяся в результате сопряжения
– с увеличением цепи сопряжения энергия сопряжения увеличивается.
В результате сопряжения выделяется энергия, внутренняя энергия уменьшается, и молекула становится термодинамически более устойчивой.
Описание сопряженных систем с помощью метода валентных схем
– вклад структур (2) и (3) незначителен из-за уменьшения количества двойных связей и разделения зарядов.
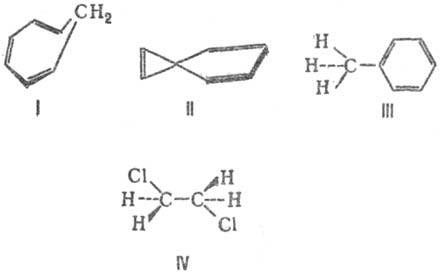
Аллильные частицы – анион, катион, радикал – обладают повышенной устойчивостью в результате следующего сопряжения:
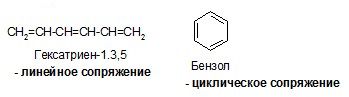
Структуры (1) и (2) идентичны (“вырожденные”), из-за этого энергия сопряжения особенно велика, и аллильные частицы значительно устойчивее, чем соответствующие пропильные. Различаются линейные и циклические сопряженные системы. Циклические сопряженные системы в отличие от линейных имеют замкнутую непрерывную цепь сопряжения, в которой все входящие в неё атомы имеют негибридизованную р-орбиталь.
Ароматичность – это понятие, обозначающее совокупность особых свойств некоторых циклических сопряженных систем.
Ароматические соединения, несмотря на высокую степень ненасыщенности:
1) предпочтительно вступают в реакции замещения, а не присоединения;
2) устойчивы к мягкому окислению.
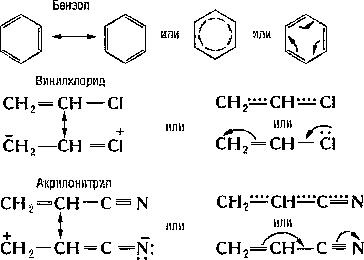
К ароматическим соединениям относятся, прежде всего, бензол и его производные
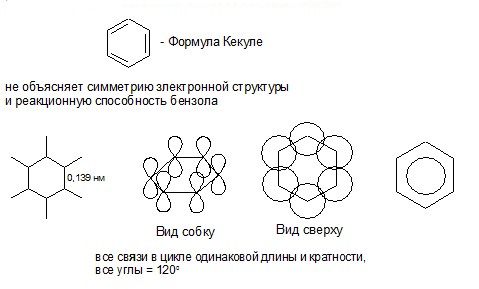
ЭЛЕКТРОННОЕ СТРОЕНИЕ МОЛЕКУЛЫ БЕНЗОЛА
Энергия ароматического сопряжения выше энергии линейного сопряжения:
Признаки ароматичности:
1) Замкнутая цепь сопряжения
2) Правило Хюккеля:
N = 4n + 2, где N – число π- и р-электронов в сопряженной системе; n = 0,1,2,3 …
Ароматическая система – это циклическая сопряженная система, удовлетворяющая правилу Хюккеля.
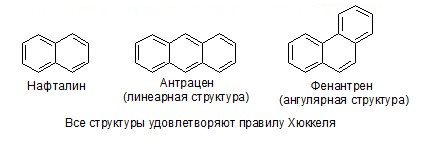
Небензоидные ароматические системы
Ароматические сопряженные системы могут образовываться за счет как π-π – так и р-π-сопряжения, например: