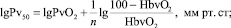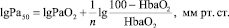Что такое сродство гемоглобина к кислороду
Что такое сродство гемоглобина к кислороду
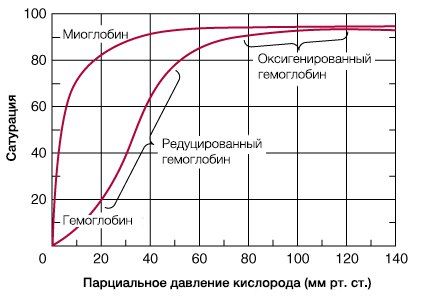
Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов.
Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц.
Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН.
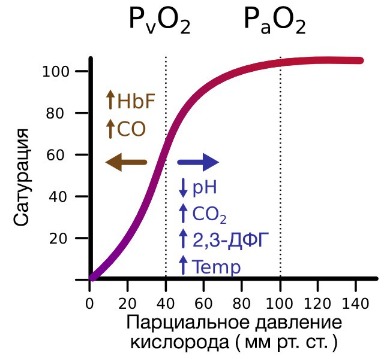
Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани.
Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей.
Что такое сродство гемоглобина к кислороду
Внешней средой, с которой контактирует кровь человека, служит воздух легочных альвеол. «Альвеолярный газ служит для организма своеобразной «внутренней атмосферой» – подобно тому, как кровь служит его внутренней жидкой средой» [1]. Обмен кислородом и углекислотой между альвеолами и кровью зависит от диффузии газов на уровне аэрогематического барьера (АГБ) [6]. Структурно-функциональная основа АГБ нарушается при остром повреждении легких (ОПЛ) [2]. Это осложняет газообмен и способствует развитию в организме кислородного дефицита – гипоксии.
ОПЛ является одним из признаков развития системной воспалительной реакции. Повреждение АГБ связано с действием медиаторов воспаления, образованием тромбов в легочных капиллярах и, как следствие, нарушением микроциркуляции [7].
При ОПЛ наблюдаются клинические и лабораторно-инструментальные признаки повреждения АГБ. Развитие ОПЛ требует использования респираторной поддержки (РП) в виде увлажненного кислорода или искусственной вентиляции легких (ИВЛ) [5, 7]. Применение различных алгоритмов ИВЛ может привести к изменениям РСО2, что изменяет рН крови в сторону ацидоза или алкалоза.
В условиях затрудненной диффузии О2 через АГБ особо важную роль приобретают функциональные свойства гемоглобина – сродство к О2.
На физиологическое значение сдвига КДО в ту или иную сторону указывали многие авторы. По их данным, различия в степени оксигенации гемоглобина, являющиеся в конечном счете функцией различного РО2 плазмы, сопряжены с улучшением или ухудшением снабжения тканей кислородом.
Значение Р50 определенно можно рассматривать как одну из важнейших физиологических констант внутренней среды организма, изменение которой может вызвать только значительный дисбаланс систем гомеостазиса [8].
Между тем различные факторы среды (рН, рСО2, температура и ДФГ) оказывают на молекулу гемоглобина определенное воздействие [4], что может определять изменение сродства гемоглобина к О2. В последние годы к числу важнейших лигандов, способных определять функциональные свойства гемоглобина, относят такие сигнальные молекулы, как оксид азота – NO [3].
Известно, что активность Н+ наиболее существенно изменяет свойства гемоглобина – связи между субъединицами становятся слабее по мере подкисления среды. При этом КДО смещается вправо, сродство к гемоглобину уменьшается, Р50 растет [4, 6]. Исследователями убедительно доказана связь между содержанием протона и положением КДО. РСО2 также изменяет степень сродства гемоглобина к О2 в основном за счет изменения рН.
Интересно, что в литературе приводятся различные, но очень близкие значения показателя Р50 в норме – от 25 до 27,5 мм рт. ст. [8]. Очевидно, что единого значения нормы Р50 нет из-за применения различных методик определения (газовая тонометрия по Austrup, 1965 г.; газовый анализатор Duvelleroy, 1970 г.; метод смешения равных объемов полностью оксигенированной и дезоксигенированной крови по Edwards и Martin, 1966 г) [8]. В настоящее время, как и в нашей работе, при определении Р50 используют формулу [9]:
Цель работы: определить у пациентов с ОПЛ Р50, сравнить с нормальными значениями. Определить зависимость Р50 от содержания протона и от парциального напряжения углекислоты в крови при ОПЛ.
Материалы и методы исследования
В соответствии с целью работы материалом служили пробы крови пациентов, находившихся на лечении в отделении реанимации и интенсивной терапии (ОРИТ) Коми республиканской больницы, у которых на основании диагностических признаков определено развитие ОПЛ. Работу выполняли в течение 2010–2012 гг. Исследована кровь 33 пациентов (26 мужчин, 7 женщин) в возрасте от 18 лет до 71 года.
Кровь получали из бедренных сосудов a et v femoralis, как это рекомендуется при ведении пациентов с ОПЛ [7]. Всем исследуемым производилась РП вида увлажненного О2 или ИВЛ с различными FiO2.
РО2, рН артериальной и венозной крови определяли датчиком аппарата RADIOMETER (t = 37,0 °C).
Гемоглобин
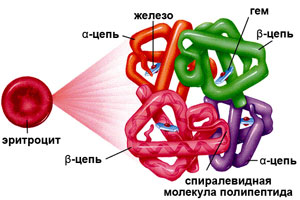
Строение гемоглобина
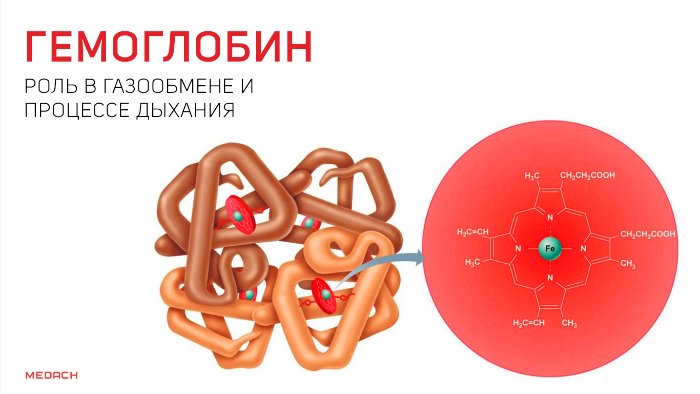
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
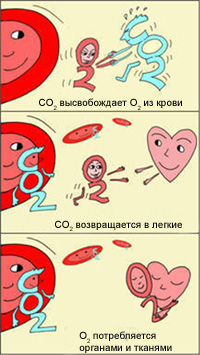
Эффект был описан датским физиологом Христианом Бором http://en.wikipedia.org/wiki/Christian_Bohr (отцом знаменитого физика Нильса Бора).
Христиан Бор заявил, что при большей кислотности (более низкое значение рН, например, в тканях) гемоглобин будет меньше связываться с кислородом, что позволит его отдать.
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.

В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.
Гемоглобин: роль в газообмене и процессе дыхания
Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии. Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1–2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.
При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.
В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
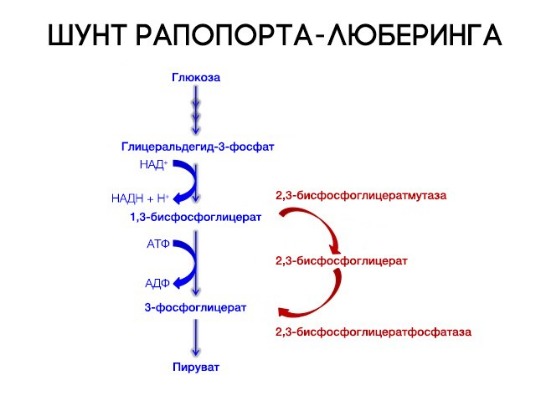
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.
Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Источники:
Что такое сродство гемоглобина к кислороду
4.1. Транспорт кислорода
В сложных механизмах транспорта газов кровью и газообмена в тканях важная роль отводится эритроцитам, ответственным за доставку О2 к различным органам и удаление образующегося в процессе метаболизма СО2.
Эритроцит – безъядерная клетка, лишенная митохондрий, основным источником энергии для эритроцита служит глюкоза, метаболизируемая в гексозомонофосфатном шунте или цикле Эмбдена-Мейергофа. Транспорт О2 обеспечивается в значительной мере гемоглобином, состоящим из белка глобина и гема. Последний представляет собой комплексное соединение железа и порфирина. Глобин представляет собой тетрамер полипептидной цепи. Hb A (HbA) – основной гемоглобин взрослых содержит 2 – альфа и 2 – бета – цепи, Hb A2 – содержит две альфа и две дельта цепи.
Гем состоит из иона железа, встроенного в порфириновое кольцо. Ион железа гема обратимо связывает одну молекулу О2. С одной молекулой Hb максимально связываются 4 молекулы О2 с образованием оксигемоглобина.
Гем может подвергаться не только оксигенации, но и истинному окислению, когда железо становится из двухвалентного трехвалентным. Окисленный гем носит название гематина, а молекула гемоглобина становится метгемоглобином. В крови человека метгемоглобин находится в незначительных количествах, его уровень резко возрастает при отравлениях. Метгемоглобин не способен отдавать кислород тканям.
В норме метгемоглобин составляет менее 3% общего Hb крови. Основная форма транспорта О2 – в виде оксигемоглобина. Кислород транспортируется артериальной кровью не только в связи с гемоглобином, но и в растворенном виде. Принимая во внимание тот факт, что 1 г Hb может связать 1,34 мл О2, кислородная емкость крови в среднем у взрослого человека составляет около 200 мл/л крови. Одним из показателей кислородного транспорта является насыщение артериальной крови О2(Sa O2), равного отношению О2, связанного с Hb, к кислородной емкости крови:
SaO2=O2, связанного с Hb/O2 емкость крови* 100%.
В соответствии с кривой диссоциации оксигемоглобина насыщение артериальной крови кислородом в среднем составляет 97%, в венозной крови – 75%.
PaO2 в артериальной крови около 100 мм. рт. ст., а в венозной – около 40 мм. рт. ст.
Количество растворенного кислорода в крови пропорционально парциальному давлению О2 и коэффициэнту его растворимости.
Последний для О2 составляет 0,0031/100 мл крови/ 1 мм. рт. ст.. Таким образом, 100 мл крови при PaO2, равном 100 мм. рт. ст., содержит менее 0,31 мл O2.
Диссоциация оксигемоглобина в тканях обусловлена главным образом химическими свойствами гемоглобина, а также рядом других факторов – температурой тела, рН среды, р СО2.
При понижении температуры тела наклон кривой диссоциации оксигемоглобина возрастает, а при ее повышении – снижается, и соответственно снижается сродство Hb к О2.
При снижении рН, т.е. при закислении среды, сродство гемоглобина к О2 уменьшается. Увеличение напряжения в крови СО2 также сопровождается снижением сродства Hb к О2 и уплощением кривой диссоциации оксигемоглобина.
Известно, что степень диссоциации оксигемоглобина определяется содержанием в эритроцитах некоторых фосфорорганических соединений, главным из которых является 2,3 – ДФГ (2,3 дифосфоглицерат), а также содержанием в эритроцитах катионов. В случаях развития алкалозов, поглощение О2 в легких увеличивается, но в то же время затрудняется отдача кислорода тканями. При ацидозах наблюдается обратная картина.
4.2.Утилизация кислорода тканями
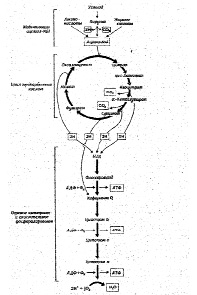
Тканевое или клеточное дыхание включает три стадии. На первой стадии пируват, аминокислоты и жирные кислоты окисляются до двухуглеродных фрагментов ацетильных групп, входящих в состав ацетилкофермента А. Последние на втором этапе окисления включаются в цикл лимонной кислоты, где происходит образование высокоэнергетических атомов водорода и высвобождение СО2 – конечного продукта окисления органических субстратов. На третьей стадии клеточного дыхания атомы водорода делятся на протоны (Н+) и «высокоэнергетические» электроны, передающиеся по дыхательной цепи на молекулярный О2 и восстанавливающие его до НО2. Перенос электронов сопряжен с запасом энергии в форме АТФ, т.е. с окислительным фосфорилированием (рис.6).
Касаясь патогенеза метаболических сдвигов, свойственных гипоксическим состояниям, следует отметить, что в организме человека более 90% всего потребляемого кислорода восстанавливается с участием цитохромоксидазы митохондрий, и лишь около 10% кислорода метаболизируется в тканях с участием оксигеназ: диоксигеназы и монооксигеназы.
Рис.6. Схема тканевого дыхания. Конечные продукты каждой стадии даны в рамке (Ленинджер А., 1999)
Наиболее многочисленны и сложны монооксигеназные реакции, протекающие в эндоплазматическом ретикулуме клеток при участии цитохрома Р-450 и обеспечивающие гидроксилирование субстрата (стероидных гормонов, лекарственных препаратов и различных др. соединений) и, как правило, его инактивацию.
Диоксигеназы катализируют реакции, в которых в молекулу органического субстрата включаются оба атома молекулы кислорода (например, реакция окисления катехола молекулярным кислородом с раскрытием кольца).
В реакциях, связанных с переносом электронов, т.е. в реакциях окисления-восстановления, где, как указывалось выше, используется более 90% потребляемого кислорода, атомы водорода, отщепленные дегидрогеназами от субстратов в цикле лимонной кислоты, передают свои электроны в цепь переноса электронов и превращаются также в Н +. Как известно, помимо 4 пар атомов водорода, поставляемых каждым оборотом цикла лимонной кислоты, образуются и другие атомы водорода, отщепленные дегидрогеназами от пирувата, жирных кислот и аминокислот в процессе их расщепления до Ацетил-СоА и других продуктов.
Таким образом, все атомы водорода, отщепляемые дегидрогеназами от субстратов, передают свои электроны в дыхательную цепь к конечному акцептору электронов – кислороду.
Скорость утилизации О2 в различных тканях различна. В среднем взрослый человек потребляет 250 мл О2 в 1 мин. Максимальное извлечение О2 из притекающей артериальной крови свойственно миокарду.
Кислород используется в клетках, в основном в метаболизме белков, жиров, углеводов, ксенобиотиков, в окислительно-восстановительных реакциях в различных субклеточных фракциях: в митохондриях, в эндоплазматическом ретикулуме, в реакциях липопероксидации, а также в межклеточном матриксе и в биологических жидкостях.
Коэффициент утилизации О2 в тканях равен отношению потребления О2 к интенсивности его доставки, широко варьирует в различных органах и тканях.
В условиях нормы минимальную потребность в О2 проявляют почки и селезенка, а максимальную потребность – кора головного мозга, миокард и скелетные мышцы, где коэффициент утилизации О2 колеблется от 0,4 до 0,6, а в миокарде до 0,7. При крайне интенсивной физической работе коэффициент утилизации О2 мышцами и миокардом может возрастать до 0,9.
Обмен дыхательных газов в тканях происходит в процессе свободной и облегченной диффузии. При этом О2 переносится по градиенту напряжения газа из эритроцитов и плазмы крови в окружающие ткани.
Одновременно происходит диффузия СО2 из тканей в кровь. На выход О2 из крови в ткани влияет диссоциация оксигемоглобина в эритроцитах, что обеспечивает так называемую облегченную диффузию О2. Интенсивность диффузионного потока О2 и СО2 определяется градиентом их напряжения между кровью и тканями, а также площадью газообмена, плотностью капилляров, распределением кровотока в микроциркуляторном русле. Интенсивность окислительных процессов в тканях определяется величиной критического напряжения О2 в митохондриях, которое в условиях нормы должно превосходить 0,1-1 мм рт. ст.
Соответствие доставки О2 к органам и тканям, возросшим потребностям в оксигенации обеспечивается на клеточном, органном уровнях за счет образования метаболитов изнашивания, а также при участии нервных, гормональных и гуморальных влияний.
Основная масса углекислого газа (СО2) образуется в организме как конечный продукт различных метаболических реакций и транспортируется к легким с кровью. Вдыхаемый воздух содержит лишь незначительное количество СО2.
Транспорт СО2 кровью осуществляется в 3-х состояниях: в виде аниона бикарбоната, в растворенной форме и в виде карбаминовых соединений.
СО2 хорошо растворяется в плазме крови и в артериальной крови, около 5% от общей двуокиси углерода содержится в крови в растворенной форме.
Третьей формой транспорта СО2 кровью являются карбаминовые соединения, образованные взаимодействием СО2 с концевыми группами белков крови преимущественно с гемоглобином:
Карбаминовые соединения составляют около 5% от общего количества СО2, транспортируемого кровью.
В оксигенированной артериальной крови напряжение СО2 составляет 40 мм. рт. ст., а в венозной крови Рv СО2 равно 46 мм. рт. ст.
4.4.Связывание гемоглобина с окисью углерода