Что такое статины в медицине их названия
Подсказки фармацевту: ЛС при атеросклерозе
Гиполипидемические препараты: механизм действия, побочные эффекты и особенности приема
Атеросклероз, в основе которого лежит комплекс сложных нарушений метаболизма липидов, — один из важнейших факторов риска развития сосудистых катастроф. Тесно связанная с ним гиперхолестеринемия выявляется более чем у 60 % госпитализированных пациентов в возрасте 30–69 лет [1]. Поэтому препараты, способствующие нормализации липидных параметров, пользуются в аптеках стабильным спросом. По всей вероятности, он будет только расти: ведь средний возраст населения России растет и число больных сердечно-сосудистыми заболеваниями увеличивается. И чтобы качественно проводить фармконсультирование, первостольникам важно помнить, как работают гиполипидемические ЛС, какие побочные эффекты они проявляют и о чем необходимо предупредить клиента с соответствующим рецептом.
Начало начал: классификация гиполипидемических средств
В первую очередь вспомним, какие гиполипидемические средства есть в настоящее время в ассортименте аптек.
Таблица 1: Гиполипидемические ЛС
| Средства, понижающие содержание в крови преимущественно холестерина (ЛПНП) | ||
| Ингибиторы синтеза холестерина (ингибиторы 3-гидрокси-3-метилглутаргил коэнзим А-редуктазы, или статины) | аторвастатин, ловастатин, питавастатин, правастатин, розувастатин, симвастатин, флувастатин | |
| Ингибиторы всасывания холестерина из кишечника | эзетимиб | |
| Средства, понижающие содержание в крови преимущественно триглицеридов | Производные фиброевой кислоты, или фибраты | гемфиброзил фенофибрат |
| Препараты, снижающие холестерин в крови (ЛПНП) и триглицеридов (ЛПОНП) | Кислота никотиновая | |
Гиполипидемические препараты нормализуют липидный профиль за счет реализации различных механизмов. Среди них [1, 2]:
Рассмотрим подробнее, как работают представители различных подгрупп гиполипидемических препаратов и какие особенности они имеют.
Фармакология статинов
Статины — препараты первой линии для лечения гиперлипидемии, которые выделяются самой высокой липолитической активностью среди всех подгрупп гиполипидемических препаратов [3, 4]. Первые представители статинов были получены из плесневых культур. Речь идет о ловастатине — он был выделен в 1980 году из содержащегося в почве плесневого грибка Aspergillus terreus. В клинической практике ловастатин начал применяться в 1987 году, положив начало эре самых мощных гиполипидемических средств [5].
Последующие ЛС этой подгруппы имеют полусинтетическое (симвастатин, правастатин) и синтетическое происхождение (флувастатин, аторвастатин, розувастатин).
Механизм действия статинов
Статины снижают синтез холестерина и липопротеинов очень низкой плотности (ЛПОНП) в печени за счет угнетения активности ключевого фермента, участвующего в раннем этапе синтеза холестерина (ГМГ-КоА-редуктазы, — прим. ред.). В результате происходит цепочка изменений [3]:
Важно отметить, что гиполипидемический эффект при приеме статинов проявляется быстро, приблизительно в течение недели после начала терапии.
Кроме того, для статинов характерны нелипидные плейотропные эффекты, среди которых следует выделить:
Статины также оказывают профилактическое действие в отношении сердечно-сосудистых заболеваний. Доказано, что они снижают риск смертности от больших сердечно-сосудистых событий (инфаркт миокарда, инсульт) и развития сердечно-сосудистых заболеваний [4]. Результаты Кокрановского обзора свидетельствуют, что статины снижают риск повторного инсульта [4].
К статинам (как, впрочем, и к гиполипидемическим препаратам других подгрупп) не развивается устойчивость.
Безопасность статинов при беременности не изучалась, поэтому женщинам репродуктивного возраста во время лечения важно использовать эффективную контрацепцию. При лактации статины также противопоказаны [5].
Побочные эффекты
Как правило, статины хорошо переносятся, однако негативные реакции при их приеме возможны. Среди самых распространенных — диспепсические явления (тошнота, рвота, боль в животе, диарея, снижение аппетита), неврологические (головокружение, раздражительность). На фоне приема статинов может ощущаться мышечная боль и ассоциированная с ней мышечная слабость: они возникают у 10 % пациентов [4].
Редким серьезным побочным эффектом статинов является разрушение мышечной ткани — рабдомиолиз. Он проявляется при комбинации неблагоприятных факторов, например, приеме статинов на фоне применения иммунодепрессантов [4].
О чем предупредить клиента?
Статины быстро оказывают гиполипидемическое действие, однако, даже если анализы демонстрируют нормализацию уровня липидов, отменять препараты без рекомендации врача нельзя. При их отмене уровень липидов часто вновь повышается. Препараты применяют длительно, иногда пожизненно.
Препараты, ингибирующие всасывание холестерина в кишечнике
Первым и пока единственным лекарством этой подгруппы стал эзетимиб. Он работает в основном в ворсинчатом эпителии щеточной каймы тонкой кишки.
Механизм действия основан на ингибировании транспортера холестерина в энтероцитах кишечника. Это обеспечивает снижение всасывания холестерина примерно на 50 %. Также уменьшается уровень ЛПНП и ЛПОНП на 20–25 % и незначительно повышается содержание ЛПВП.
Максимальное действие препарата развивается через две недели. При монотерапии в стандартной дозе 10 мг в сутки эзетимиб обеспечивает снижение концентрации ЛПНП не более чем на 17–18 %, поэтому чаще его применяют в комбинации со статинами [3].
Побочные эффекты
Обычно, эзетимиб хорошо переносится. В редких случаях он может вызывать изменение уровня ферментов печени, а также боли в спине, артралгию, слабость [1, 3].
О чем предупредить клиента?
Если доктор выписал комбинацию эзетимиба и статинов, важно придерживаться рекомендаций и принимать оба препарата, чтобы достичь оптимального гиполипидемического эффекта.
Фибраты
Фибраты — первые эффективные гипотриглицеридемические препараты, которые начали использовать для лечения атеросклероза. Выделяют два поколения этой подгруппы: к первому относится клофибрат, который в настоящее время не зарегистрирован из‑за низкого профиля безопасности. Появились данные, что на фоне продолжительного применения клофибрата увеличивается смертность, не связанная с сердечно-сосудистыми заболеваниями, а также повышается риск развития опухолей пищеварительного тракта и печени [1].
Сегодня применяются только фибраты второго поколения, имеющие благоприятный профиль безопасности: фенофибрат, безафибрат, ципрофибрат и гемфиброзил.
По эффективности все фибраты второго поколения сходны, а вот по фармакокинетике препараты различаются. Наиболее длительно действует фенофибрат (20–25 часов) и ципрофибрат (более 48 часов) [1]. При этом максимальный клинический эффект развивается только спустя несколько недель применения. Так, для гемфиброзила этот показатель составляет не менее 4 недель.
Механизм действия фибратов до сих пор остается не до конца ясным [5]. Исследования последних лет свидетельствуют, что многие их эффекты связаны со взаимодействием с рецепторами, активируемыми пероксисомными пролифераторами (PPAR). Они играют существенную роль в регуляции транскрипции генов. Фибраты связываются с PPAR, которые экспрессируются в первую очередь в печени и бурой жировой ткани, и, предположительно, за счет PPAR-опосредованной стимуляции окисления жирных кислот, обеспечивают [4]:
На фоне приема фибратов также уплотняются атеросклеротические бляшки в стенке сосудов, что приводит к увеличению их просвета. Кроме того, препараты этой группы оказывают антиагрегантное действие.
Фибраты назначаются длительно, как правило, на протяжении нескольких лет.
Побочные эффекты
Нежелательные реакции при приеме фибратов развиваются в 2–15 % случаев. Чаще всего возникают диспепсические расстройства — тошнота, диарея; кожные реакции (сыпь). Реже появляются сонливость, нарушение оттока желчи, миозит.
О чем предупредить клиента?
Фибраты лучше применять утром во время еды, поскольку синтез липопротеидов, богатых триглицеридами, интенсивнее происходит именно в утренние часы.
Производные никотиновой кислоты
Ниацин, или никотиновая кислота при атеросклерозе, — один из самых «заслуженных» препаратов, который используется для лечения гиперлипидемии с 1955 года [6]. Она действует только после превращения в организме в никотинамид и последующего связывания с коэнзимами кодегидразой I и кодегидрозой II, которые переносят водород.
Отличительные действия никотиновой кислоты по сравнению с другими гиполипидемическими препаратами — способность выраженно повышать уровень ЛПВП, а также вазодилатирующий эффект.
Гиполипидемическое действие ниацина требует более высоких доз, чем необходимо для проявления витаминного эффекта. В среднем доза никотиновой кислоты как гиполипидемического средства в 100 раз выше, чем в качестве витамина [1].
Механизм действия основан на ингибировании липолиза триглицеридов в жировой ткани. Ниацин уменьшает синтез ЛПОНП, снижает уровень общего холестерина, ЛПНП, триглицеридов и повышает содержание ЛПВП на 15–30 %. Препарат также обладает антиатерогенными свойствами [5].
Наряду с гиполипидемическим эффектом никотиновая кислота расширяет мелкие сосуды (в том числе сосуды головного мозга), улучшает микроциркуляцию, оказывает слабое антикоагулянтное действие.
Уровень триглицеридов начинает падать уже через 1–4 дня после начала приема никотиновой кислоты, в то время как содержание холестерина падает на 5–7 день использования препарата.
Побочные эффекты
Наряду с довольно мощными гиполипидемическими свойствами ниацин выделяется плохой переносимостью. До 40 % пациентов отказываются от ее приема из‑за побочных эффектов [6]. Одним из побочных эффектов, связанных с низким комплаенсом, является ощущение жара и приливов, обусловленное выбросом простагландинов. Этот эффект может быть снижен за счет постепенного титрования дозы и назначения ацетилсалициловой кислоты в дозе 250 мг за полчаса до приема никотиновой кислоты.
На фоне применения высоких доз никотиновой кислоты (как правило, составляющих 2–6 г в сутки) возможно появление кожного зуда и диспепсии — рвоты, диареи. Существует риск образования пептической язвы желудка, нарушения функции печени, повышения уровня глюкозы и мочевой кислоты в крови. Из-за возможного развития гиперурикемии никотиновая кислота противопоказана при подагре. Ее также не рекомендуется применять при сахарном диабете и метаболическом синдроме [1, 3].
Ввиду не лучшей переносимости никотиновой кислоты были синтезированы ее производные, имеющие более высокий профиль безопасности. Одним из самых назначаемых стал ксантинола никотинат.
О чем предупредить клиента?
Ниацин за счет вазодилатирующего действия может потенцировать эффект гипотензивных препаратов и приводить к внезапному снижению артериального давления, поэтому использовать ее на фоне антигипертензивной терапии нужно осторожно, после консультации с врачом [7].
Никотиновую кислоту рекомендуют принимать во время еды.
Комбинированная гиполипидемическая терапия
В некоторых случаях врачи назначают комбинацию гиполипидемических препаратов с различным механизмом действия. Самое распространенное показание — тяжелая гиперлипидемия. Чаще всего фибраты применяют в сочетании со статинами. Никотиновую кислоту с другими гиперлипидемическими средствами комбинируют очень осторожно, под контролем врача [6].
При неэффективности двухкомпонентной схемы лечения могут применяться сразу три препарата, например, статины, ингибиторы всасывания холестерина и никотиновая кислота [3].
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Статины — наиболее перспективные препараты для лечения атеросклероза
(По материалам XI Международного симпозиума по проблемам атеросклероза, проходившего в Париже с 5 по 9 октября 1997 г.) Из всех антигиперлипидеми- ческих препаратов наиболее оптимальными в плане клинической эффективности являются
(По материалам XI Международного симпозиума по проблемам атеросклероза, проходившего в Париже с 5 по 9 октября 1997 г.)
Из всех антигиперлипидеми- ческих препаратов наиболее оптимальными в плане клинической эффективности являются статины
 |
Все известные на сегодняшний день фармакологические препараты, предназначенные для лечения атеросклероза (антигиперлипидемические препараты), условно могут быть разделены на пять классов. Принадлежность к тому или иному классу определяется биохимическим механизмом действия препарата и особенностями его влияния на показатели липидного состава крови. Первый из упомянутых классов представляют так называемые секвестранты желчных кислот (холестирамин, холестипол, квестран и др.); второй — препараты никотиновой кислоты, обеспечивающие суточный дозовый режим от 3 до 5 г; третий — производные фиброевой кислоты, или фибраты (клофибрат, безофибрат, фенофибрат, гемфиброзил и др.); четвертый — пробукол в единственном числе; пятый — конкурентные ингибиторы ГМГ-КоА-редуктазы, или статины (ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, церивастатин).
Из всех антигиперлипидемических препаратов наиболее оптимальными в плане клинической эффективности и относительно низкой токсичности являются статины — как природные, так и синтезированные соединения, способные эффективно тормозить процесс развития атеросклероза и тем самым улучшать показатели заболеваемости и летальности у больных с различными формами атеросклеротического поражения сердечно-сосудистой системы (Tonkin A., Illingworth R.). Механизм действия статинов довольно сложен: в основном он сводится к ингибированию ферментативного синтеза эндогенного холестерина, уменьшению продукции атерогенных липопротеидов (низкой плотности) в печени и специфической активации печеночных рецепторов, ответственных за элиминацию этих липопротеидов. В конечном итоге статины снижают уровень атерогенных липопротеидов в крови, замедляя тем самым рост атеросклеротических бляшек или способствуя обратному их развитию (Serruys P., Herd J., Baldassarre D., Ballantyne C.). Чрезвычайно важным является недавно установленный факт положительного влияния статинов на уровень триглицеридов и антиатерогенных липопротеидов (высокой плотности) в крови больных атеросклерозом (McKenney J., Perova N., Harris W., Collins R., Temelkova-Kurktschiev T.). Большой интерес также представляют данные (Nesto R., Tikkanen M., Tomlinson B.) о высокой антигиперлипидемической активности статинов у больных сахарным диабетом с синдромом инсулинрезистентности.
Особого внимания заслуживают сравнительно недавно выявленные положительные эффекты статинов, не связанные с гиполипидемическим действием, определяющие во многом их антиатерогенную и антиишемическую активность.
Согласно последним данным (Illingworth R., Brown B., Lee R., Bellosta S., Nishikawa T.), статины благотворно влияют на миграцию и функциональное состояние макрофагов, а также на миграцию и пролиферацию гладкомышечных клеток и сосудистой стенки, улучшая тем самым ее биомеханические и гистохимические характеристики. В частности, инактивируя макрофаги, статины уменьшают продукцию в них так называемых металлопротеиназ (интерстициальная коллагеназа, желатиназа и стромелизин), разрыхляющих и тем самым дестабилизирующих атеросклеротическую бляшку. В результате снижается риск разрыва бляшки и внутрисосудистого тромбообразования. Угнетение миграции и пролиферации гладкомышечных клеток приводит к уменьшению потенциального объема атеромы.
Помимо описанного положительного воздействия на морфологические и функциональные свойства сосудистой стенки, статины нормализуют автономную регуляцию сосудистого тонуса и объемной скорости кровотока, устраняя тем самым в атеросклеротически измененном сосудистом бассейне гемодинамический фактор патогенеза органной ишемии (Simons L., Lamas S., Schmieder R.).
Механизм антигиперкоагулянтного действия статинов довольно сложен. Эти препараты снижают уровень фибриногена плазмы, нормализуют липидный состав мембран клеток крови, ингибируют АДФ-зависимую агрегацию тромбоцитов, угнетают продукцию тромбоксанов и уменьшают концентрацию 1-го ингибитора тканевого активатора плазминогена.
| Механизм действия статинов сводится к ингибированию ферментативного синтеза эндогенного холестерина в печени. Применение статинов приводит к снижению «коронарной» летальности, частоты развития инфаркта миокарда и инсульта |
Крупномасштабные многоцентровые рандомизированные исследования последних лет позволили наглядно продемонстрировать высокую клиническую эффективность статинов у больных ишемической болезнью сердца. В исследованиях «MAAS» (с симвастатином) и «LCAS» (с флувастатином) было показано, что длительное (более двух лет) применение адекватных (липидоснижающих) доз статинов может существенно замедлять прогрессирование и даже вызывать обратное развитие атеросклеротических изменений в коронарных артериях (Vaughan C., Herd J.). Эти исследования, выполненные с привлечением методик количественной ангиографии, представляют большой научный интерес. Они позволили проанализировать изменения морфологии атеросклеротических бляшек при спонтанном течении заболевания и на фоне антигиперлипидемической терапии, однако при этом не было получено убедительных доказательств эффективности статинов в отношении показателей летальности. Вместе с тем, принимая во внимание описанный выше сложный механизм действия препаратов, который отнюдь не исчерпывается снижением уровня атерогенных липидов в крови, можно с уверенностью сказать, что только показатели летальности позволяют в полной мере судить о клинической эффективности статинов. Всегда следует помнить о том, что именно клинические, а не биохимические задачи стоят перед создателями липидоснижающих препаратов. Никогда нельзя быть уверенным в том, что достигнутое улучшение лабораторных показателей обеспечит желаемый клинический эффект в отношении течения атеросклеротического процесса и продления жизни больного. Именно поэтому аналитики безоговорочно отдают предочтение тем препаратам, для которых удается продемонстрировать именно клиническую эффективность (снижение общей, «коронарной» и «цереброваскулярной» летальности; снижение частоты развития инфаркта миокарда и кумулятивной потребности в рентгеноэндоваскулярном и кардиохирургическом лечении).
На сегодняшний день в этой области сложилась довольно сложная ситуация. Согласно образному выражению Graham Jackson, мир стоит на пороге «великой войны между статинами». Если говорить о чисто лабораторно-биохимической эффективности, то пальму первенства следует отдать аторвастатину. Однако в отношении именно клинической эффективности — прежде всего показателей летальности — бесспорными лидерами остаются симвастатин и правастатин. Именно для этих двух препаратов в ходе гигантских многоцентровых рандомизированных исследований (CARE и WOSCOPS — правастатин, 4S — симвастатин) удалось продемонстрировать достоверное улучшение всех основных анализируемых клинических показателей: снижение риска «коронарной» летальности на 20 — 42%, частоты развития инфаркта миокарда — на 25 — 37%, частоты развития инсульта — на 28 — 31%. Следует особо отметить, что симвастатин и правастатин испытывались не в одинаковом дозовом режиме и при разных исходных уровнях гиперхолестеринемии. Если в исследованиях CARE и WOSCOPS правастатин назначали пациентам с уровнем суммарного холестерина в крови от 4,0 до 6,2 ммоль/л (практически в пределах нормы) в дозе 40 мг в сутки, то в исследовании 4S симвастатин назначали при несомненной гиперхолестеринемии (5,5 — 8,0 ммоль/л) и в меньшей суточной дозе (20 — 40 мг). Таким образом, сравнительный метанализ клинической эффективности двух рассматриваемых альтернативных препаратов позволяет констатировать более высокую эффективность симвастатина (с учетом степени выраженности гиперлипидемии у больных, получавших симвастатин, и возможности его использования в сравнительно невысоких дозах).
Сегодня с полной объективностью можно утверждать, что симвастатин, известный в мире под названием «ЗОКОР», является наиболее клинически эффективным, надежно апробированным препаратом для лечения атеросклероза у больных с умеренной (наиболее часто встречающейся) гиперхолестеринемией (5,5 — 8,0 ммоль/л). Важно, что дозовый режим применения симвастатина вполне приемлем в отношении переносимости и экономичности.
Не исключено, что недавно синтезированный аторвастатин, обладающий непревзойденной антигиперлипидемической активностью, в самом ближайшем будущем займет свое законное место в ряду статиновых препаратов, не вытесняя при этом своих фармакологических аналогов. Например, можно рассчитывать на высокую клиническую эффективность аторвастатина в случаях высокой гиперхолестеринемии (выше 8,0 ммоль/л), когда другие статины либо вообще не справляются, либо должны вынужденно применяться в субтоксических дозах.
Возможно, в перспективе медикаментозное лечение атеросклероза будет заключаться в комбинировании препаратов различных групп. Сегодня широко применяется комбинация статинов с секвестрантами желчных кислот. Чрезвычайно перспективным представляется применение статинов в сочетании с фибратами, способными значительно потенцировать такие статиновые эффекты, как повышение уровня антиатерогенных липопротеидов (высокой плотности), снижение уровня триглицеридов и концентрации фибриногена в плазме крови.
Можно рассчитывать на то, что в течение нескольких ближайших лет проблема внедрения препаратов группы статинов в клиническую практику будет успешно решена, и это существенно расширит научный поиск в сфере борьбы с атеросклерозом.
Примечание.
В статье используются ссылки на авторов оригинальных сообщений, представленных на XI Международном симпозиуме по проблемам атеросклероза (Париж, 5 — 9 октября 1997 г.). (См. Atherosclerosis, 1997, v. 134 (1,2), P. 1 — 420.)
Применение статинов в кардиологической практике
Для реального снижения частоты основных сердечно-сосудистых заболеваний (ССЗ) и смертности от них нужны эффективные меры по первичной и вторичной профилактике. Как показывает опыт США и стран Западной Европы, наибольший вклад
Для реального снижения частоты основных сердечно-сосудистых заболеваний (ССЗ) и смертности от них нужны эффективные меры по первичной и вторичной профилактике. Как показывает опыт США и стран Западной Европы, наибольший вклад в снижение смертности от ССЗ привносит государственная (национальная — в западном понимании) образовательная программа. Она особенно эффективна при высокой и очень высокой смертности от указанных заболеваний. Благодаря подобной программе США сократили смертность от ССЗ на 50%, а Финляндия — на 61%, снижая смертность ежегодно на 2,5% и 3% соответственно (NIH, NHLBI, Fact Book, 2004).
Вторичная профилактика также снижает смертность в стране, но в меньшей степени, чем первичная, и обходится существенно дороже. Если первичная профилактика преимущественно строится на изменении образа жизни и устранении факторов риска, то вторичная профилактика осуществляется в основном за счет комплексного весьма продолжительного применения лекарственных средств и дорогостоящих оперативных вмешательств.
В таблице 1 представлены наиболее важные средства и методы лечения, влияющие на прогноз у пациентов с ишемической болезнью сердца (ИБС).
Среди представленных методов эффективно снижают смертность от ССЗ у практически здоровых людей с факторами риска (первичная профилактика) статины, антиатеросклеротическая диета, физические тренировки. Эти же средства (антиагреганты, b-блокаторы, ингибиторы ангиотензинпревращающего фермента — АПФ) широко используются и дают достаточно ощутимый эффект и при вторичной профилактике. Антагонисты кальция и нитраты достаточно эффективно устраняют стенокардию и ишемию миокарда, улучшают качество жизни, хотя и не влияют на смертность. Таким образом, получается, что статины, диета и физические тренировки эффективны при применении и у практически здоровых людей, имеющих факторы риска, и у больных с хроническими ССЗ атеросклеротической природы (Д. М. Аронов, 2000).
Поскольку в нашей стране в течение последних 3–4 десятилетий не предпринималось никаких государственных комплексных программ по борьбе с неуклонно и упорно возраставшей смертностью от ССЗ, а врачи и население скептически и с неохотой относятся к немедикаментозным методам по вторичной профилактике (модификация факторов риска, включая прекращение курения, соблюдение диеты, программа физических тренировок, образовательная программа), роль медикаментозных методов вторичной профилактики может стать наиболее значимой.
В этой связи особые надежды возлагаются на статины. Как видно из таблицы 1, среди медикаментозных средств, доказавших свою стратегическую эффективность, они воздействуют благоприятно на все основные причины и механизмы, ведущие к утяжелению заболевания, развитию осложнений и смерти.
Среди приведенных в таблице, патологических состояний, конечно же, важнейшим является атерогенез. По силе воздействия на атерогенез ни одно из перечисленных в таблице терапевтических мероприятий не может сравниться со статинами, за исключением программы физических тренировок.
В двух рандомизированных исследованиях (Гейдельберг, ФРГ) показано, что программа физических тренировок на фоне антиатеросклеротической диеты уже через год достоверно снижает частоту прогрессирования коронарного атеросклероза и вызывает его частичное обратное развитие (Schuler и соавт., 1992; J. Niebauer и соавт., 1995). Эти два исследования включают в себя в общей сложности всего лишь 203 больных ИБС. Подобных работ со статинами выполнено намного больше и число включенных в них больных также несопоставимо больше, чем при исследованиях с физическими тренировками. В пять исследований (монотерапия с применением ловастатина, симвастатина, правастатина и флувастатина) включен 1831 больной. В других четырех исследованиях, где статины сочетались с другими препаратами, включено 726 больных. В этих работах больные наблюдались от 2 до 5 лет. Таким образом, результаты работ по изучению регресса коронарного атеросклероза с помощью повторных ангиографических исследований с применением статинов и физических тренировок не могут считаться сопоставимыми. Коронарографическая оценка эффективности лечения выполнена для схем с применением статинов старой генерации — с ловастатином, симвастатином, правастатином, флувастатином. В последние два года завершены принципиально новые исследования по количественному изучению регресса коронарного атеросклероза. Речь идет о результатах повторного внутрикоронарного ультразвукового исследования (УЗИ) при применении новой генерации статинов — аторвастатина (Nissen и соавт., 2004) и розувастатина (Nissen и соавт., 2006). В обоих исследованиях с помощью более прогрессивного метода исследования объективно изучена внутрисосудистая динамика коронарного атеросклероза и установлено уменьшение размера бляшки, суживающей просвет артерии. Следует обратить внимание на то, что стандарт современного клинического изучения коронарного атеросклероза — контрастная коронарная ангиография — исследует диаметр просвета коронарной артерии в пораженных и непораженных участках, а внутрикоронарное УЗИ — размеры и характер самого атероматоза, что является более прогрессивным по сравнению со стандартной коронарографией методом (P. Schaenhagen и соавт., 2003).
В исследовании REVERSAL, в котором применялось повторное внутрикоронарное УЗИ, наблюдались 502 больных с ИБС. Рандомизированно больные получали максимальную дозу либо правастатина, либо аторвастатина в течение 18 мес. При сравнительно малом снижении уровня холестерина липопротеинов низкой плотности (ЛПНП) (на 25% при правастатине в дозе в 40 мг/день) за 18 мес наблюдения не удалось приостановить прогрессирование коронарного атеросклероза. При более интенсивном снижении холестерина ЛПНП (на 46% при аторвастатине в дозе 80 мг/день) наступило торможение коронарного атеросклероза. В обеих группах произошло снижение С-реактивного белка (СРБ) (на 5,2% — при правастатине; на 36,4% — при аторвастатине; Nissen и соавт., JAMA, 2004).
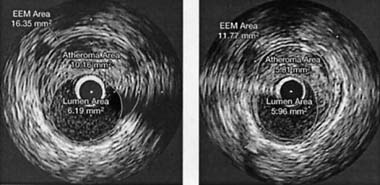 |
| Рисунок 1. Внутрикоронарное УЗИ до и после лечения розувастатином |
Таким образом, новейший статин — розувастатин оказался вполне эффективным антиатеросклеротическим средством. Это особенно важно отметить, поскольку появление розувастатина, как и любого нового препарата, воспринималось с большими надеждами и в то же время с настороженностью.
Антиатерогенное действие статинов, установленное в упоминавшихся выше исследованиях, приводит в конце концов к самому главному эффекту лечения больных атеросклерозом — к достоверному снижению смертности от ИБС и головного мозга. Причем статины эффективны как при первичной профилактике у людей с факторами риска, так и при вторичной профилактике, т. е. у больных с манифестированными заболеваниями атеросклеротического характера (табл. 2).
Как видно из таблицы 2, в первых двух исследованиях по первичной профилактике коронарной болезни сердца с совокупным числом больных более 13 000 человек, имеющих факторы риска, применялись правастатин и ловастатин. В исследовании с правастатином (Западно-шотландское исследование WOSCOPS) общая смертность от всех причин за 5 лет снизилась на 22%, собственно коронарная смертность на — 33%. Примерно такие же результаты получены и в известном американском «техасском» исследовании с ловастатином. За 5 лет фатальный и нефатальный инфаркты миокарда (ИМ) сократились в наблюдаемой популяции на 40%, потребность в реваскуляризации — на 33%, а первый крупный коронарный инцидент наблюдался на 37% реже, чем в группе плацебо.
В последнем крупном исследовании по первичной профилактике ИБС ASCOT-LLA в связи с наличием артериальной гипертонии и гиперлипидемии (при исследовании не натощак!) 10 305 больных были рандомизированы — на прием 10 мг аторвастатина или плацебо сроком на 5 лет, но Наблюдательный совет по безопасности и эффективности исследования в сентябре 2002 г. сообщил, что LLA-ветвь ASCOT показала статистически высокодостоверное снижение первичных конечных точек и инсульта (снижение на 29%, p
Д. М. Аронов, доктор медицинских наук, профессор
ГНИЦ профилактической медицины, Москва