Что такое степень окисления в химии как определить
Степень окисления элемента
Что такое степень окисления
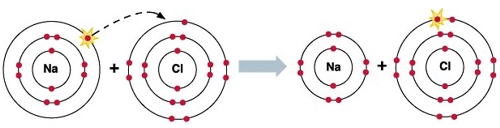
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
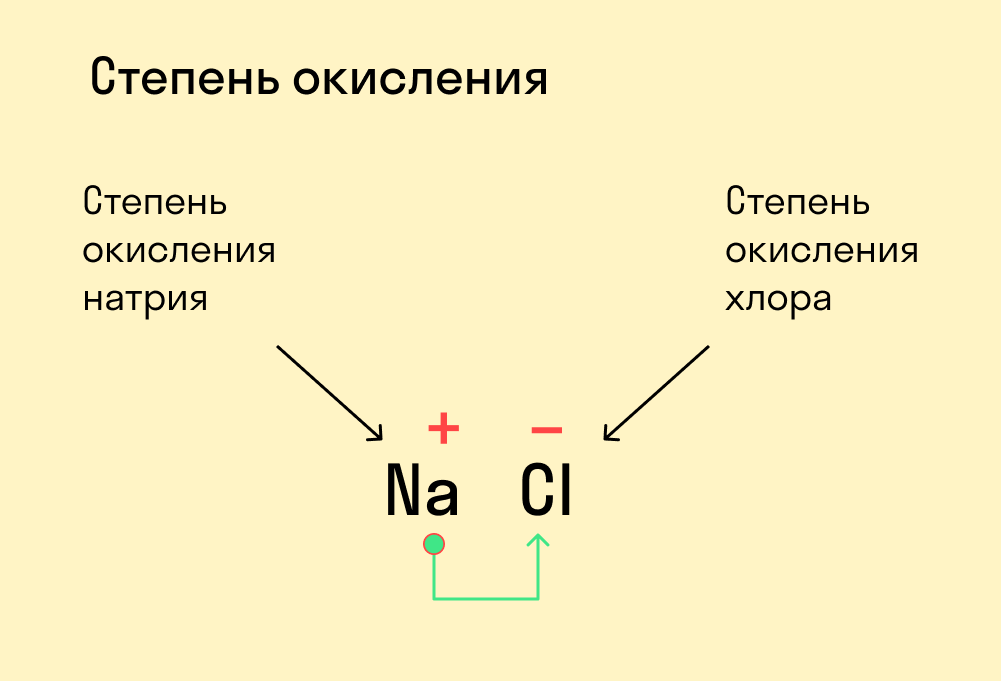
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
Запомните:
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Как рассчитать степень окисления
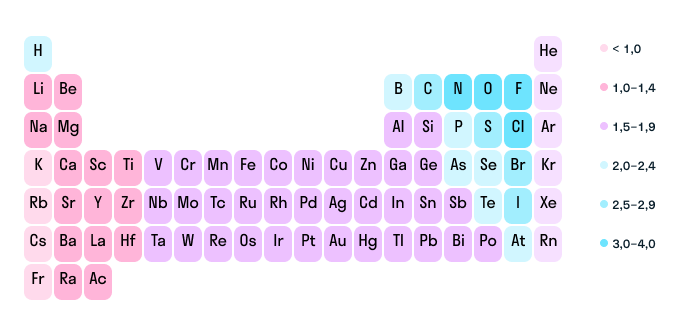
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
Шкала относительной электроотрицательности
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.
Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
Пример
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4 + равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число +1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: (+1) × 2 + х + (−2) × 4 = 0. Значит х = −6.
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Пример
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4 + формула для определения заряда азота будет следующей: х + (+1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO4 2- формула для серы х + (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен +6.
Как определить высшую и низшую степень окисления
Выделяют высшую (или максимально положительную) и низшую (максимально отрицательную) степени окисления. В диапазоне между ними располагаются окислительные числа, которые могут принадлежать данному химическому элементу в различных соединениях. Для четных групп характерны четные числа в диапазоне, а для нечетных групп — нечетные.
Высшая степень окисления совпадает с номером группы элемента (для элементов в главной подгруппе) в короткой форме периодической системы.
Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
Проиллюстрируем на примере, как найти высшую и низшую степень окисления.
Хлор (Cl), согласно короткой периодической таблице, принадлежит к группе VII. Значит, его максимальное окислительное число будет +7. Такой условный заряд элемент приобретает в оксиде хлора Cl2O7 и хлорной кислоте HClO4. Минимальное число получаем следующим образом: 7 − 8 = −1 (характерно для хлороводорода HCl).
По степени окисления можно понять, как поведет себя вещество в окислительно-восстановительных реакциях. Если в соединении главный действующий элемент имеет высшую степень окисления, оно является окислителем, а если он имеет низшую степень окисления — восстановителем.
Например, серная кислота является окислителем, поскольку у серы в данном случае заряд +6. А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную. В сероводороде заряд серы равен −2, и это минимальная степень окисления, а значит, данное вещество — восстановитель.
Как найти степень окисления в органическом соединении
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
Пример
Рассчитайте степень окисления углерода в метаноле H3C−OH.
Мы знаем, что водород Н имеет окислительное число +1, а у кислорода в данном случае оно равно −2. Составим уравнение:
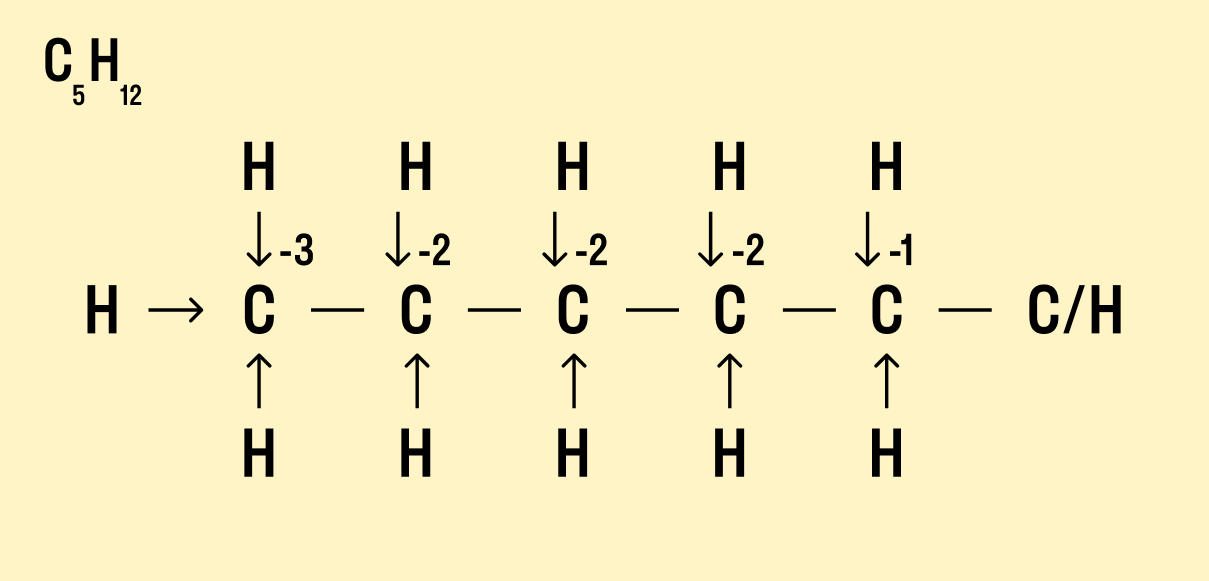
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Графический метод
Нарисуйте структурную формулу соединения.
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это «+»), а затем суммируйте «+» и «−», чтобы узнать степень окисления.
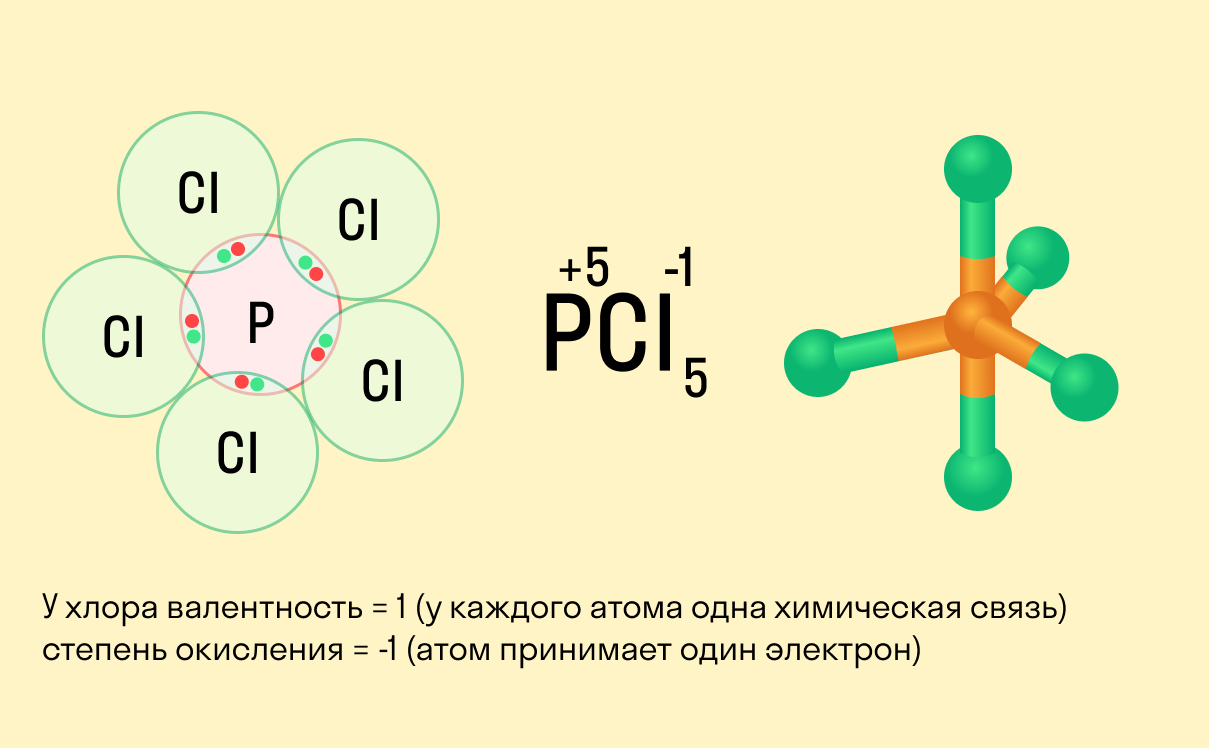
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Между этими двумя понятиями есть следующие отличия:
валентность не имеет знака, в то время как у окислительного числа он есть («+» или «−»);
валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
Вопросы для самопроверки
Почему степень окисления называют формальным зарядом, условным?
Что отражает численная величина степени окисления?
Чему равна сумма всех окислительных чисел в ионе?
Как определить низшую степень окисления?
Как найти две неизвестных степени окисления в одном веществе?
Как определять степени окисления в органических веществах?
Степень окисления для «чайников»
Степень окисления или окислительное число дает количественную характеристику состояния атома в соединении.
| Степень окисления — условный заряд атома в соединении, если предположить, что соединение состоит только из ионов |
Исходя из вышесказанного, в окислительно-восстановительных реакциях вычисляют неизвестную степень окисления элементов, исходя из двух моментов:
Составляем и решаем уравнение:
| Высшая степень окисления — наибольшее положительное ее значение |
Высшая степень окисления является очень важной количественной характеристикой элемента, чаще всего, она равна номеру группы элемента в Периодической таблице:
| Низшая степень окисления — наименьшее возможное ее значение для данного элемента |
Если элемент имеет три и более возможных степеней окисления, то все остальные степени окисления, лежащие между высшей и низшей, называются промежуточными или средними.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Степень окисления
Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна. Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры. Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
Степени окисления бывают высшие, низшие и промежуточные.
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.
Для нахождения степеней окисления используют следующие правила :
Примеры :
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Степени окисления элементов. Как найти степени окисления?
3) Высшая степень окисления элемента, как правило, совпадает с номером группы, в которой находится данный элемент (например, фосфор находится в V группе, высшая с. о. фосфора равна +5). Важные исключения: F, O.
4) Поиск степеней окисления остальных элементов основан на простом правиле:
Несколько простых примеров на определение степеней окисления
Что делать, если неизвестны степени окисления двух элементов
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение!
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте «разделить» молекулу на несколько частей.
Как расставлять степени окисления в органических соединениях
Не смешивайте понятия «валентность» и «степень окисления»!
Степень окисления часто путают с валентностью. Не совершайте подобной ошибки. Перечислю основные отличия:
Небольшой тест на тему «Степень окисления»
Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов!
Для желающих еще немного потренироваться рекомендую соответствующий тематический тест.
Что это такое
В химии описание различных окислительно-восстановительных процессов не обходится без степеней окисления – специальных условных величин, при помощи которых можно определить заряд атома какого-либо химического элемента.
Если представить степень окисления (не путайте с валентностью, так как во многих случаях они не совпадают) как запись в тетради, то мы увидим просто цифры со знаками ноль (0 – в простом веществе), плюс (+) или минус (-) над интересующим нас веществом. Как бы то ни было, они играют огромную роль в химии, а умение определять СО(степень окисления) – это необходимая база в изучении данного предмета, без которой дальнейшие действия смысла не имеют.
Мы используем СО, чтобы описать химические свойства вещества (или отдельного элемента), верного написания его международного названия (понятного для любой страны и нации вне зависимости от используемого языка) и формулы, а также для классификации по признакам.
Степень может быть трёх видов: высшая (для её определения требуется знать, в какой группе находится элемент), промежуточная и низшая (необходимо из числа 8 вычесть номер группы, в которой располагается элемент; естественно, цифра 8 берётся потому, что всего в периодической системе Д.Менделеева 8 групп). Подробно об определении степени окисления и правильном её расставлении будет сказано ниже.
Как определяется степень окисления: постоянная СО
Во-первых, СО может быть переменной или постоянной
Определение постоянной степени окисления не составляет большого труда, поэтому урок лучше начинать именно с неё: для этого необходимо только умение пользоваться ПС (периодической системой). Итак, существует ряд определённых правил:
На основе данных сведений расставляются степени окисления во множестве сложных веществ, описываются окислительно-восстановительные реакции и прочее, однако об этом позже.
Переменная СО
Некоторые химические элементы отличаются тем, что имеют не одну степень окисления и меняют её в зависимости от того, в какой формуле стоят. Согласно правилам сумма всех степеней также должна равняться нулю, но для её нахождения необходимо проделать некоторые вычисления. В письменном варианте это выглядит как просто алгебраическое уравнение, но со временем мы «набиваем руку», и не составляет труда составить и быстро выполнить весь алгоритм действий мысленно.
Разобраться на словах будет не так легко, и лучше сразу перейти к практике:
Дополнительные упражнения можно будет найти в конце, но прежде всего нам требуется определить, какие элементы имеют переменную степень окисления. В принципе, все элементы, не считая первых трёх групп, меняют свои степени. Наиболее ярким примером служат галогены (элементы VII группы, не считая фтора F), IV группа и благородные газы. Ниже вы увидите перечень некоторых металлов и неметаллов с переменной степенью:
Это лишь небольшое количество элементов. Чтобы научиться определять СО, требуется изучение и практика, однако это не значит, что нужно заучивать все постоянные и переменные СО наизусть: просто запомните, что последние встречаются значительно чаще. Зачастую немалую роль играет коэффициент и то, какое вещество представлено – к примеру, в сульфидах отрицательную степень принимает сера (S), в оксидах – кислород (O), в хлоридах – хлор (Cl). Следовательно, в этих солях положительную степень принимает другой элемент (и называется в данной ситуации восстановителем).
Решение задач на определение степени окисления
Теперь мы подошли к самому главному – практике. Попробуйте выполнить следующие задания сами, а затем посмотрите разборку решения и сверьте ответы:
Краткое заключение
Чтобы научиться определять степень окисления самостоятельно, вам нужно не только уметь составлять уравнения, но и основательно взяться за изучение свойств элементов различных групп, вспомнить уроки алгебры, составляя и решая уравнения с неизвестной переменной.
Не забывайте, что в правилах есть свои исключения и о них нельзя забывать: речь идёт об элементах с переменной СО. Также для решения многих задач и уравнений необходимо умение расставлять коэффициенты (и знать, с какой целью это делается).