Что такое взаимодействие молекул
Урок 4. Взаимодействие молекул
В уроке 4 «Взаимодействие молекул» из курса «Химия для чайников» выясним что из себя представляет межмолекулярное взаимодействие; рассмотрим влияние сил Ван-дер-Ваальса на температуры плавления и кипения; определим роль электроотрицательности в образовании ковалентной полярной и водородной связи. Но нельзя обсуждать взаимодействие молекул, не зная их строения, поэтому не пройдите мимо прошлого урока «Схема образования молекул».
Межмолекулярное взаимодействие
Между молекулами в веществе всегда присутствует некоторое притяжение друг к другу, которое называется межмолекулярным взаимодействием. Притяжение молекул друг к другу не такое сильное, как взаимодействие между атомами в молекуле, и недостаточно для образования химических связей, но достаточно для того, чтобы сделать их слегка «клейкими» друг к другу.
Силы Ван-дер-Ваальса
Силы взаимодействия молекул, вызываемые мгновенными флюктуациями распределения электронов в атомах, называются силами Ван-дер-Ваальса. Заумно прозвучало? Далее все встанет на свои места. Силы Ван-дер-Ваальса являются одним из видов межмолекулярного взаимодействия, но можно считать эти силы взаимодействия молекул основными. Просто запомните, что именно благодаря силам Ван-дер-Ваальса в природе существуют три агрегатных состояния вещества.
Температура плавления и кипения
Ковалентная полярная химическая связь
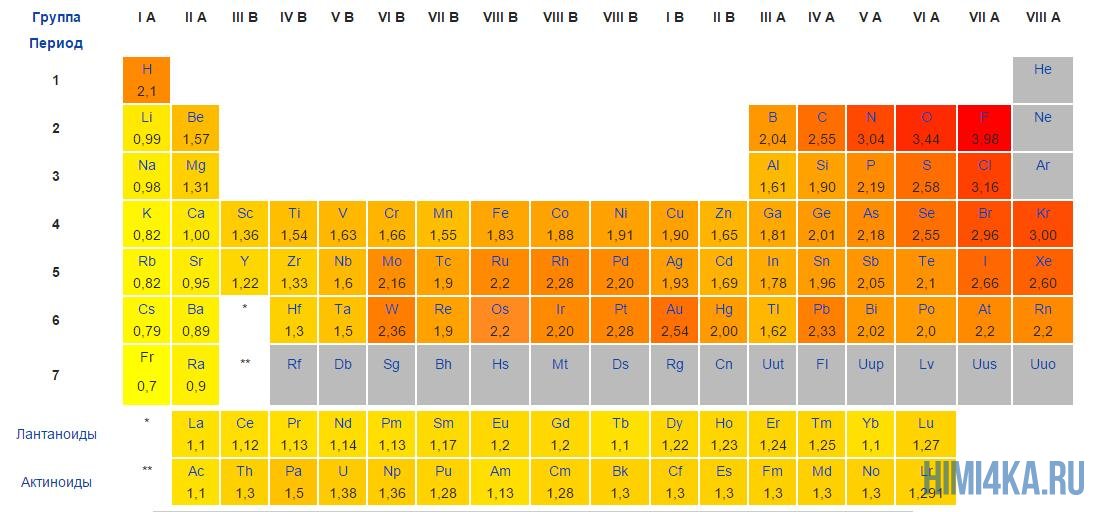
«Силу» атома определяет его электроотрицательность: чем больше электроотрицательность химического элемента, тем сильнее он притягивает к себе электроны.
Постарайтесь запомнить самые электроотрицательные химические элементы в порядке возрастания их электроотрицательности: I, Br, N, Cl, O, F. За помощью вы всегда можете обратиться к таблице электроотрицательности, которая расположена ниже.
Образование водородной связи
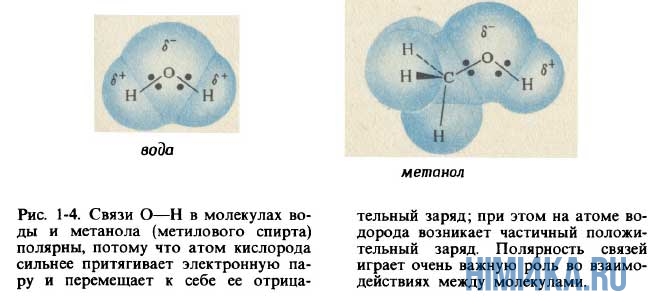
Очевидно, что молекулы воды образованы ковалентной полярной химической связью, поскольку электроотрицательность кислорода больше, чем у водорода. Поэтому атом кислорода в молекуле воды несет в себе небольшой отрицательный заряд, а атомы водорода — небольшие положительные заряды.
Надеюсь урок 4 «Взаимодействие молекул» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Что такое взаимодействие молекул
Силы взаимодействия молекул
Атом состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Заряд ядра равен суммарному заряду всех электронов, поэтому в целом атом электрически нейтрален.
Молекула, состоящая из одного или нескольких атомов, тоже электрически нейтральна.
Рассмотрим взаимодействие между молекулами на примере двух неподвижных молекул.
Между телами в природе могут существовать гравитационные и электромагнитные силы.
Так как массы молекул крайне малы, ничтожно малые силы гравитационного взаимодействия между молекулами можно не рассматривать.
На очень больших расстояниях электромагнитного взаимодействия между молекулами тоже нет.
Но, при уменьшении расстояния между молекулами молекулы начинают ориентироваться так, что их обращенные друг к другу стороны будут иметь разные по знаку заряды (в целом молекулы остаются нейтральными), и между молекулами возникают силы притяжения.
При еще большем уменьшении расстояния между молекулами возникают силы отталкивания, как результат взаимодействия отрицательно заряженных электронных оболочек атомов молекул.
В итоге на молекулу действует сумма сил притяжения и отталкивания. На больших расстояниях преобладает сила притяжения (на расстоянии 2-3 диаметров молекулы притяжение максимально), на малых расстояниях сила отталкивания.
Существует такое расстояние между молекулами, на котором силы притяжения становятся равными силам отталкивания. Такое положение молекул называется положением устойчивого равновесия.
Находящиеся на расстоянии друг от друга и связанные электромагнитными силами молекулы обладают потенциальной энергией.
В положении устойчивого равновесия потенциальная энергия молекул минимальна.
В веществе каждая молекула взаимодействует одновременно со многими соседними молекулами, что также влияет на величину минимальной потенциальной энергии молекул.
Кроме того, все молекулы вещества находятся в непрерывном движении, т.е. обладают кинетической энергией.
Таким образом, структура вещества и его свойства (твердых, жидких и газообразных тел) определяются соотношением между минимальной потенциальной энергией взаимодействия молекул и запасом кинетической энергии теплового движения молекул.
Строение и свойства твердых, жидких и газообразных тел
Строение тел объясняется взаимодействием частиц тела и характером их теплового движения.
Твердое тело
Твердые тела имеют постоянную форму и объем, практически несжимаемы.
Минимальная потенциальная энергия взаимодействия молекул больше кинетической энергии молекул.
Сильное взаимодействие частиц.
Тепловое движение молекул в твердом теле выражается только лишь колебаниями частиц (атомов, молекул) около положения устойчивого равновесия.
Из-за больших сил притяжения молекулы практически не могут менять свое положение в веществе, этим и объясняется неизменность объема и формы твердых тел.
Жидкость
Жидкости имеют определенный объем, но не имеют своей формы, они принимают форму сосуда, в которой находятся.
Минимальная потенциальная энергия взаимодействия молекул сравнима с кинетической энергией молекул.
Слабое взаимодействие частиц.
Тепловое движение молекул в жидкости выражено колебаниями около положения устойчивого равновесия внутри объема, предоставленного молекуле ее соседями
Молекулы не могут свободно перемещаться по всему объему вещества, но возможны переходы молекул на соседние места. Этим объясняется текучесть жидкости, способность менять свою форму.
В жидкостях молекулы достаточно прочно связаны друг с другом силами притяжения, что объясняет неизменность объема жидкости.
В жидкости расстояние между молекулами равно приблизительно диаметру молекулы. При уменьшении расстояния между молекулами (сжимании жидкости) резко увеличиваются силы отталкивания, поэтому жидкости несжимаемы.
По своему строению и характеру теплового движения жидкости занимают промежуточное положение между твердыми телами и газами.
Хотя разница между жидкостью и газом значительно больше, чем между жидкостью и твердым телом. Например, при плавлении или кристаллизации объем тела изменяется во много раз меньше, чем при испарении или конденсации.
Газы не имеют постоянного объема и занимают весь объем сосуда, в котором они находятся.
Минимальная потенциальная энергия взаимодействия молекул меньше кинетической энергии молекул.
Частицы вещества практически не взаимодействуют.
Газы характеризуются полной беспорядочностью расположения и движения молекул.
Расстояние между молекулами газа во много раз больше размеров молекул. Малые силы притяжения не могут удержать молекулы друг около друга, поэтому газы могут неограниченно расширяться.
Газы легко сжимаются под действием внешнего давления, т.к. расстояния между молекулами велики, а силы взаимодействия пренебрежимо малы.
Давление газа на стенки сосуда создается ударами движущихся молекул газа.
Взаимодействие молекул в физике с примерами
Взаимодействие молекул:
Оглядитесь вокруг, и вы увидите множество физических тел. Это и ваш сосед, с которым вы сидите за партой, и сама парта. Это и стул, на котором вы сидите, и ручка, которой вы пишете, и т. п. Все эти тела, как вы уже знаете, состоят из разделенных промежутками частичек, которые постоянно двигаются. Тогда почему частички, из которых состоят физические тела, не разлетаются во все стороны? Более того, тела не только не рассыпаются на отдельные моле кулы — наоборот, чтобы их растянуть, сломать, разорвать, нужно приложить усилие. Попробуем разобраться, почему так.
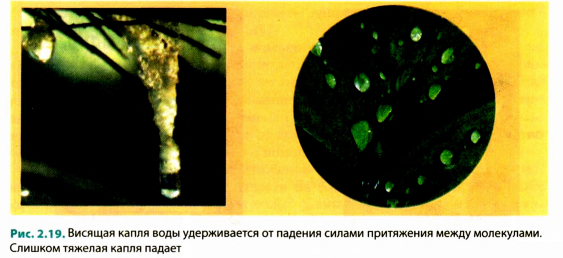
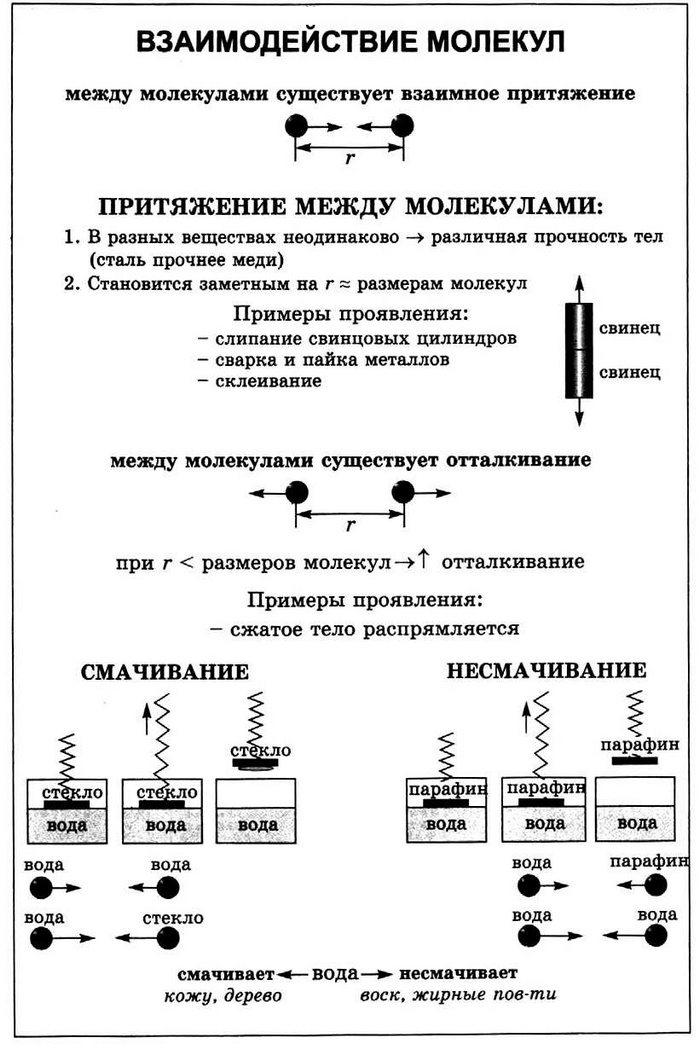
Причина того, что все тела вокруг нас не распадаются на отдельные молекулы, очевидна: молекулы притягиваются друг к другу. Каждая молекула притягивается к соседним молекулам, а те, в свою очередь,— к ней. Именно благодаря межмолекулярному притяжению твердые тела сохраняют свою форму, жидкость собирается в капли (рис. 2.19), скотч прилипает к бумаге, чернила оставляют след на листе, прижатые друг к другу срезами свинцовые цилиндры крепко схватываются (рис. 2.20).
В науке установлено, что притяжение между молекулами действует всегда. Почему же тогда разбитая чашка не становится целой после того, как ее обломки прижмут друг к другу? С какой бы силой мы ни прижимали друг к другу части сломанного карандаша, они также не соединятся в целый карандаш.
Дело в том, что притяжение между молекулами становится заметным только на очень малых расстояниях (таких, которые можно сравнить с размерами самих частичек). Прижимая обломки чашки или части сломанного карандаша, мы приближаем на такие расстояния только очень малое количество молекул. Расстояние же между большинством из них остается таким, что молекулы практически не взаимодействуют. Теперь становится понятным, почему для того, чтобы свинцовые цилиндры слиплись, необходимо предварительно отшлифовать срезы, а кусочки мягкого воска или пластилина легко слипнутся и без всякого шлифования.
Два сухих листа невозможно сблизить настолько, чтобы они соединились. Однако если смочить листы водой, то они слипнутся, так как молекулы воды приблизятся к молекулам бумаги настолько, что межмолекулярное притяжение уже будет удерживать листы друг возле друга (рис. 2.21).
Межмолекулярное притяжение также является причиной смачивания или несмачивания тела определенными жидкостями (рис. 2.22).
Межмолекулярное отталкивание:
Выше мы доказали, что между молекулами существует притяжение. Учитывая это, возникает целый ряд вопросов. Почему же молекулы газов, в беспорядке двигаясь и постоянно сталкиваясь между собой, не слипаются
Рис. 2.22. Капелька воды растекается по поверхности чистого стекла (смачивает ее), поскольку притяжение между молекулами жидкости больше, чем между молекулами жидкости и стекла (о). Притяжение между молекулами воды больше, чем между молекулами воды и жира, которым покрыты перья водоплавающих птиц поэтому вода не смачивает их (вспомните выражение «как с гуся вода») (б) в один большой ком? Почему, если сжать, например, губку, она через некоторое время восстановит свою форму?
Дело в том, что молекулы не только притягиваются друг к другу, но и отталкиваются. Если расстояние между ними станет очень малым (немного меньше размера молекулы), то межмолекулярное отталкивание становится более сильным, чем притяжение. Попробуйте сжать, например, монетку. Вы не сможете заметно уменьшить ее размеры, так как молекулы монетки будут отталкиваться друг от друга. Так же вы не сможете заметно уменьшить объем жидкости даже с помощью мощного пресса.
Именно межмолекулярное притяжение и отталкивание удерживает молекулы жидкостей и твердых веществ на более или менее определенных расстояниях, которые приблизительно равны размерам самих молекул. В случае уменьшения расстояния молекулы начинают отталкиваться друг от друга, а в случае увеличения — притягиваться, поэтому как для сближения, так и для отдаления молекул необходимо приложить усилие.
Молекулы взаимодействуют между собой: они одновременно притягиваются и отталкиваются. Межмолекулярное взаимодействие проявляется на расстояниях, которые можно сравнить с размерами самих молекул.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Что такое взаимодействие молекул
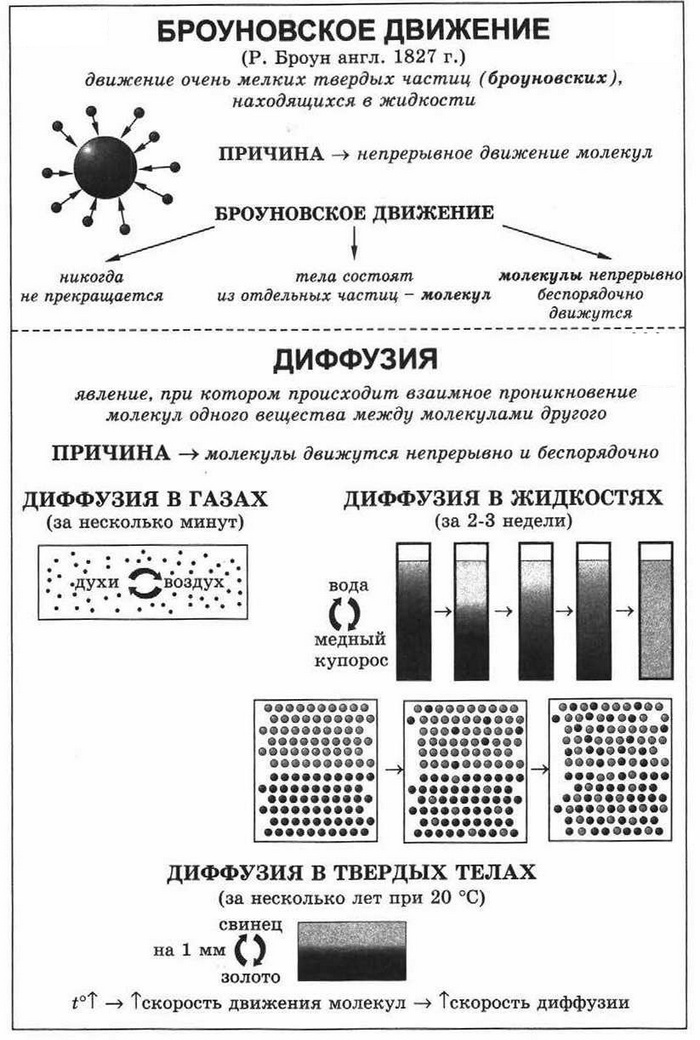
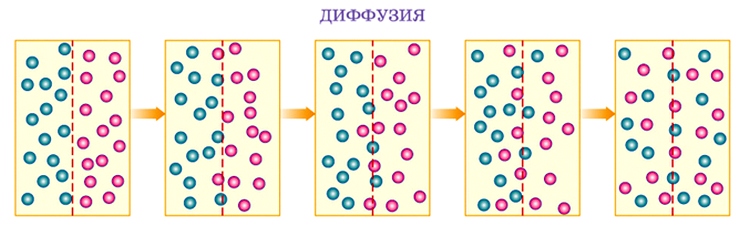
Диффузия — явление проникновения молекул одного вещества в промежутки между молекулами другого вещества.
Мы ощущаем запах духов на некотором расстоянии от флакона. Это объясняется тем, что молекулы духов, так же как и молекулы воздуха, движутся. Между молекулами существуют промежутки. Молекулы духов проникают в промежутки между молекулами воздуха, а молекулы воздуха — в промежутки между молекулами духов.
Опыты показывают, что диффузии в газах — самый быстрый процесс, в жидкостях он протекает гораздо медленнее, но может наблюдаться даже в твердых телах. Соединив гладко отполированными поверхностями два бруска из разных металлов, например из меди и алюминия, и оставив их в таком положении на длительное время (на 4—5 лет), мы обнаружим их сращивание за счет проникновения атомов меди в алюминиевый образец и, наоборот, проникновения атомов алюминия в медный.
Диффузия в газах происходит быстрее, чем в жидкостях, потому, что газы имеют меньшую плотность, чем жидкости, т.е. молекулы газов расположены на больших расстояниях друг от друга. Ещё медленнее происходит диффузия в твёрдых телах, поскольку молекулы твёрдых тел находятся ещё ближе друг к другу, чем молекулы жидкостей.
Скорость диффузии зависит не только от агрегатного состояния вещества, но и от температуры. При более высокой температуре диффузия будет происходить быстрее. Это происходит потому, что при повышении температуры быстрее движутся молекулы. Скорость движения молекул и температура тела взаимосвязаны. Чем больше средняя скорость движения молекул тела, тем выше его температура.
Проявление диффузии: окрашивание, склеивание, проникновение питательных веществ из кишечника в кровь.
Конспект урока «Диффузия. Взаимодействие молекул».
Движение молекул в физике в газах, жидкостях и твёрдых телах с примерами
Содержание:
Движение молекул:
Почему запах духов распространяется по всей комнате? Могут ли «срастись» два кусочка металла? От чего зависит скорость движения атомов и молекул? На эти и другие вопросы вы сможете ответить, прочитав этот параграф.
Тепловое движение
В соответствии с современными представлениями, атомы и молекулы, из которых состоит вещество, находятся в беспрерывном хаотическом движении. Такое движение называется тепловым.
Тепловое движение невозможно увидеть невооруженным глазом, ведь размеры молекул очень малы.
Однако существует много физических явлений, объяснить которые можно только опираясь на тот факт, что молекулы постоянно двигаются.
Определение диффузии
Бесспорным доказательством движения молекул служит физическое явление, хорошо известное вам из курса природоведения,— диффузия (от лат. diffusio — распространение, растекание).
Напомним, что диффузией называют взаимное проникновение соприкасающихся веществ друг в друга, происходящее в результате теплового (хаотического) движения молекул (атомов).
Диффузия в газах и жидкостях
Вспомните, что происходит, если где-то в комнате разлить ароматное вещество, например духи,— его запах в скором времени будет ощущаться повсюду. Это значит, что молекулы ароматного вещества, двигаясь, попадают в промежутки между молекулами воздуха, которым заполнена комната, т. е. наблюдается диффузия. Именно в результате диффузии в газах мы ощущаем запах свежеиспеченного хлеба из булочной или запах прогретой солнцем травы.
Диффузию можно наблюдать и в жидкостях. Проведем такой опыт. В прозрачный сосуд с чистой водой с помощью воронки нальем раствор медного купороса так, чтобы жидкости не смешались (рис. 2.15). Сначала мы наблюдаем резкую границу между водой и раствором медного купороса. Оставив сосуд в покое на несколько дней, мы увидим, что вся жидкость в сосуде приобрела бирюзовый цвет (рис. 2.16). Причем перемешивание жидкостей произошло без вмешательства извне. Схематически процесс диффузии изображен на рис. 2.17. Многочисленные опыты свидетельствуют, что диффузия в жидкостях протекает значительно медленнее, чем в газах. Еще медленнее происходит диффузия в твердых телах. Почему? Ответ на этот вопрос следует искать в особенностях расположения молекул газов, жидкостей и твердых тел.
Как связаны скорость движения молекул и температура
Приготовим два сосуда, как показано на рис. 2.15. Один из сосудов поставим в теплое место, второй — в холодное. Посмотрев через некоторое время на сосуды, мы убедимся, что в теплом растворе диффузия произошла намного быстрее.
В случае повышения температуры скорость диффузии в газах также увеличивается.
Зависимость скорости диффузии от температуры особенно заметна для твердых тел. Так, английский металлург Вильям Роберт Остин провел следующий опыт. Он наплавил тонкий диск золота на свинцовый цилиндр (рис. 2.18, а) и на несколько дней поместил этот цилиндр в печь, где поддерживалась температура около 400 °С. Оказалось, что золото продиф-фундировало через весь цилиндр (рис. 2.18, б); тем временем при комнатной температуре диффузия практически не наблюдалась.
Таким образом, мы выяснили, что чем выше температура вещества, тем быстрее происходит диффузия, т. е. молекулы быстрее двигаются.
Довольно сложные эксперименты показывают, что при любой температуре в веществе есть молекулы, двигающиеся довольно медленно, и молекулы, скорость которых высока. Если количество молекул вещества, имеющих высокую скорость, увеличивается, т. е. увеличивается средняя скорость молекул, то это значит, что температура вещества также увеличивается.
Диффузия в природа и ее применение в технике
Явление диффузии очень распространено в природе. Благодаря диффузии углекислый газ попадает в листву растений; кислород из воздуха — на дно водохранилищ; питательные вещества впитываются в кишечнике; кислород из легких попадает в кровь, а из крови — в ткани и т. д.
Диффузию широко применяют в технике. Одним из примеров является диффузное сваривание металлов. Куски металлов крепко прижимают друг к другу, нагревают до высокой
температуры, но ниже температуры плавления. В месте соединения происходит диффузия, и куски металлов как будто срастаются.
Атомы и молекулы, из которых состоит вещество, находятся в беспрерывном хаотическом движении. Такое движение называется тепловым, поскольку увеличение температуры вещества соответствует увеличению средней скорости движения его молекул (атомов).
Одним из доказательств движения частиц вещества является физическое явление, которое называется диффузией. Диффузия — взаимное проникновение соприкасающихся веществ друг в друга, происходящее в результате теплового хаотического движения молекул (атомов).
Движение и взаимодействие молекул
Что такое броуновское движение
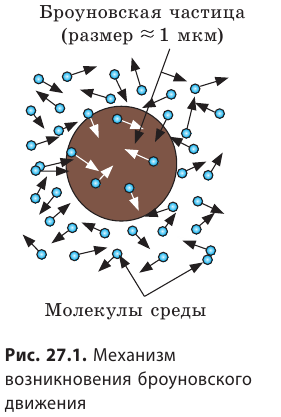
Броуновское движение — хаотическое движение видимых в микроскоп малых макрочастиц, взвешенных в жидкости или газе, которое происходит под действием ударов молекул.
Это явление названо в честь шотландского ботаника Роберта Броуна (1773–1858), который первым наблюдал его в 1827 г. Рассматривая в микроскоп взвешенные в воде частички пыльцы, Броун заметил, что они непрерывно движутся, постоянно изменяя скорость.
Причина броуновского движения — хаотическое движение молекул жидкости или газа. Двигаясь, молекулы среды непрерывно бомбардируют взвешенную в ней макрочастицу (рис. 27.1). Если суммарная сила ударов с одной стороны случайно окажется больше, чем с другой, то макрочастица может начать движение; потом другие толчки изменят ее скорость.
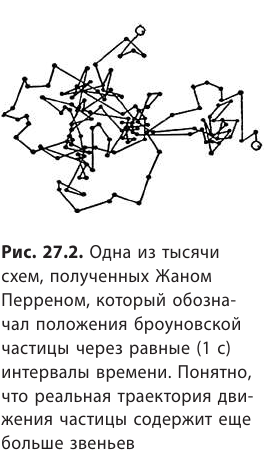
Теория броуновского движения, созданная А. Эйнштейном и польским физиком M. Смолуховским в 1905–1906 гг. и экспериментально подтвержденная французским физиком Ж. Перреном (рис. 27.2), окончательно закрепила победу атомистики.
Что такое диффузия и где ее применяют
Непрерывное хаотическое движение молекул происходит внутри любого макроскопического тела. В курсе физики 7 класса вы изучали диффузию — еще одно явление, обусловленное таким движением (от лат. diffusio — распространение, растекание).
Диффузия — процесс взаимного проникновения молекул одного вещества между молекулами другого, происходящий вследствие теплового движения молекул.
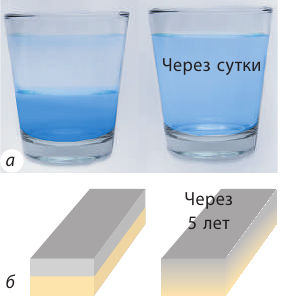
Если в стакан с водой налить подкрашенный сахарный сироп, спустя некоторое время вода в стакане окрасится и станет сладкой (рис. 27.3, а).
Рис. 27.3. Диффузия в жидкостях и твердых телах. Вследствие теплового хаотического движения молекул сироп смешался с водой в течение суток (а), две отшлифованные и прижатые друг к другу пластины свинца и золота «срослись» на 1 мм в течение 5 лет (б)
Диффузия в жидкости происходит довольно медленно, а в твердых телах она медленнее в сотни и тысячи раз (рис. 27.3). В газах диффузия протекает гораздо быстрее, чем в жидкостях, но все равно: если бы не было конвекции, запах духов распространялся бы в комнате часами. Отметим, что в любых средах скорость диффузии увеличивается с повышением температуры и давления.
Диффузные процессы очень важны для получения и обработки некоторых материалов. Диффузия в твердых телах обеспечивает соединение металлов при сварке, пайке, никелировании. С помощью диффузии поверхностный слой металлических изделий насыщают углеродом, обеспечивая их прочность (рис. 27.4).
Рис. 27.4. Цементация — процесс насыщения поверхностного слоя стали углеродом. если изготовить деталь из низкоуглеродистой стали, а затем поместить ее в высокотемпературную смесь, содержащую углерод, то благодаря диффузии поверхностный слой стали обогатится углеродом. Полученная деталь одновременно будет твердой (снаружи — крепкий чугун) и не будет разрушаться при ударных нагрузках (внутри — упругая сталь)
Разновидностью диффузии является осмос (от греч. osmos — толчок, давление) — процесс односторонней диффузии сквозь полупроницаемую перегородку (мембрану) молекул растворителя в сторону большей концентрации растворенного вещества. Например, если острым ножом отрезать дольку лимона, то сок практически не выделится; если посыпать дольку сахаром, то сок появится. Выделяясь из лимона, сок как бы стремится разбавить концентрированный раствор сахара, образовавшийся на срезе.
В природе благодаря осмосу питательные вещества и вода проникают из почвы в корни растений, из пищеварительного тракта — в организмы живых существ и непосредственно в клетки; кислород из легочных альвеол поступает в кровь и т. п. В промышленности осмос используют для очистки воды, производства напитков, получения некоторых полимеров.
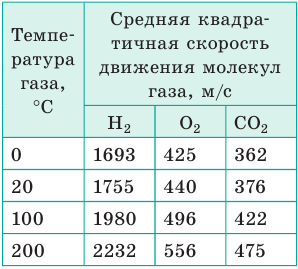
Как быстро движутся молекулы
Молекулы в газах движутся очень быстро — со скоростью пули (см. таблицу), но далеко «улететь» не могут, поскольку ежесекундно испытывают более миллиарда столкновений с другими молекулами. Поэтому траектории движения молекул представляют собой сложные ломаные линии, подобные траектории движения броуновской частицы.
Обратите внимание! В веществе всегда есть молекулы, движущиеся медленно, и молекулы, скорость движения которых огромна. В результате столкновений скорости молекул непрерывно изменяются. Описать движение даже одной молекулы невозможно, да и не нужно. Важно знать, к какому результату приводит движение всей совокупности молекул данного объекта.
Как была измерена скорость движения молекул
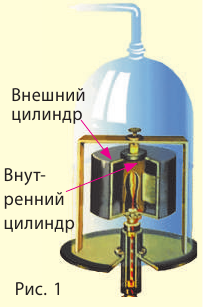
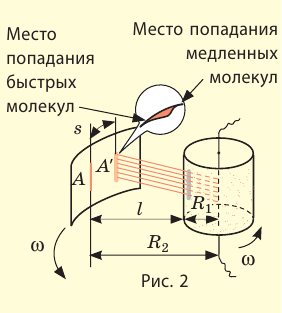
Впервые скорость движения молекул измерил немецкий физик Отто Штерн (1888–1969) в 1920 г. Для опыта Штерн изготовил устройство (см. рис. 1), состоящее из двух жестко связанных пустых цилиндров, надетых на общую ось; стенка внутреннего цилиндра имела щель. Вдоль оси была натянута металлическая нить, покрытая слоем серебра. Воздух из цилиндров был откачан. Когда по нитке пропускали ток, серебро испарялось и внутренний цилиндр заполнялся атомами Аргентума, часть которых проходила сквозь щель и оседала на внутренней стенке внешнего цилиндра. В результате напротив щели образовывалась тонкая полоска серебра (А на рис. 2).
При вращении цилиндров полоска серебра становилась размытой и образовывалась не напротив щели, а на определенном расстоянии s от полоски А (полоска A’). Ведь пока атомы Аргентума проходили расстояние l (см. рис. 2), цилиндры поворачивались. Чем быстрее двигались атомы, тем ближе к полоске А они оседали.
Зная радиусы цилиндров, угловую скорость ω их вращения и измерив расстояние s, Штерн определил скорости v движения атомов Аргентума. Действительно, время движения атомов от щели до внешнего цилиндра равна 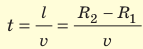
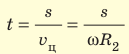
Таким образом, 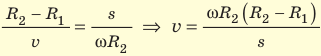
Как и почему взаимодействуют молекулы
Убедиться в том, что молекулы притягиваются друг к другу, достаточно просто. Попробуйте, например, разорвать стальную проволоку или разломить кирпич — это будет сложно, хотя предметы состоят из отдельных частиц. Тот факт, что твердые тела и жидкости не распадаются на отдельные молекулы, превращаясь в газ, тоже говорит о том, что между молекулами существуют силы притяжения. Вместе с тем молекулы отталкиваются друг от друга. В этом легко убедиться, попробовав сжать ту же проволоку или тот же кирпич, — вряд ли вам это удастся.
МКТ утверждает: между молекулами одновременно существуют как силы притяжения, так и силы отталкивания. Основная причина наличия этих сил — электрическое притяжение и отталкивание заряженных частиц, образующих атом: положительно заряженное ядро одного атома притягивается к отрицательно заряженному электронному облаку другого атома; вместе с тем и ядра атомов отталкиваются друг от друга, и электронные облака. Если расстояние r между молекулами меньше размеров d самих молекул (r d) начинают преобладать силы притяжения и молекулы притягиваются друг к другу. Таким образом, на расстоянии r=d молекулы находятся в состоянии устойчивого равновесия: при отклонениях молекулы от этого положения межмолекулярные силы стремятся вернуть ее в состояние равновесия.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.