Что такое гидроксид химия 8 класс
Основания

Всего получено оценок: 1701.
Всего получено оценок: 1701.
Один из классов сложных неорганических веществ – основания. Это соединения, включающие атомы металла и гидроксильную группу, которая может отщепляться при взаимодействии с другими веществами.
Строение
Основания могут содержать одну или несколько гидроксо-групп. Общая формула оснований – Ме(ОН)х. Атом металла всегда один, а количество гидроксильных групп зависит от валентности металла. При этом валентность группы ОН всегда I. Например, в соединении NaOH валентность натрия равна I, следовательно, присутствует одна гидроксильная группа. В основании Mg(OH)2 валентность магния – II, Al(OH)3 валентность алюминия – III.
Количество гидроксильных групп может меняться в соединениях с металлами с переменной валентностью. Например, Fe(OH)2 и Fe(OH)3. В таких случаях валентность указывается в скобках после названия – гидроксид железа (II), гидроксид железа (III).
Физические свойства
Характеристика и активность основания зависит от металла. Большинство оснований – твёрдые вещества белого цвета без запаха. Однако некоторые металлы придают веществу характерную окраску. Например, CuOH имеет жёлтый цвет, Ni(OH)2 – светло-зелёный, Fe(OH)3 – красно-коричневый.

Основания классифицируются по двум признакам:
Щёлочи образуются щелочными металлами – литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs).
Все остальные основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3, относятся к нерастворимым.
По-другому щёлочи называются сильными основаниями, а нерастворимые – слабыми основаниями. При электролитической диссоциации щёлочи быстро отдают гидроксильную группу и быстрее вступают в реакцию с другими веществами. Нерастворимые или слабые основания менее активные, т.к. не отдают гидроксильную группу.
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е. в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH)2, Al(OH)3, Pb(OH)2, Cr(OH)3, Be(OH)2 и другие основания.
Получение
Основания получают различными способами. Самый простой – взаимодействие металла с водой:
Щёлочи получают в результате взаимодействия оксида с водой:
Нерастворимые основания получаются в результате взаимодействия щелочей с солями:
Химические свойства
Основные химические свойства оснований описаны в таблице.
Реакции
Что образуется
Примеры
Соль и вода. Нерастворимые основания взаимодействуют только с растворимыми кислотами
Разложение при высокой температуре
Оксид металла и вода
С кислотными оксидами (реагируют щёлочи)
С неметаллами (вступают щёлочи)
Щелочей с некоторыми металлами
Сложная соль и водород
С помощью индикатора проводится тест на определение класса основания. При взаимодействии с основанием лакмус становится синим, фенолфталеин – малиновым, метилоранж – жёлтым.
Что мы узнали?
Из урока 8 класса химии узнали об особенностях, классификации и взаимодействии оснований с другими веществами. Основания – сложные вещества, состоящие из металла и гидроксильной группы ОН. Они делятся на растворимые или щёлочи и нерастворимые. Щёлочи – более агрессивные основания, быстро реагирующие с другими веществами. Основания получают при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щёлочи. Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разлагаются при высокой температуре.
Урок №44. Гидроксиды. Основания: классификация, номенклатура, получение
Гидроксиды
ОСНОВАНИЯ
NaOH – гидроксид натрия,
KOH – гидроксид калия,
Ca(OH) 2 – гидроксид кальция,
Fe(OH) 3 – гидроксид железа (III),
Ba(OH) 2 – гидроксид бария.
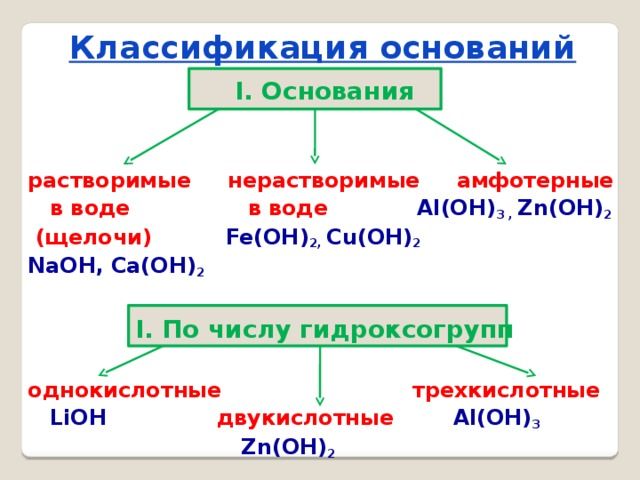
Классификация оснований
Щёлочи – это основания растворимые в воде.
К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью как кислоты.
Классификация оснований по числу групп ОН:
Физические свойства
Большинство оснований – твёрдые вещества с различной растворимостью в воде.
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ
1. Металл + H 2 O = ЩЁЛОЧЬ + Н 2 ↑
2Na + 2H 2 O = 2NaOH + H 2
2. ОКСИД МЕТАЛЛА + H 2 O = ЩЁЛОЧЬ
Na 2 O + H 2 O = 2 NaOH
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba, Ra, Sr)
СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
Ме х А у + Ме * (OH) n = Me(OH) у ↓+Ме * х А n
CuSO 4 + 2 NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
ВЫПОЛНИТЕ ЗАДАНИЯ:
№1. Классифицируйте формулы:
№2. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P 2 O 5 , Ca(OH) 2 , CO, Al(OH) 3 , BeO, Mg(OH) 2 , K 2 O, ZnO, KOH, CrO 3
№3. Приведите по два уравнения реакций получения следующих оснований:
Урок по химии для 8 класса «Гидроксиды. Основания».
Тема : Гидроксиды. Основания. Классификация. Номенклатура Получение..
Цели урока: сформировать знания о составе оснований, валентности гидроксильной группы, физических свойствах оснований, их применении; выяснить какие основания относятся к щелочам, познакомиться с их представителями; изучить правила техники безопасности при работе со щелочами;
— совершенствовать умение сравнивать вещества, выявлять
общие черты и различия в составе и свойствах оснований;
— развитие умений работать коллективно (в группах),
оценивать свои возможности и знания товарищей.
Требования к уровню подготовки учащихся, конечный результат:
— уметь определять принадлежность веществ к классу оснований,
называть основания, составлять формулы оснований.
— инструкция по технике безопасности при работе со щелочами.
На классной доске записаны формулы веществ:
Учитель приветствует учащихся, настраивает класс на деловой рабочий лад.
2.Проверка домашнего задания и усвоения основных понятий предыдущих уроков.
— учитель задает классу вопросы с целью проверки и повторения понятий:
Какие вещества называются простыми?
Какие вещества называются сложными?
Дайте определение оксидам.
На какие две группы по химическим свойствам делятся оксиды?
На какие группы делятся солеобразующие оксиды?
Дайте определение кислотных, основных и амфотерных оксидов.
— к доске вызываются отдельные учащиеся и находят и называют среди записанных формул: простые вещества, оксиды, из которых потом выбирают основные, кислотные и амфотерные (По мере определения и названия веществ – формулы их стираются).
На доске остаются формулы незнакомых для учащихся веществ: NaOH, KOH, Ca(OH) 2, Cu(OH) 2, Fe(OH) 3. Учащиеся не могут определить, к какому классу относятся данные вещества, назвать их.
3.Актуализация знаний, постановка познавательной задачи, определение темы урока.
Учитель говорит, что оставшиеся формулы веществ еще не знакомы учащимся и сегодня на уроке им предстоит познакомиться с этими веществами, они относятся к классу «Оснований». Записывается тема урока. Учитель ставит перед классом познавательную задачу:
— Какие же вещества относятся к основаниям?
4.Изучение нового материала.
Учащиеся на основании вышеустановленных признаков класса оснований самостоятельно дают определение этому классу соединений.
«Основания (гидоксиды)– это сложные вещества, состоящие из атомов металлов и гидроксильных групп».
По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента:
Основания (гидроксиды). Свойства, получение, применение

Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
Fe(OH)2 — гидроксид железа (II)
Fe(OH)3 — гидроксид железа (III)
Классификация оснований
Основания можно классифицировать по следующим признакам:
Изменение цвета индикаторов:
метиловый оранжевый – желтый
Фенолфталеин придаёт раствору щёлочи малиновую окраску
Презентация к уроку по химии на тему «Понятие о гидроксидах» (8 класс)
Описание презентации по отдельным слайдам:
«…взять ковш золы, да не простой, а еловой или от подсолнечника, замочить в дубовом ведре ключевой или дождевой водой. Постоит такая смесь сутки, потом ее надо процедить или просто слить верхний слой, развести фильтрат чистой водой, подогреть на камельке в рубленой бане и вымыть косы.»
Основания Класс: 8 Учитель: Щербина Марина Яковлевна, учитель химии 2015-2016 учебный год МБОУ «Октябрьская школа-гимназия» Красногвардейского района АР Крым
Цель урока: 1. Познакомить учащихся с новым классом неорганических соединений – основаниями. 2. Рассмотреть классификацию, состав и номенклатуру оснований.
Значение оснований Основания – один из классов неорганических веществ, который наряду с кислотами, оксидами и солями составляет основу неорганической химии. Они широко используются в разных областях химии и химической промышленности. С их помощью получают удобрения, строительные материалы, стекло. Без них мы бы лишились легких и экономичных щелочных аккумуляторов, многих медицинских препаратов.
План изучения темы: Состав, названия и определение оснований. Классификация оснований. Индикаторы. Физические свойства оснований, их значение в жизни человека.
Определение. Номенклатура. Основания – это сложные вещества, состоящие из атомов металлов и связанных с ними гидроксид-групп. Название: «гидроксид» + «металл»
Классификация оснований NaOH KOH Ba(OH)2 LiOH Cu(OH)2 Al(OH)3 Ni(OH)2 Fe(OH)2 Fe(OH)3 Нерастворимые Растворимые (щелочи)
Таблица растворимости кислот, оснований, солей
Соблюдайте правила ТБ при обращении с основаниями Растворимые основания – щелочи – могут вызвать химический ожог при попадании на незащищенные участки кожи рук и лица. Они могут разъесть кожу, ткань, бумагу и другие материалы.
Что делать? В случае попадания щелочи на одежду или участок кожи следует немедленно сообщить учителю о случившемся и сделать следующее: тщательно и обильно промыть участок кожи водой из-под крана, затем обработать это место нейтрализующим раствором борной кислоты, вновь промыть водой и смазать место ожога вазелиновым маслом. Обязательно обратиться в медпункт школы для наблюдения и оказания дальнейшей медицинской помощи.
Химические свойства оснований Щелочи изменяют окраску индикаторов Лакмус Метиловый оранжевый Фенолфталеиновый Синий Желтый Малиновый
Гидроксид кальция Ca(OH)₂ (гашеная известь)
Гидроксид калия KOH (едкое кали)
Гидроксид натрия NaOH (натр едкий, каустическая сода )
1. Что такое основание, общая формула? 2. Какими по растворимости бывают основания? 3. Как называются основания хорошо растворимые в воде? 4. Дать определение индикаторам. 5. Выбрать основания и назвать их: LiOH, K2O, BaO, Ca(OH)2.
Тест «Пятерочка» 1. Выберите формулы оснований: а) SO3 б) Mg(OH)2 в) H2SO4 г) СаО 2. К каждому из ниже указанных веществ прибавили фенолфталеин. С каким веществом появится малиновое окрашивание? а) BaO б) HNO3 в) КОН 3. Гидроксид-ион (OH) ⁻ входит в состав: а) оксидов б) оснований в) углекислого газа 4.Окраска индикаторов под действием раствора гидроксида калия меняется следующим образом: а) лакмус синеет б) Метилоранж краснеет в) фенолфталеин бесцветный 5. Выберите формулу щелочи а) КОН б) H2S в) Сu(ОН)2
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Номер материала: ДВ-450685
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Путин призвал повышать уровень общей подготовки в колледжах
Время чтения: 1 минута
При засыпании человеческий мозг может решать сложные задачи
Время чтения: 1 минута
В МГУ заработала университетская квантовая сеть
Время чтения: 1 минута
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
Петербургский Политех перевел студентов на дистанционку
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.






