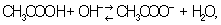Что такое полная нейтрализация
Реакция нейтрализации в химии: объяснение, примеры, уравнения и решение
Содержание:
Реакция нейтрализации – это реакция между кислотой и основанием с формированием растворимой соли и воды.
Кислота + основание = соль + вода
Как правило, эти взаимодействия сопровождаются выделением тепла. Количество выделенной энергии — это тепловой эффект взаимодействия между соединениями. Реакция нейтрализации — это один из типов реакции обмена.
Характеристика нейтрализации
Реакцию нейтрализации можно записать сокращенным ионным уравнением:
Если поместить лакмусовую бумажку в пробирку с кислотой, то она становится красной. Если ее поместить в пробирку со щелочью, то она становится синей. При взаимодействии щелочи и кислоты лакмус приобретает фиолетовый оттенок, что указывает на нейтральную среду.
Если получившийся раствор нагреть, то вода испарится, а в колбе останутся кристаллы соли.
Примеры реакций нейтрализации
Реакции нейтрализации — это реакции ионного обмена. Необратимые реакции характерны для реакций сильной кислоты и сильного основания.
Полное ионное уравнение
Сокращенное ионное уравнение
Обратимые реакции наблюдаются при взаимодействии сильного основания и слабой кислоты.
Полное ионное уравнение
Сокращенное ионное уравнение
Также обратимые реакции характерны для взаимодействий слабого основания и сильной кислоты.
Полное ионное уравнение
Сокращенное ионное уравнение
Не характерно для данной реакции.
Задачи на реакции нейтрализации
Задача. Сколько мл гидроксида натрия NaOH необходимо для нейтрализации 0,1 моль серной кислоты H2SO4, при том что плотность гидроксида натрия NaOH равна 0,968 г/мл.
Дано:
Решение:
Ответ: V(NaOH)=8,264 мл
Найти: V(NaOH)-?
Применение реакций нейтрализации
Реакции нейтрализации активно используются в титровании. Их используют при определении уровня кислотности желудочного сока. Если в лаборатории проливается щелочь, то ее нейтрализуют и убирают. Таким образом, реакции нейтрализации активно используются человеком.
Нейтрализация
Полезное
Смотреть что такое «Нейтрализация» в других словарях:
НЕЙТРАЛИЗАЦИЯ — (лат., от neuter средний, ничей). Уничтожение свойств и действий известного вещества. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. НЕЙТРАЛИЗАЦИЯ 1) в химии такое действие, посредством которого раствор совершенно … Словарь иностранных слов русского языка
нейтрализация — и, ж. neutralisation f. <лат. neutralis не принадлежащий ни тому, ни тому ни другому. 1. В международном праве объявление нейтральным (на случай войны) какого л. определенного района или государства. Нейтрализация морей. БАС 1. Шведский сейм… … Исторический словарь галлицизмов русского языка
НЕЙТРАЛИЗАЦИЯ — (от лат. neuter ни тот ни другой) (реакция нейтрализации), химическая реакция между стехиометрическими количествами кислоты и основания, приводящая к образованию соли, напр.: HCl + NaOH = NaCl + H2O НЕЙТРАЛИЗАЦИЯ в языкознании снятие… … Большой Энциклопедический словарь
НЕЙТРАЛИЗАЦИЯ — НЕЙТРАЛИЗАЦИЯ, в химии смешивание равного количества кислоты и основания (щелочи) в водной среде до получения смеси, которая не является ни кислотной, ни щелочной. РН этой смеси равно 7, что указывает на нейтральность раствора. Нейтрализация… … Научно-технический энциклопедический словарь
НЕЙТРАЛИЗАЦИЯ — НЕЙТРАЛИЗАЦИЯ, нейтрализации, жен. 1. Химическая реакция, при которой раствор утрачивает кислотные свойства присоединением щелочей или щелочные свойства присоединением кислот (хим.). 2. Объявление нейтральным на случай войны какого нибудь… … Толковый словарь Ушакова
нейтрализация — компенсация; ослабление, парализование, парализация, уничтожение Словарь русских синонимов. нейтрализация сущ., кол во синонимов: 4 • ослабление (57) • … Словарь синонимов
нейтрализация — НЕЙТРАЛИЗОВАТЬ, зую, зуешь; ованный; сов. и несов., кого что. Сделать (делать) нейтральным (в 1 и 3 знач.). Н. чьё н. влияние. Н. раствор. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Нейтрализация — Нейронные модели памяти и обучения модели нейронных сетей, направленные на изучение их способности к формированию следов памяти и извлечению записанной информации. По английски: Neutralization Синонимы английские: режима, согласно которому… … Финансовый словарь
НЕЙТРАЛИЗАЦИЯ — реакции взаимодействия сильных кислот и сильных оснований. Na++OH +Н++Сl = Na++Cl +H2O. Сводится к образованию молекул воды из ионов водорода (или гидроксония) и ионов гидроксила, при этом исчезают как “кислые” свойства ионов Н+ (кислоты), так и… … Геологическая энциклопедия
НЕЙТРАЛИЗАЦИЯ — (от лат. neuter ни тот, ни другой) англ. neutralization; нем. Neutralisierung. 1. Пресечение, прекращение к. л. воздействия, влияния, обезвреживание ч. л. 2. Объявление к. л. государства или территории нейтральным. см. НЕЙТРАЛИТЕТ. 3.… … Энциклопедия социологии
НЕЙТРАЛИЗАЦИЯ — (осредосоливанйе, или осреднение), в хим. смысле процесс уничтожения свойств свободной к ты добавлением основания или уничтожения свойств свободного основания добавлением к ты. При Н. происходит выделение тепла, и образуются два новых вещества:… … Большая медицинская энциклопедия
Нейтрализация
Из Википедии — свободной энциклопедии
Реакция нейтрализа́ции (от лат. neuter — ни тот, ни другой) — реакция взаимодействия кислоты и основания между собой с образованием соли и слабо диссоциирующего вещества (воды).
В большинстве своем, реакции нейтрализации экзотермичны. К примеру, реакция гидроксида натрия и соляной кислоты:
H C l + N a O H → N a C l + H 2 O <\displaystyle <\mathsf
В сокращенном ионном виде уравнение записывают так:
H + + O H − → H 2 O <\displaystyle <\mathsf 
К понятию нейтрализации также могут относиться реакции сильной кислоты с карбонатами, так как в результате такой реакции получается соль и угольная кислота, которая относится к слабым кислотам (не создает полноценную кислотную среду, не вступает в реакции и слабо диссоциирует), а также к нестабильным, поэтому разлагается на углекислый газ и воду — два нейтральных вещества (оксида).
Реакция нейтрализации

Всего получено оценок: 500.
Всего получено оценок: 500.
Взаимодействие кислоты и основания с образованием соли и воды называется реакцией нейтрализации. Обычно подобные реакции протекают с выделением тепла.
Общее описание
Суть нейтрализации состоит в том, что кислота и основание, обмениваясь активными частями, нейтрализуют друг друга. В результате образуется новое вещество (соль) и нейтральная среда (вода).
Простым и наглядным примером реакции нейтрализации является взаимодействие соляной кислоты и гидроксида натрия:
Если опустить лакмусовую бумажку в раствор соляной кислоты и гидроксида натрия, то она окрасится в фиолетовый цвет, т.е. покажет нейтральную реакцию (красный – кислая среда, синий – щелочная среда).
После нагревания получившегося раствора вода испарится, а в пробирке останется поваренная соль – NaCl.
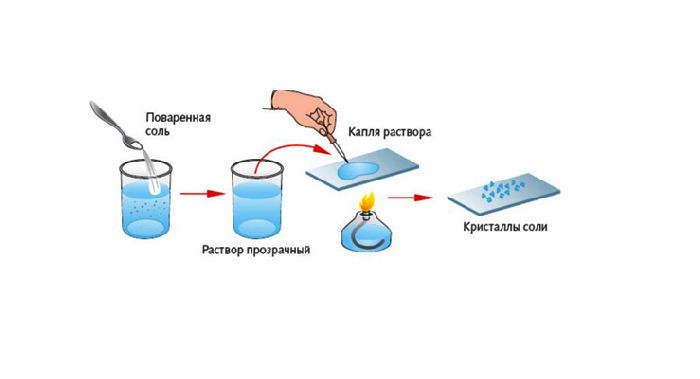
В подобных реакциях вода – обязательный продукт.
Примеры
Реакция нейтрализации может происходить между сильными и слабыми кислотами и щелочами. Рассмотрим два типа реакций:
Примером первого вида реакций является взаимодействие сильной кислоты с сильным основанием:
Обратимые реакции протекают при нейтрализации слабой кислоты сильным основанием, а также слабого основания слабой кислотой:
Слабые нерастворимые или слаборастворимые основания (Fe(OH)3, Fe(OH)2, Mg(OH)2, Zn(OH)2) также нейтрализуются сильной кислотой. Например, гидроокись меди не растворяется в воде, но при взаимодействии с азотной кислотой образует соль (нитрат меди) и воду:
Реакции нейтрализации экзотермичные, они протекают с выделением тепла.
Использование
Реакции нейтрализации – основа титриметрического анализа или титрования. Это метод количественного анализа концентрации веществ. Метод используется в медицине, например, для определения кислотности желудочного сока, а также в фармакологии.

Кроме того, важно практическое применение нейтрализации в лаборатории: при проливе кислоты её можно нейтрализовать щёлочью.
Что мы узнали?
Реакция, при которой кислота и основание образуют соль и воду, называется нейтрализацией. Эта реакция возможна между любыми кислотами и основаниями: сильной кислотой и сильной щёлочью, слабой кислотой и слабым основанием, сильным основанием и слабой кислотой, слабым основанием и сильной кислотой. Реакция протекает с выделением тепла. Нейтрализация применяется в медицине и фармакологии.
Реакция нейтрализации – примеры, типы и применение
Взаимодействие кислоты и основания с образованием соли и воды называется реакцией нейтрализации. Обычно подобные реакции протекают с выделением тепла.
Общее описание
Суть нейтрализации состоит в том, что кислота и основание, обмениваясь активными частями, нейтрализуют друг друга. В результате образуется новое вещество (соль) и нейтральная среда (вода).
Простым и наглядным примером реакции нейтрализации является взаимодействие соляной кислоты и гидроксида натрия:
HCl + NaOH → NaCl + H2O.
Если опустить лакмусовую бумажку в раствор соляной кислоты и гидроксида натрия, то она окрасится в фиолетовый цвет, т.е. покажет нейтральную реакцию (красный – кислая среда, синий – щелочная среда).
Раствор двух активных соединений превратился в воду за счёт обмена натрием и хлором, поэтому ионное уравнение данной реакции выглядит следующим образом:
После нагревания получившегося раствора вода испарится, а в пробирке останется поваренная соль – NaCl.
Рис. 1. Образование соли после выпаривания.
В подобных реакциях вода – обязательный продукт.
Примеры
Реакция нейтрализации может происходить между сильными и слабыми кислотами и щелочами. Рассмотрим два типа реакций:
Примером первого вида реакций является взаимодействие сильной кислоты с сильным основанием:
Обратимые реакции протекают при нейтрализации слабой кислоты сильным основанием, а также слабого основания слабой кислотой:
Слабые нерастворимые или слаборастворимые основания (Fe(OH)3, Fe(OH)2, Mg(OH)2, Zn(OH)2) также нейтрализуются сильной кислотой. Например, гидроокись меди не растворяется в воде, но при взаимодействии с азотной кислотой образует соль (нитрат меди) и воду:
Cu(OH)2 + 2HNO3 ↔ Cu(NO3)2 + 2H2O.
Рис. 2. Взаимодействие гидроокиси меди с кислотой.
Реакции нейтрализации экзотермичные, они протекают с выделением тепла.
Использование
Реакции нейтрализации – основа титриметрического анализа или титрования. Это метод количественного анализа концентрации веществ. Метод используется в медицине, например, для определения кислотности желудочного сока, а также в фармакологии.
Кроме того, важно практическое применение нейтрализации в лаборатории: при проливе кислоты её можно нейтрализовать щёлочью.
Что мы узнали?
Реакция, при которой кислота и основание образуют соль и воду, называется нейтрализацией. Эта реакция возможна между любыми кислотами и основаниями: сильной кислотой и сильной щёлочью, слабой кислотой и слабым основанием, сильным основанием и слабой кислотой, слабым основанием и сильной кислотой. Реакция протекает с выделением тепла. Нейтрализация применяется в медицине и фармакологии.