Что такое стандартные электродные потенциалы металлов
Стандартный электродный потенциал
Содержание
Вычисление стандартных электродных потенциалов
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен водородный электрод, для которого этот потенциал точно определён и равен 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Fe 3+ + 3e − → Fe(тв) −0.036 В
Fe 2+ + 2e − → Fe(тв) −0.44 В
Для получения третьего уравнения:
Fe 3+ + e − → Fe 2+ (+0.77 В)
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.
Таблица стандартных электродных потенциалов
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гиббса ΔG o должна быть отрицательной, в соответствии со следующим уравнением:
где n это количество молей электронов на моль продуктов, а F является постоянной Фарадея,
96485 Кл/моль. Таким образом применимы следующие правила:
если E o яч> 0, тогда процесс самопроизвольный (гальваническая ячейка) если E o яч
Нестандартные условия
Стандартные электродные потенциалы даны при стандартных условиях. Однако, реальные ячейки могут действовать и при нестандартных условиях. При данном стандартном потенциале, потенциал при нестандартных эффективных концентрациях может быть вычислен с использованием уравнения Нернста:
Величины E 0 зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для конденсированных фаз величины потенциалов также зависят от давления.
См. также
Литература
Ссылки
Полезное
Смотреть что такое «Стандартный электродный потенциал» в других словарях:
СТАНДАРТНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ — (нормальный электродный потенциал) потенциал электрода в растворе, в котором ионы, определяющие электродный процесс, имеют активность, равную единице. Стандартный потенциал данного электрода измеряется относительно стандартного (нормального)… … Большая политехническая энциклопедия
стандартный электродный потенциал — standartinis elektrodo potencialas statusas T sritis chemija apibrėžtis Potencialų skirtumas, susidarantis metalui arba nemetalui liečiantis su tirpalu, kurio elektrochemiškai veiklių jonų koncentracija 1 mol/l. atitikmenys: angl. standard… … Chemijos terminų aiškinamasis žodynas
Стандартный электродный потенциал — Standard electrode potential Стандартный электродный потенциал. Обратимый потенциал для электродного процесса, где все продукты и реакции находятся на шкале активности, на которой потенциал полуэлемента водорода равен нулю. (Источник: «Металлы и… … Словарь металлургических терминов
Электродный потенциал — У этого термина существуют и другие значения, см. Потенциал. Электродный потенциал разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение… … Википедия
Нормальный электродный потенциал — В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации… … Википедия
нормальный электродный потенциал — standartinis elektrodo potencialas statusas T sritis chemija apibrėžtis Potencialų skirtumas, susidarantis metalui arba nemetalui liečiantis su tirpalu, kurio elektrochemiškai veiklių jonų koncentracija 1 mol/l. atitikmenys: angl. standard… … Chemijos terminų aiškinamasis žodynas
Потенциал электростатический — Классическая электродинамика Магнитное поле соленоида Электричество · Магнетизм Электростатика Закон Кулона … Википедия
СТАНДАРТНЫЙ ЭЛЕКТРОД — (эталонный ЭЛЕКТРОД), в ЭЛЕКТРОХИМИИ ПОЛУЭЛЕМЕНТ, состоящий из других полуэлементов и служащий эталоном. Главным стандартным электродом является водородный электрод платиновый электрод, погруженный в молярный раствор ионов водорода и покрытый… … Научно-технический энциклопедический словарь
Электростатический потенциал — У этого термина существуют и другие значения, см. Потенциал. Классическая электродинамика … Википедия
Окислительно-восстановительный потенциал — (редокс потенциал от англ. redox reduction oxidation reaction, Eh или Eh) мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно восстановительный потенциал выражают в милливольтах (мВ).… … Википедия
Стандартные электродные потенциалы металлов



В 1865 г. (т.е. за 4 года до открытия Д.И. Менделеевым переодического закона) металлы уже были классифицированы по их активности. Это сделал известный русский ученый Н.Н. Бекетов, который изучал действие различных металлов на разбавленные кислоты и воду и заметил, что наиболее активно ведут себя щелочные металлы. Некоторые же металлы, такие, как Cu, Hg, Ag, Au, вообще не вытесняли водород из растворов кислот, даже наоборот — водород сам способен вытеснять металлы из солей ртути и серебра.
Итогом трудов Н.Н. Бекетова явился так называемый вытеснительный ряд металлов:
K, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au.
Все металлы, стоящие в этом ряду левее водорода, вытесняют водород из разбавленных кислот.
Современное название этого ряда — «Электрохимический ряд напряжений», так как положение каждого металла в этом ряду определяется величиной так называемого электродного потенциала.
Что же такое электродный потенциал? Как он возникает?
Напомним, что электрическим потенциалом называют величину, соответствующую энергии, которую нужно затратить (и тогда потенциал положителен) или которую можно получить (и тогда потенциал отрицателен) при переносе единицы электричества из бесконечности в данную точку.
Согласно современным представлениям, в узлах кристаллических решеток металлов находятся атомы и ионы, причем нейтральных атомов очень мало, подавляющее число частиц находится в виде ионов. Электроны, подчиняясь законам квантовой теории, движутся в поле положительных зарядов, создавая своеобразный «электронный газ». Таким образом, в металле существует подвижное равновесие, которое можно выразить уравнением.
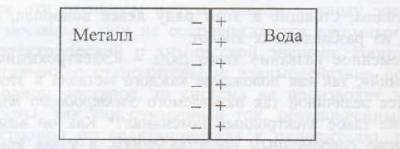
Катионы, перешедшие в жидкость, располагаются вблизи поверхности отрицательно заряженной пластинки металла, в результате чего образуется двойной электрический слой, что схематически можно представить так (рис.1):
Рис.1. двойной электрический слой на границе металл–вода
Таким образом, на границе соприкосновения жидкости с металлом электрический потенциал? резко изменяется и наблюдается скачок (или разность) потенциала ??, который принято называть электродным потенциалом.
. В большинстве современной химической литературы скачки потенциалов обозначаются просто ?.
Ясно, что чем активнее металл, тем легче будут диссоциировать его атомы, тем большее количество катионов перейдет в жидкость и тем, следовательно, б?льшим будет отрицательный заряд металла, что, в свою очередь, обусловит б?льшую разность потенциалов на границе металл—жидкость.
Процесс перехода ионов металла в жидкость является обратимым процессом. Поэтому, если погрузить пластинку металла не воду, а в раствор соли этого металла, то равновесие будет смещено: из металла в раствор будет переходить меньше ионов и разность потенциалов на границе металл—раствор будет несколько иной, чем в первом случае.
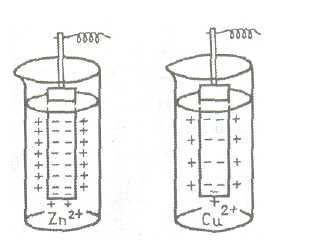
На рис. 2. представлена схема возникновения двойного электрического слоя в случае цинковой и медной пластинок, погруженных в растворы их солей.
Рис.2. Схема возникновения электродного потенциала
Видно, что величина электродного потенциала определяется прежде всего природойметалла. Кроме того она зависит от температуры, концентрации раствора и других факторов. Поэтому для сравнения электродных потенциалов необходимо выбрать некоторые стандартные условия. Обычно сравнение производят при 25°С, давлении 101,3 кПа и в растворе с концентрацией одноименного иона, равной единице (1 моль/л).
Таким образом, стандартным электродным потенциалом называется электродный потенциал при концентрации иона металла 1 моль/л.
Абсолютное значение электродного потенциала измерить невозможно (поскольку введение любых измерительных зондов неизбежно приводит к появлению новой контактной разности потенциалов). Вместе с тем не представляет труда измерение величины относительного электродного потенциала.
Относительные электродные потенциалы металлов измеряют относительно стандартного водородного электрода, потенциал которого произвольно принят за нуль.
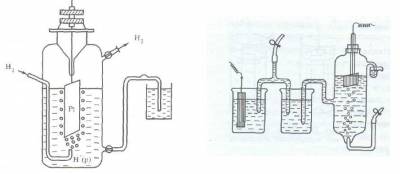
Поскольку водород при температуре 298 К является газом, из него невозможно, как из металла, изготовить пластинку. В качестве твердой фазы в стандартном водородном электроде используют инертный металл (например, Pt).
Конструктивно водородный электрод (рис.3) состоит из платиновой пластинки, покрытой слоем мелкозернистой платины — платиновой чернью, частично погруженной в раствор кислоты с концентрацией ионов водорода, равной 1 моль/л. Обычно берут раствор нелетучей кислоты — серной H2SO4 или хлорной HClO4. К пластинке подают чистый газообразный водород под постоянным давлением 101,3 кПа.
Суммарный процесс выражается уравнением:
Рис. 3. Схема водородного электрода или так
Если пластинку некоторого металла, погруженную в раствор его соли с концентрацией иона металла 1 моль/л, соединить электролитным мостиком с водородным электродом (рис.3), то получится гальванический элемент, т.е. в полученной системе пойдет электрический ток, обусловленный разностью электродныхпотенциаловводородногоэлектродаи изучаемогометалла.
Вот эту величину — разность электродных потенциалов катода и анода — в разомкнутом (незамкнутом) гальваническом элементе называют электродвижущей силой (ЭДС или Е) элемента:
ЭДС= ??1 –??2 или ЭДС = ??к –??А
В замкнутом гальваническом элементе, т.е. при измеряемом значении силы тока в элементе (т.е. при соединении платины с некоторым металлом металлическим проводником) разность потенциалов катода и анода называют напряжением:
Прямым измерением разности потенциалов на клеммах гальванического элемента с помощью обычного вольтметра можно получить значение напряжения U,которое не равноЭДСэлемента, т.е. U 0 , ВK, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
(или просто ? 0 ) –2,92 –2,38 0,0 0,8 1,2
Ряд напряжений характеризует химические свойства металлов:
1. Чем меньшей алгебраической величиной ? 0 обладает металл, тем он химически активнее, т.е. тем больше его восстановительная способность.
2. Чем дальше расположены друг от друга в ряду напряжений два металла, тем б?льшую электродвижущую силу будет иметь построенный из них гальванический элемент, причем катодом всегда будет являться тот электрод, потенциал которого больше.
Что такое электродный потенциал
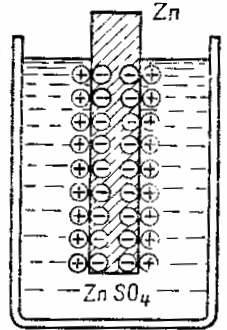
Явления растворения металлов в электролитах используются в химических источниках электроэнергии. Металлическая пластина, опушенная в раствор своей же соли, в той или иной мере стремится в ней раствориться. Это стремление иногда называется упругостью растворения металла.
Эти заряды будут противодействовать дальнейшему переходу металла в раствор — отрицательные пластины удерживают положительный ион металла, а положительный заряд электролита отталкивает ион металла назад на пластину. Иными словами, электрическое поле двойного слоя на границе металл — жидкость противодействует дальнейшему переходу ионов металла в раствор. Устанавливается равновесие между химическими по своей природе силами стремления металла перейти в раствор и электрическими силами, им противодействующими.
Схема образования двойного электрического слоя на границе металла и электролита
Таким образом, вследствие растворения в электролите металлический электрод приобретает по отношению к электролиту определенный электродный (иначе электрохимический) потенциал, зависящий от материала электрода и состава электролита.
Однако электродные потенциалы могут иметь положительное значение. Это имеет место в тех случаях, когда положительные ионы раствора переходят на электрод, заряжая его положительно, а слой электролита — отрицательно, например, когда медная пластина погружена в достаточно концентрированный раствор сернокислой меди (CuSO4).
Двойной электрический слой можно уподобить конденсатору, одна из обкладок которого представляет собой поверхность металла, а другая — слой ионов в растворе у поверхности металла. Между разноименно заряженными обкладками и возникает разность, или скачок, потенциала.
Скачок потенциала на границе электрод-раствор может служить мерой окислительно-восстановительной способности системы. Однако невозможно произвести измерение такого скачка потенциала или, что то же, разности потенциалов между двумя фазами. Но можно произвести измерение э. д. с. элементов, составленных из интересующих нас электродов и какого-нибудь одного (одинакового во всех случаях) электрода, потенциал которого условно принят за нуль.
Измеренная э. д. с. будет характеризовать окислительно-восстановительную способность интересующего нас электрода относительно некоторого условного нуля. Полученная таким способом величина называется собственным потенциалом металла.
Чтобы измерить электродный потенциал любого металла, необходимо поместить в электролит второй электрод, который и свою очередь будет обладать определенным электродным потенциалом, зависящим от его материала. Следовательно, непосредственно измерить можно только алгебраическую сумму двух электродных потенциалов.
По этой причине электродные потенциалы различных материалов определяются по отношению к стандартному (водородному электроду, потенциал которого условно принимают за нуль.
Для измерения могут применяться и другие электроды сравнения, потенциал которых относительно водородного стандартного электрода известен. Этот потенциал также находят на основании измерения э. д. с. цепи, составленной из выбранного электрода сравнения и стандартного водородного электрода.
Если в соответствующий электролит помещены две пластины из металлов, имеющих различный электродный потенциал, например, в раствор серной кислоты (H2SO4) помещены цинковая (Zn) и медная (С u ) пластины, то вольтметр, присоединенный к этим пластинам, покажет между ними напряжение немного более 1 В.
Это напряжение, называемое в данном случае э. д. с. гальванической пары, будет обусловлено разностью электродных потенциалов меди, обладающей небольшим положительным потенциалам, и цинка, обладающего значительным отрицательным потенциалом. Такое устройство является простейшим гальваническим элементом — элементом Вольта.
В гальваническом элементе происходит превращение химической энергии в электрическую и с его помощью можно совершить электрическую работу за счет энергии химической реакции.
Измерение э. д. с. гальванических элементов необходимо производить при отсутствии тока в цепи элемента. В противном случае измеренная э. д. с. будет меньше, чем величина, определяемая как разность равновесных потенциалов обоих электродов. Действительно, равновесному потенциалу отвечает определенная концентрация электронов на электродах: на более положительном она ниже, на более отрицательном выше. Сообразно с этим различно и строение той части двойного слоя, которая расположена в растворе.
Измерение э. д. с. элемента без протекания тока обычно производится компенсационным методом. Для осуществления его необходимо иметь некоторый эталон э. д. с. Таким эталоном служит так называемый нормальный элемент. Чаще всего пользуются ртутно-кадмиевым нормальным элементом Вестона, э. д. с. которого равна 1,01830 В при 20 °С.
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Подписывайтесь на наш канал в Telegram!
Просто пройдите по ссылке и подключитесь к каналу.
Не пропустите обновления, подпишитесь на наши соцсети:
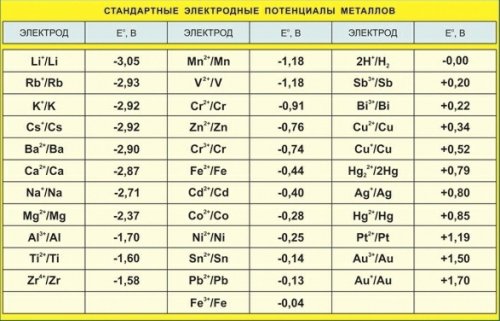
Стандартные электродные потенциалы



Мерой склонности веществ к окислению и восстановлению служит стандартный электродный потенциал. Так как нет методов измерения абсолютных величин, то измеряют относительные электродные потенциалы, пользуясь так называемыми электродами сравнения. Основным электродом сравнения является водородный. Условно потенциал водородного электрода принимают за ноль и называют стандартным.
Стандартный потенциал металла E 0 — это разность потенциалов между металлом, погруженным в раствор своей соли, содержащий один моль иона этого металла в литре, и стандартным водородным электродом.
Стандартные потенциалы E 0 распространенных металлов Me n + /Me 0 приведены в справочниках, они всегда относятся к определенному электродному процессу, т.е. определенному заряду и составу катиона металла в растворе. Последовательность расположения металлов по возрастанию стандартного потенциала E 0 (от меньших отрицательных к бо́льшим положительным значениям) как раз и отвечает электрохимическому ряду напряжений. Такая
Стандартные потенциалы металлических электродов при 25 °C
последовательность называется рядом стандартных электродных потенциалов металлов (табл. 3) и является фрагментом ряда стандартных электродных потенциалов (см. табл. 2). Чем отрицательнее потенциал электрода, тем сильнее восстановительные свойства и больше активность металла.
Электрохимический ряд активности металлов
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительные реакциях в водных растворах.
Содержание
История
В 1793 году Алессандро Вольта, конструируя гальванический элемент («Вольтов столб»), установил относительную активность известных тогда металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. «Сила» гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга металлы в этом ряду («ряд напряжений»). Однако Вольта не связал этот ряд с химическими свойствами металлов.
В эпоху становления классической химии способность элементов вытеснять друг друга из соединений стала важным аспектом понимания реакционной способности. Й. Берцелиус на основе электрохимической теории сродства построил классификацию элементов, разделив их на «металлоиды» (сейчас применяется термин «неметаллы») и «металлы» и поставив между ними водород.
Многочисленные экспериментальные данные, полученные в конце XIX века, опровергали гипотезу Бекетова. Так, Уильям Одлинг описал множество случаев «обращения активности». Например, медь вытесняет олово из концентрированного подкисленного раствора SnCl2 и свинец — из кислого раствора PbCl2; она же способна к растворению в концентрированной соляной кислоте с выделением водорода. Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора CdCl2.
Бурное развитие теоретической и экспериментальной физической химии указывало на иную причину различий химической активности металлов. С развитием современных представлений электрохимии (главным образом в работах Вальтера Нернста) стало ясно, что эта последовательность соответствует «ряду напряжений» – расположению металлов по значению стандартных электродных потенциалов. Таким образом, вместо качественной характеристики — «склонности» металла и его иона к тем или иным реакциям — Нерст ввёл точную количественную величину, характеризующую способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла на электроде, а соответствующий ряд получил название ряда стандартных электродных потенциалов.
Теоретические основы
Значения электрохимических потенциалов являются функцией многих переменных и поэтому обнаруживают сложную зависимость от положения металлов в периодической системе. Так, окислительный потенциал катионов растёт с увеличением энергии атомизации металла, с увеличением суммарного потенциала ионизации его атомов и с уменьшением энергии гидратации его катионов.
В ряд напряжений традиционно включается водород, поскольку практическое измерение электрохимических потенциалов металлов производится с использованием стандартного водородного электрода.
Практическое использование ряда напряжений
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе: