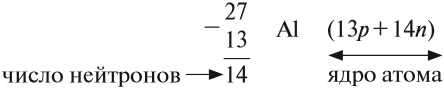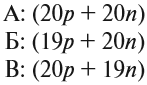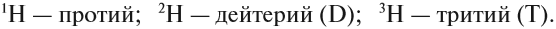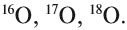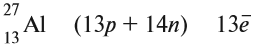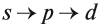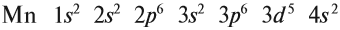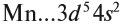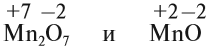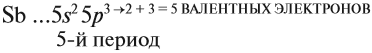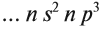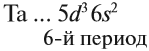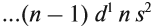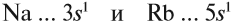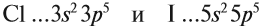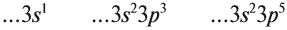Что такое строение атома химия
Строение атома
История открытия. Демокрит. Начала атомистики
Уже в древности философы задумывались, из чего же состоит природа вокруг них. Демокрит первым из античных ученых предположил, что все в мире состоит из крошечных неделимых частиц. Эту частицу он назвал атом, что в переводе с греческого означает «неделимый».
К сожалению, возможности ученых в те времена были весьма ограничены. Каких-либо приборов, позволяющих исследовать строение вещества, у них не было. Но значение Демокрита в зарождении атомистики невозможно сбросить со счетов истории.
Атомно-молекулярное учение. Строение атома
Практически до середины XVIII века, пока М.В. Ломоносов не принес в химию количественные эксперименты, учение об атомах оставалось лишь прерогативой философских размышлений. Михаил Васильевич считал, что лишь знание физических законов поможет правильно истолковать результаты химических опытов.
В своих исследованиях ученый выделил в веществе крупные частицы — «корпускулы», и мелкие — «элементы», или как мы называем их сейчас — атомы.
Ломоносов считал, что каждая молекула по своему составу идентична всему веществу, а также, что различные по химическому строению элементы имеют и разные по составу молекулы. Ученый предполагал, что вещества имеют особенности не только из-за отличий в составе молекул, но и благодаря различному расположению атомов в молекуле.
Следующий шаг в изучении атомов сделал английский естествоиспытатель Джон Дальтон. Проводя различные эксперименты с растворением газов в жидкостях, ученый открыл главное физическое качество атомов: эти мельчайшие частицы имеют вес. Но поскольку атом до сих пор никто не видел, Дальтон назвал вес частицы относительным. Он установил, что самым легким элементом является водород и предложил его вес принять за единицу.
Открытие Дальтона стало прорывом в химии. Ведь теперь к любому химическому соединению можно было подойти с измерительным прибором. Это исследование позволило приблизиться к современной записи химических формул и уравнений. И именно Дальтон придумал первые обозначения для известных химических элементов.
До конца XIX века, несмотря на все старания ученых, химическое строение атома по-прежнему оставалось лишь гипотезой.Ученым не хватало оборудования, чтобы постичь тайну мельчайшей частицы.
Открытие Дальтона дало толчок дальнейшим опытам, в ходе которых ученые вычислили относительную атомную массу разнообразных химических элементов, что позволило их классифицировать, а Д.И.Менделееву – сформулировать периодический закон и представить научному миру Периодическую систему химических элементов.
Протоны и нейтроны
Обнаружение катодных лучей немецким ученым-физиком Юлиусом Плюккером в 1859 году и создание прототипа электронной трубки Ульямом Круксом в 1879 году положили новый виток исследованиям в атомистике.
Однако потребовалось еще несколько десятков лет, чтобы строение атомов химических элементов приоткрыло свои тайны. на заре XX века в одном журнале появились две публикации, которые пытались объяснить структуру атома. Одна из публикаций принадлежала английскому ученому Д.Д. Томсону, автором другой был японский физик Хантаро Нагаока.
При создании своей атомной структуры Нагаока использовал разработанную Максвеллом в 1856 году теорию устойчивости колец Сатурна. Японский ученый был убежден, что опираясь на «сатурнианскую» модель ядра в будущих исследованиях, можно прояснить все основные свойства материи.
Исследователь ошибся, однако два постулата его теории впоследствии подтвердились:
Томсон выдвинул гипотезу о том, что атом напоминает шарообразную, электронейтральную сферу диаметром около 10 –10 м, где положительный заряд равномерно распределен по всей структуре атома, а электроны хаотично расположены в этом поле. Поэтому, можно сказать, что атом напоминает микроскопическую булочку с изюмом.
Опыты продолжались в разных странах. В лаборатории Резерфорда проходили испытания, которые смогли доказать, что в центре атома расположено крупное ядро с диаметром около —10 —15 м, в котором содержится более 99,95 % его массы, а заряд его положительный.
В 1932 году и Джеймс Чедвик обнаружил нейтрон — третий недостающий элемент атома.
Атомное взаимодействие обеспечивает тесную связь протонам и нейтронам в ядре атома. Протоны и нейтроны имеют общее название — нуклоны. Ученые считают, что их характеристики достаточно подобны, чтобы отнести эти частицы к одному семейству, как биологи относят в один вид собак и волков.
Казалось бы, вот оно – тайна ядра разгадана. Но нет, в современной физике считается, что нуклоны состоят из еще более мелких частиц, которые называют кварками, и кварковая модель является ведущей в современной науке.
Эксперименты по исследованию атома и его ядра не прекращаются, и в 2010 году международная группа физиков при исследовании протонов в мюонном водороде установила, что размер радиуса протона меньше на 4%, чем считалось до этого.
Так в фундаментальную физику ворвалась загадка протонного радиуса, почему измерение одной и той же величины в обычном и в мюонном водороде дает разные результаты — и, несмотря на усилия сотен специалистов, она до сих пор не решена.
Изотопы
Работая в лаборатории Резерфорда, Фредерик Содди экспериментально установил, что встречаются атомы одного химического элемента с различной атомной массой. А поскольку к этому времени уже было известно, что количество протонов для ядра постоянно, соответственно, отличались они количеством нейтронов.
Содди предложил термин изотоп (от греческих слов изос — «равный» и топос — «место») для обозначения веществ, идентичных по химическим свойствам, но отличающихся атомной массой и определенными физическими свойствами.
При графической записи изотоп выглядит как знак химического элемента, которому он соответствует. А что бы обозначить разницу, в массовом числе используют индекс слева вверху: ( 12 C, 222 Rn)
Протий, дейтерий, и тритий — исторические собственные названия изотопов водорода.
Электронное строение атома
Исследование таинственного микромира продолжается. Изучение движения электронов и внутриатомных взаимодействий выделилось в отдельную область физики — квантовую механику. Главный постулат квантовой механики — все волны обладают свойствами частиц, а микрочастицы имеют волновую природу.
В макромире физическое тело всегда находится в какой-то конкретной точке пространства. Даже если вы сфотографируете летящую муху и на фотографии она будет в виде черной полосы, вы все равно будете уверены, что в конкретный момент времени она была в определенном месте.
В мире атома все иначе. Легкий подвижный электрон находится одновременно во всех точках околоядерного пространства. Если провести аналогию с макромиром, больше всего это напомнит неплотный клубок мягкой пушистой шерсти.
И именно эта зона пространства, где существует вероятность встретить электрон, называется электронным облаком. Плотность электронного облака неравномерна.
В электронном облаке выделяют зону, где вероятность встречи с электроном более 90% — эта область обозначена как атомная или электронная орбиталь.
Все электроны в атоме обладают определенной энергией. Чтобы описать состояние электрона, ученые используют квантовые числа. Всего их четыре. Целое число n, которое определяет энергию электронов на конкретном энергетическом уровне, называют главным квантовым числом.
На одной электронной оболочке находятся атомные орбитали с единым значением главного квантового числа n.
У невозбужденного атома электроны расположены на орбиталях 4-х видов: s, p, d и f.
Но почему нельзя было обозначить буквами по алфавиту a, b, c? Все не так просто, для обозначения атомных орбиталей ученые решили использовать начальные буквы от прилагательных, описывающих спектральные линии в атомных спектрах:
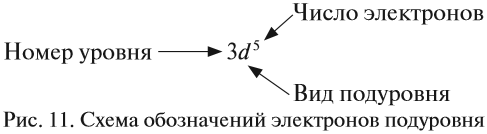
Чтобы графически представить расположение электронов на уровнях и подуровнях атомной оболочки, ученые ввели электронные формулы. Это такие численно-буквенные комбинации, где подуровень обозначен строчной латинской литерой, а цифровой индекс вверху справа обозначает количество электронов на подуровне.
Несмотря на свои способности быть одновременно в любой точке пространства, электроны при заполнении орбиталей соблюдают определенный порядок:
У этого правила есть еще одно мнемоническое название — правило троллейбуса. Расположение электронов напоминает рассадку в общественном транспорте. Если есть свободные места и человек входит один, он сядет на свободное сиденье, и только если нет свободных сидений, подсядет к кому-то на свободное место.
Итак, подведем выводы, на которые ученым понадобилось более сотни лет опытов, исследований, научных дискуссий и даже трагедий.
Чтобы проверить насколько хорошо усвоен материал, предлагаем вашему вниманию тест на тему «Строение атома» для 8-11 классов:
Основы строения атомов
Большинство из нас думает, что знает об атомах достаточно много. Мы знаем какие они маленькие и даже можем дать определение атому. Но как же человечество пришло к пониманию, что такое атом и каковы основы строения атомов?
Модель атома Томпсона (пудинг с изюмом)
В 1897 году Дж. Дж. Томпсон проводил опыт — в вакуумную трубку между двумя палочками (электродами) подавал напряжение и заметил, что в результате этого, проходит пучок сверкающих лучей от «-» к «+» электроду.
Эти лучи он назвал катодными лучами, позднее их стали называть электронными лучами. С помощью магнита, Томпсон определил, что эти лучи содержат частицы с отрицательным зарядом. После большой серии опытов ему удалось установить, что отрицательные частицы (электроны) очень малы, по сравнению с тем, что дает положительный заряд атому.
В итоге многочисленных опытов была разработана модель атома, получившая название «пудинг с изюмом». В этой модели атом – это большое облако, имеющее «+» заряд (пудинг), имеющее очень маленькие вкрапления «-» заряженных частиц (электроны — изюм).
Модель атома Резерфорда (ядерная модель)
В 1907 году Эрнест Резерфорд «дурачился» в своей лаборатории, запуская в тонкую золотую фольгу альфа-частицы, чтобы увидеть, как они отклоняются облаком положительного заряда.
Но вот произошло то, что он никак не ожидал увидеть: хотя большинство частиц летели прямо, некоторые отклонялись на большой угол, а некоторые летели назад в сторону источника. Этот эксперимент позволил предположить, что весь положительный заряд находится в ядре атома, а отрицательно заряженные электроны плавают вокруг него. Согласно ядерной модели строения атома по Резерфорду, большую часть атома занимает пустое пространство.
Модель атома Бора (планетарная модель)
Пока другие ученые ставили эксперименты с катодными лучами, Нильс Бор был озадачен теми линиями, которые давал водород при добавлении ему энергии. И вот возникла планетарная модель атома, в которой Бор предположил, что электроны движутся вокруг ядра по круговым орбитам, подобно планетам, вращающихся вокруг Солнца.
Также он полагал, что чем дальше электрон находится от ядра, тем большей энергией он обладает. При получении атомом дополнительной энергии, электроны с ближних орбит могут перескакивать на более отдаленные. Начальная орбиталь называется основной, а конечная – возбужденной. Энергия, полученная атомом должна куда-то уйти, и она высвобождается в виде квантов электромагнитного излучения. Т.к. существует несколько возбужденных состояний, то испускаются кванты различных энергий. Этим он объяснил полученный спектр водорода.
Современная модель атома (квантовая модель)
Во что мы верим сейчас? Из предыдущего раздела Основные понятия и законы химии, мы знаем, что Атом состоит из ядра и электронов. Атомное ядро имеет положительный заряд и состоит из протонов (Z) и нейтронов (N), а сумма масс протонов (Z) и нейтронов (N) атомного ядра называется массовым числом A = Z + N. Электроны атома расположены вокруг ядра на своих орбиталях.
В таблице приведены характеристики частиц, входящих в атом
Частица
Атомы электронейтральны и число протонов совпадает с числом электронов, а вот число нейтронов может отличаться, тогда и появляются изотопы. Поскольку все элементы имеют несколько изотопов, то у каждого из них мы будем иметь среднюю атомную массу от масс всех изотопов, отсюда и возникает дробное значение атомной массы элемента в Периодической таблице Менделеева.
Атомная орбиталь
А что же такое атомная орбиталь, какова ее природа и как она выглядит? В результате титанического труда многих ученых, родилась новая теория строения атома – квантовая.
Согласно этой теории электрон обладает корпускулярно-волновым дуализмом — является одновременно волной и частицей. Масса и заряд электрона – это свойства частицы, а способность к дифракции и интерференции — волновые.
Уравнение де Бройля связывает эти два свойства электрона.
Вскоре было выведено уравнение Шредингера, которое описывает электрон как волну:
где E— полная энергия электрона, V-потенциальная энергия электрона, Ψ-квадратный корень от вероятности нахождения электрона в пространстве с координатами x, y и z (при этом начало координат — ядро).
Уравнение предполагало, что точно предсказать местонахождение и траекторию движения электрона невозможно. Однако, можно найти вероятность нахождения электрона с помощью волновой функции. Теперь орбитали стали не двухмерными, как считалось ранее, а трехмерными телами.
Что такое орбиталь?
Орбиталь — это околоядерное пространство, в котором вероятность обнаружения электрона равна 95%.
Т.о. можно описать 4 разных видов орбиталей, имеющих разную энергию и различную форму:
Электроны в зависимости от занимаемой орбитали (подуровня), называют s-, p-, d- и f-электронами.
Элементы, внешние электроны которых занимают только s-подуровень, называются s-элементами. Таким же образом называют p-элементы, d-элементы и f-элементы.
Квантовые числа (n, l, ml, ms)
Чтобы описанные раннее уравнения работали, нужны 4 переменные (4 квантовых числа). Опишем их:
Принцип Паули гласит,
Никакие два электрона в атоме не могут иметь одинаковый набор всех 4х квантовых чисел.
Из принципа Паули вытекает, что на энергетическом уровне n может находиться не более чем 2n 2 электронов, на n 2 подуровнях.
Существует правило, которое гласит, что электроны размещаются на уровнях и орбиталях не беспорядочно, а по принципу наименьшей энергии, т.е. чтобы сумма главного и орбитального квантовых чисел n+l была наименьшей.
Это правило известно, как правило Клечковского. В случае, когда сумма равна, сначала идет заполнение энергетического уровня с наименьшим главным квантовым числом.
Правила заполнения орбиталей
Заполнение орбиталей происходит в следующем порядке:
1s В пределах одного периода, находясь в основном состоянии, атом стремится к максимально возможному числу неспаренных электронов
Зная, где находится электрон, мы можем написать его электронную конфигурацию (запись ряда орбиталей атома, на которых находятся электроны), которая составляется по образцу:
n(тип орбитали) число электронов на этой орбитали
Итак, заполнение орбиталей электронами происходит следующим образом:
Возбужденное состояние атома
При сообщении атому дополнительной энергии (действие температуры, рентгеновского или электромагнитного излучения), его электроны переходят в возбужденное состояние. При этом один или несколько электронов основного состояния переходят с занятых орбиталей на свободные. Предпочтительно возбуждаются электроны внешних оболочек, т.к. образующиеся состояния обладают наименьшей энергией.
Это состояние очень неустойчиво и длится всего миллионные доли секунды.
Валентные электроны (электроны, расположенные на внешнем уровне) способны выравнивать свою энергию и изменять форму орбиталей. Этот процесс называется гибридизацией атомных орбиталей и подробнее описан в разделе Метод валентных связей
Примеры с решениями на составление электронных формул, распределение электронов по орбиталям в различных атомах Вы можете посмотреть в разделе Задачи по теме Основы строения атомов
Строение атома

Всего получено оценок: 3037.
Всего получено оценок: 3037.
Атом – наименьшая частица вещества. Его изучение началось еще в Древней Греции, когда к строению атома было приковано внимание не только ученых, но и философов. Каково же электронное строение атома, и какие основные сведения известны об этой частице?
Строение атома
Уже древнегреческие ученые догадывались о существовании мельчайших химически частиц, из которых состоит любой предмет и организм. И если в XVII-XVIII вв. химики были уверены, что атом неделимая элементарная частица, то на рубеже XIX-XX вв., опытным путем удалось доказать, что атом не является неделимым.
Атом, будучи микроскопической частицей вещества, состоит из ядра и электронов. Ядро в 10000 раз меньше атома, однако практически вся его масса сосредоточена именно в ядре. Главной характеристикой атомного ядра, является то, что он имеет положительный заряд и состоит из протонов и нейтронов. Протоны заряжены положительно, а нейтроны не имеют заряда (они нейтральны).
Атом любого элемента можно обозначить электронной формулой и электронно графической формулой:
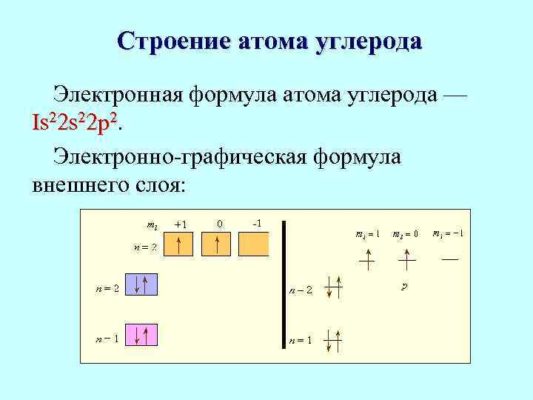
Единственным химическим элементом из периодической системы, в ядре которого не содержатся нейтроны, является легкий водород (протий).
Электрон является отрицательно заряженной частицей. Электронная оболочка состоит из движущихся вокруг ядра электронов. Электроны имеют свойства притягиваться к ядру, а между друг друг на них оказывает влияние кулоновское взаимодействие. Чтобы преодолеть притяжения ядра, электроны должны получать энергию от внешнего источника. Чем дальше электрон находится от ядра, тем меньше энергии для этого необходимо.
Модели атомов
На протяжении долго времени ученые стремились познать природу атома. На раннем этапе большой вклад внес древнегреческий философ Демокрит. Хотя сейчас его теория и кажется нам банальной и слишком простой, в тот период, когда представления об элементарных частицах только начинало зарождаться, его теория о кусочках материи воспринималась совершенно серьезно. Демокрит считал, что свойства любого вещества зависят от формы, массы и других характеристик атомов. Так, например, у огня, полагал он, острые атомы – поэтому огонь обжигает; у воды атомы гладкие, поэтому она способна течь; у твердых предметов, по его представлению, атомы были шереховатые.
Демокрит считал, что из атомов состоит абсолютно все, даже душа человека.
В 1904 году Дж. Дж. Томсон предложил свою модель атома. Основные положения теории сводились к тому, что атом представлялся положительно заряженным телом, внутри которого находились электроны с отрицательным зарядом. Позже эта теория была опровергнута Э. Резерфордом.

Также в 1904 году японским физиком Х. Нагаока была предложена ранняя планетарная модель атома по аналогии с планетой Сатурн. Электроны по этой теории объединены в кольца и вращаются вокруг положительно заряженного ядра. Эта теория оказалась ошибочной.
В 1911 году Э. Резерфорд, проделав ряд опытов, сделал выводы, что атом по своему строению похож на планетную систему. Ведь электроны, словно планеты, движутся по орбитам вокруг тяжелого положительно заряженного ядра. Однако это описание противоречило классической электродинамике. Тогда датский физик Нильс Бор в 1913 году ввел постулаты, суть которых заключалась в том, что электрон, находясь в некоторых специальных состояниях, не излучает энергию. Таким образом, постулаты бора показали, что для атомов классическая механика неприменима. Планетарная модель, описанная Резерфордом и дополненная Бором, получила название – планетарная модель Бора-Резерфорда.

Дальнейшее изучение атома привело к созданию такого раздела, как квантовая механика, с помощью которого объяснялись многие научные факты. Современные представления об атоме развились из планетарной модели Бора-Резерфорда.
Что мы узнали?
В данной статье по химии (8 класс) рассказывается кратко и понятно о строении атома. На протяжении многих веков ученые разных стран изучали мельчайшие частицы вещества. Появлялись разные теории, модели и разные формулы строения атома. Современные представления об атоме основываются на модели Бора-Резерфорда, по которой атом состоит из ядра и электронного облака, в котором электроны движутся вокруг ядра.
Урок 3. Элементарные сведения о строении атома
АТОМ — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Число электронов в ходе химических процессов может изменяться, но заряд ядра всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства данного химического элемента, а также простых и сложных веществ, в состав которых этот элемент входит.
Структура Периодической системы Менделеева
Строение атома, т. е. состав ядра, распределение электронов вокруг ядра, несложно определить по положению элемента в Периодической системе. В Периодической системе Менделеева химические элементы располагаются в определённой последовательности. Эта последовательность тесно связана со строением атома этих элементов. Каждому химическому элементу в системе присвоен порядковый номер, кроме того, для него можно указать:
Зная точный «адрес» химического элемента, т. е. его группу, подгруппу и номер периода, можно однозначно определить строение его атома.
Период — это горизонтальный ряд химических элементов. В современной Периодической системе семь периодов. Первые три — малые, так как они содержат 2 или 8 элементов:
Остальные периоды — большие. Каждый из них содержит 2–3 ряда элементов:
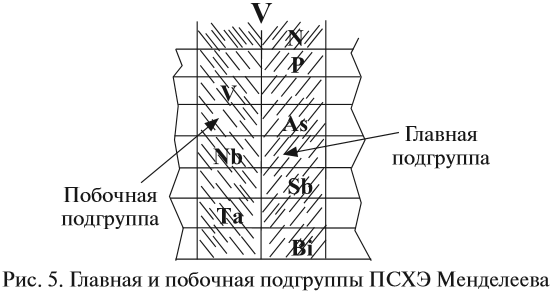
Группа — вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы (см. рис. 5).
Главную подгруппу (подгруппу А) образуют химические элементы малых периодов и больших периодов. На рисунке 5 показано, что главную подгруппу пятой группы составляют элементы малых периодов (N, P) и больших периодов (As, Sb, Bi).
Побочную подгруппу (подгруппу Б) образуют химические элементы только больших периодов. В нашем случае это V, Nb, Ta.
Визуально эти подгруппы различить легко: главная подгруппа «высокая», начинается с первого или второго периода. Побочная подгруппа — «низкая», начинается с 4-го периода.
Итак, каждый химический элемент Периодической системы имеет свой адрес:
Например, ванадий (V) — это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Задание 3.1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и название химического элемента, если известно, что он находится:
Каким образом можно связать эти сведения об элементе со строением его атома?
Ядро атома. Изотопы
Атом состоит из ядра, которое имеет положительный заряд, и электронов, которые имеют отрицательный заряд. В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
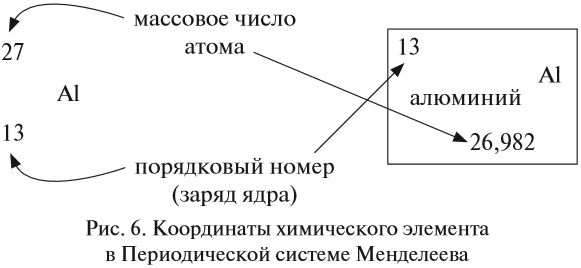
Ядро атома — сложная частица. В ней сосредоточена почти вся масса атома. Поскольку химический элемент — совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают (рис. 6).
По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
Какие частицы определяют заряд ядра? Протоны! Причём число протонов равно (по величине) заряду ядра атома, т. е. порядковому номеру:
Число нейтронов определяют по разности между величинами: «масса ядра» и «порядковый номер».
Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
Обратите внимание, что при определении массового числа ядра атома приходится округлять атомную массу, указанную в Периодической системе! Почему? Ведь массы протона и нейтрона практически целочисленны, а массой электронов можно пренебречь.
Для того,чтобы ответить на этот вопрос, нужно понять:
В химических процессах обязательно изменяется распределение электронов вокруг ядра или даже изменяется их число. В последнем случае атом отдаёт или принимает электроны и превращается в заряженную частицу — ион. Но в химических реакциях никогда не меняется состав ядра атома, его заряд. Поэтому заряд ядра атома является своеобразным «паспортом» химического элемента.
Химический элемент — совокупность атомов или ионов с одинаковым зарядом ядра.
Для того чтобы разобраться, попробуйте определить, какие из ядер, состав которых указан ниже, принадлежат одному и тому же химическому элементу:
Атомам одного химического элемента принадлежат ядра А и В, так как они содержат одинаковое число протонов, т. е. заряд этих ядер одинаковый. Но ведь у них разная масса! Исследования показывают, что масса атома не оказывает существенного влияния на его химические свойства. Поэтому атомы одного и того же химического элемента (одинаковое число протонов), но с разной массой (разное число нейтронов) являются ИЗОТОПАМИ* этого элемента.
* Слово «изотоп» означает по смыслу «одно место», т. е. все изотопы данного химического элемента находятся в одной клетке ПСХЭ.
В таблице Менделеева указана средняя атомная масса всех природных изотопов данного элемента (Аr). Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы. Так, изотоп углерода-14 ( 14 С) имеет такие же химические свойства, как и углерод-12 ( 12 С), который входит в ткани любого живого организма, отличаясь от него только радиоактивностью. Поэтому изотопы применяют для диагностики и лечения различных заболеваний, для научных исследований.
Элемент «водород» встречается в природе в виде трёх изотопов:
Химический элемент «кислород» также представлен тремя природными изотопами:
Задание 3.4. Укажите состав ядер этих изотопов водорода и кислорода.
Но вернемся к описанию строения атома.
Распределение электронов в поле ядра атома
Как известно, ядро атома в химических процессах не меняется. А что меняется? Общее число электронов и распределение электронов. Общее число электронов определить несложно: оно равно порядковому номеру, т. е. заряду ядра атома:
Электроны имеют отрицательный заряд –1, а масса их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны отталкиваются и поэтому находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, образуют энергетический уровень.
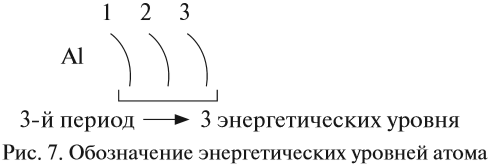
Число энергетических уровней в атоме равно номеру периода, в котором находится химический элемент. Энергетические уровни условно обозначают так (рис. 7).
Задание 3.5. Определите число энергетических уровней в атомах кислорода, магния, кальция, свинца.
На каждом энергетическом уровне может находиться ограниченное число электронов:
ЗАПОМНИТЕ ЭТИ ЧИСЛА!
Они показывают, что, например, на втором энергетическом уровне может находиться 2 или 5 или 7 электронов, но не может быть 9 или 12 электронов.
Важно знать, что, независимо от номера энергетического уровня, на внешнем (последнем) уровне не может быть больше восьми электронов. Внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершённым. Такие энергетические уровни имеются у самых неактивных элементов — благородных газов.
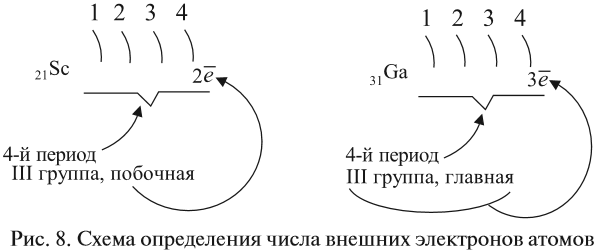
Как определить число электронов на внешнем уровне остальных атомов? Для этого существует простое правило – число внешних электронов равно:
Задание 3.6. Укажите число внешних электронов для химических элементов с порядковыми номерами 15, 25, 30, 53.
Задание 3.7. Найдите в Периодической системе химические элементы, в атомах которых имеется завершённый внешний уровень.
Очень важно правильно определять число внешних электронов, так как именно с ними связаны важнейшие свойства атома. Так, в химических реакциях атомы стремятся «приобрести» устойчивый, завершённый внешний уровень (8ē). Для этого атомы, на внешнем уровне которых мало электронов, «предпочитают» их отдать.
Химические элементы, атомы которых способны только отдавать электроны, относятся к МЕТАЛЛАМ. Очевидно, что на внешнем уровне атома металла должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома много электронов, то такие атомы стремятся принять электроны до завершения внешнего энергетического уровня, т. е. до восьми электронов. Такие элементы относятся к НЕМЕТАЛЛАМ.
Вопрос. К каким элементам (металлам или неметаллам) относятся химические элементы побочных подгрупп? Почему?
Металлы и неметаллы главных подгрупп в таблице Менделеева отделяет линия, которую можно провести от бора к астату. Выше этой линии (и на линии) располагаются неметаллы, ниже — металлы.
Задание 3.8. Определить, к металлам или неметаллам относятся: фосфор, ванадий, кобальт, селен, висмут. Вывод сделайте, определив положение элемента в Периодической системе химических элементов и число электронов на внешнем уровне.
Для того чтобы составить распределение электрона по остальным уровням и подуровням, следует воспользоваться следующим АЛГОРИТМОМ:
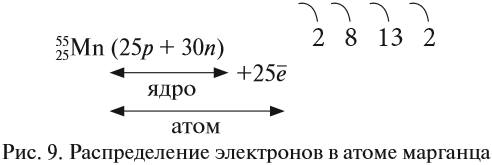
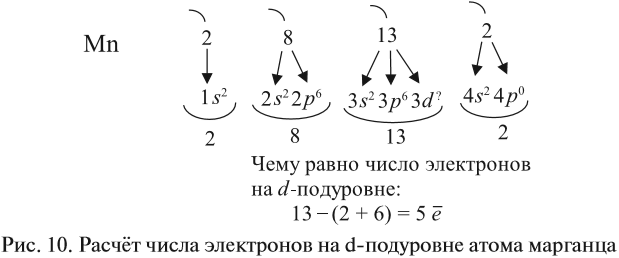
Например, согласно пунктам 1…4 для атома марганца определено:
Получили распределение электронов в атоме марганца (рис. 9):
Задание 3.9. Отработайте алгоритм, составив схемы строения атомов для элементов № 16, 26, 33, 37. Укажите: металлы это или неметаллы? Ответ поясните.
Составляя вышеприведенные схемы строения атома, мы не учитывали, что электроны в атоме занимают не только определённые уровни, но и определённые подуровни каждого уровня. Вид подуровня обозначается латинской буквой: s, p, d.
Число возможных подуровней равно номеру уровня, т. е.
На каждом подуровне может находиться строго ограниченное число электронов:
Подуровни одного уровня заполняются в строго определённом порядке:
Таким образом, р-подуровнь не может начать заполняться, если не заполнен s-подуровень данного энергетического уровня и т. д. Исходя из этого правила, несложно составить электронную конфигурацию атома марганца (рис. 10).
В целом электронная конфигурация атома марганца выглядит так:
Здесь и далее приняты обозначения (рис. 11).
Задание 3.10. Составьте электронные конфигурации атомов для химических элементов № 16, 26, 33, 37.
Для чего необходимо составлять электронные конфигурации атомов? Для того чтобы определять свойства этих химических элементов!
Для этого следует помнить: в химических процессах участвуют только валентные электроны.
Валентные электроны находятся на внешнем энергетическом уровне и незавершённом d-подуровне предвнешнего уровня.
Определим число валентных электронов для марганца:
Строение атома и свойства элементов
Мы получили краткую электронную формулу атома марганца, которая отражает распределение его валентных электронов. Что можно определить по этой формуле?
1. Какие свойства — металла или неметалла — преобладают у этого элемента? Ответ: марганец — металл, так как на внешнем (четвёртом) уровне 2 электрона.
2. Какой процесс характерен для металла? Ответ: всегда только отдача электронов.
3. Какие электроны и сколько их будет отдавать атом марганца? Ответы:
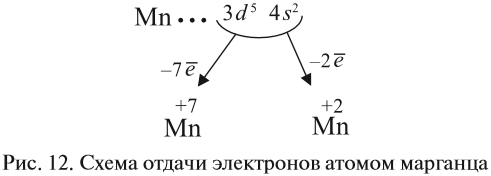
Все эти рассуждения и заключения можно отразить при помощи схемы (рис. 12).
Полученные условные заряды атома называются степенью окисления.
Рассматривая строение атомов кислорода и водорода и рассуждая аналогично, можно показать, что типичными степенями окисления для кислорода является –2, а для водорода +1.
Вопрос. С каким из этих химических элементов может образовывать соединения марганец, если учесть полученные выше степени окисления его?
Только с кислородом, так как его атом имеет противоположную по заряду (знаку) степень окисления. В этом случае несложно составить формулы соответствующих оксидов марганца (здесь степени окисления соответствуют валентностям этих химических элементов):
Строение атома марганца подсказывает, что большей степени окисления, чем +7, у марганца быть не может, так как в этом случае пришлось бы затрагивать устойчивый, теперь уже завершённый предвнешний уровень. Поэтому степень окисления +7 является высшей, а соответствующий оксид Мn2О7 — высшим оксидом марганца.
Для закрепления всех этих понятий рассмотрим строение атома теллура и некоторые его свойства (см. рис. 13). Этот рисунок показывает, что теллур относится к неметаллам, так как, во-первых, у него на внешнем уровне шесть электронов и, во-вторых, его символ находится в главной подгруппе выше линии В — At. Поэтому его атом может и принимать (до завершения внешнего уровня, и отдавать электроны. В результате, в отличие от металлов, неметалл теллур может проявлять низшую степень окисления (–2) и образовывать летучие водородные соединения с водородом (Н2Те). Высшая степень окисления атома теллура (+6), как и у металлов соответствует номеру группы и, находясь в этой степени окисления, теллур образует высший оксид ТеО3.
Задание 3.11. Изобразить электронные конфигурации атомов Nа, Rb, Сl, I, Si, Sn. Определить свойства этих химических элементов, формулы их простейших соединений (с кислородом и с водородом).
Возникает вопрос: как составить краткую электронную формулу (распределение валентных электронов), сразу, не составляя длинных электронных конфигураций? Для этого нужно помнить несколько простых правил.
1. Номер периода соответствует числу энергетических уровней у атомов химических элементов этого периода.
2. Номер группы, как правило, совпадает с числом валентных электронов, (исключение составляют только подгруппы меди и железа).
3. Подгруппа (главная или побочная) включает химические элементы, у которых имеется одинаковое распределение валентных электронов, причём в атомах элементов главной и побочной подгруппы электроны распределяются по-разному.
3.1. У элементов главных подгрупп все валентные электроны находятся на внешнем уровне, например:
V группа, главная → 5 валентных электронов
Поэтому для всех химических элементов главной подгруппы пятой группы (пять валентных электронов) распределение этих электронов следующее:
3.2. У элементов побочных подгрупп число внешних электронов не превышает двух, например:
5 валентных электронов ← V группа, побочная → 2 электрона на внешнем уровне*.
* За счёт «провала электрона» число внешних электронов может быть меньше. Но число валентных электронов при этом не меняется, поэтому свойства элемента будут такими же. Эти случаи рассмотрены в Самоучителе второго уровня, часть 1.
Для большинства химических элементов побочных подгрупп, у которых на внешнем энергетическом уровне два электрона, остальные (N – 2) валентные электроны будут находиться на d-подуровне предвнешнего уровня (N – номер группы), например:
Вопрос. Для элементов какой группы составлена такая запись?
Задание 3.12. Составьте краткие электронные формулы для атомов химических элементов № 35 и 42, а затем составьте распределение электронов в этих атомах по алгоритму. Убедитесь, что ваше «предсказание» сбылось.
Сравним теперь свойства химических элементов одной подгруппы, например:
Что общего в строении атомов этих элементов? На внешнем уровне каждого атома по одному электрону — это активные металлы. Металлическая активность связана со способностью отдавать электроны: чем легче отдает электроны атом, тем сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их к ядру. Чем ближе электроны к ядру, тем сильнее они притягиваются ядром атома, тем труднее их «оторвать».
Исходя из этого, сделаем вывод: какой элемент — Nа или Rb — легче отдает внешний электрон? Какой из них является более активным металлом? Очевидно, рубидий, так как его валентные электроны находятся дальше от ядра (и слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз металлические свойства усиливаются, так как возрастает радиус атома и валентные электроны слабее притягиваются к ядру.
Оба химических элемента — неметаллы, так как до завершения внешнего уровня не хватает одного электрона, и эти атомы будут активно притягивать недостающий электрон. При этом, чем сильнее притягивает атом неметалла недостающий электрон, тем сильнее проявляются его неметаллические свойства (способность принимать электроны).
За счёт чего происходит притяжение электрона? За счёт положительного заряда ядра атома. Но в таком случае чем ближе электрон к ядру, тем сильнее их взаимное притяжение, тем активнее неметалл.
Сделаем вывод, у какого элемента сильнее выражены неметаллические свойства: у хлора или у йода? Очевидно, у хлора, так как его валентные электроны ближе к ядру.
Вывод. Активность неметаллов в подгруппах сверху вниз убывает, так как возрастает радиус атома и все труднее притянуть недостающие электроны.
Сравним свойства кремния и олова:
На внешнем уровне обоих атомов по четыре электрона. Тем не менее эти элементы в Периодической системе находятся по разные стороны от линии, соединяющей бор и астат (см. правило в уроке 2.1.). Поэтому:
Почему? Потому что в атоме олова четыре валентных электрона находятся так далеко от ядра, что присоединение недостающих четырех электронов затруднено, в то время как отдача электронов с пятого энергетического уровня происходит достаточно легко. Для кремния возможны оба процесса, причём первый (приём электронов) — преобладает.
Сравним строение атомов и свойства химических элементов одного периода:
Вопрос. О каком периоде и каких элементах идёт речь?
Видно, что металлические свойства убывают, так как увеличивается число внешних электронов, а неметаллические свойства — возрастают. Если речь идёт о большом периоде, где большинство элементов имеет 2 электрона на внешнем уровне (элементы побочных подгрупп), то в этом случае главной причиной убывания металлических свойств в периоде является уменьшение радиуса атома. Дело в том, что за счёт увеличения заряда ядра в периоде увеличивается сила притяжения электронов к нему и уменьшается радиус атома:
Сравните: r (Ca) = 0,197 нм и r (Zn) = 0,139 нм
Вопрос. Какой из металлов более активен?
Основываясь на этих и других выводах, сформулированных в этой главе, можно для любого химического элемента Периодической системы составить алгоритм описания свойств химического элемента по его положению в Периодической системе.
1. Составить схему строения атома, т. е. определить состав ядра, распределение электронов по энергетическим уровням и подуровням:
2. Определить число валентных электронов и число внешних электронов.
3. Определить, какие свойства — металла или неметалла — сильнее проявляются у данного химического элемента (по положению в ПСХЭ).
4. Определить число отдаваемых (принимаемых) электронов.
5. Определить высшую и низшую степени окисления химического элемента.
6. Составить для этих степеней окисления химические формулы простейших соединений с кислородом и водородом.
7. Определить характер оксида (см. урок 2.1.) и составить уравнения его реакции с водой.
8. Для указанных (пункт 6) веществ составить уравнения характерных реакций (см. урок 2).
Задание 3.13. Составить по данной схеме описания атомов серы, селена, кальция и стронция и свойства этих химических элементов. Какие общие свойства имеют их оксиды? Гидроксиды?
Если вы выполнили упражнения 3.11 и 3.12, то легко заметить, что не только атомы элементов одной подгруппы, но и их соединения имеют общие свойства и похожий состав. Это отражено в Периодическом законе Менделеева: Свойства химических элементов, а также свойства простых и сложных веществ, образованных ими, находятся в периодической зависимости от ЗАРЯДА ЯДЕР ИХ АТОМОВ.
Физический смысл Периодического закона ясен: свойства химических элементов периодически повторяются потому, что периодически повторяются конфигурации валентных электронов (распределение электронов внешнего и предпоследнего уровней).
Так, у химических элементов одной и той же подгруппы одинаковое распределение валентных электронов и, значит, похожие свойства.
Выводы
Строение атома связано с положением элемента в Периодической системе. Зная строение атома, можно предсказать свойства элемента и его соединений. Эти свойства находятся в периодической зависимости от заряда ядер атомов элементов, в соответствии с Периодическим законом Менделеева.