Что такое биодоступность и какие факторы влияют на ее величину
Биодоступность
Биодоступность (обозначают буквой F) в фармакокинетике и фармакологии — в широком смысле это количество лекарственного вещества, доходящее до места его действия в организме человека (способность препарата усваиваться). Биодоступность это главный показатель, характеризующий количество потерь, т.е. чем выше биодоступность лекарственного вещества, тем меньше его потерь будет при усвоении и использовании организмом.
Для изучения биодоступности лекарственных средств используют различные методы. Чаще всего проводят сравнительное изучение изменений концентраций лекарственного вещества в исследуемой и стандартной лекарственных формах в плазме крови и/или в моче.
Обычно биодоступность определяют по количеству лекарственного вещества в крови, то есть величине введенной дозы неизмененного лекарства, которая достигла системного кровообращения, и которая является одной из важнейших фармакокинетических характеристик лекарственного средства. При внутривенном введении биодоступность лекарства составляет 100 %. (Но и при этом биодоступность может быть уменьшена введением другого препарата). Если же данное вещество введено другими путями (например, перорально), то его биодоступность уменьшается, в результате его неполного всасывания и метаболизма, которому это лекарственное средство подвергается в результате первого прохождения.
Абсолютная биодоступность — это отношение биодоступности, определенной в виде площади под кривой «концентрация-время» (ППК) активного лекарственного вещества в системном кровотоке после введения путем, иным, чем внутривенный (перорально, ректально, чрезкожно, подкожно), к биодоступности того же самого лекарственного вещества, достигнутой после внутривенного введения. Количество лекарственного вещества, всосавшегося после невнутривенного введения, является лишь долей от того количества лекарства, которое поступило после его внутривенного введения.
Такое сравнение возможно лишь после проведения уподобления доз, если применяли разные дозы для разных путей введения. Из этого следует, что каждую ППК корректируют путем деления соответствующей дозы.
В целях определения величины абсолютной биодоступности некоторого лекарственного вещества проводят фармакокинетическое исследование с целью получения графика «концентрация лекарственного вещества по отношению ко времени» для внутривенного и невнутривенного введения. Другими словами, абсолютная биодоступность — это ППК для откорректированной дозы, когда ППК, полученное для невнутривенного введения, разделено на ППК после внутривенного введения (вв). Формула расчета показателя F для некоторого лекарственного вещества, введенного перорально(по), выглядит следующим образом.
Лекарство, введенное внутривенным путем, имеет величину биодоступности, равную 1 (F=1), тогда как лекарственное вещество, введенное другими путями, имеет величины абсолютной биодоступности меньше единицы.
Относительная биодоступность — это ППК определенного лекарства, сравнимая с другой рецептурной формой этого же лекарства, принятой за стандарт, или введенной в организм другим путем. Когда стандарт представляет внутривенно введенный препарат, мы имеем дело с абсолютной биодоступностью.
Для определения относительной биодоступности могут использоваться данные об уровне содержания лекарственного вещества в крови или же его экскреции с мочой после одноразового или многократного введения. Достоверность полученных результатов значительно увеличивается при использовании перекрестного метода исследования, так как при этом устраняются различия, связанные с влиянием физиологического и патологического состояния организма на биодоступность лекарственного вещества.
Факторы, которые влияют на биодоступность. Абсолютная биодоступность некоторого лекарственного средства, введенная несосудистым путем, обычно меньше единицы (F ‹ 1,0). Разные физиологические факторы уменьшают биодоступность лекарств до их попадания в системный кровоток. К числу таких факторов относятся:
Индуцирование ферментами проявляется в виде увеличения скорости метаболизма, напр., фенитоин (противоэпилептический препарат) индуцирует цитохромы CYP1A2, CYP2C9,CYP2C19 и CYP3A4.
Ингибирование ферментами характеризуется снижением скорости метаболизма. Напр., грейпфрутовый сок угнетает функцию CYP3A → это сопровождается повышением концентрации нифедипина.
Индивидуальные вариации различий в метаболизме
Каждый из перечисленных факторов может вариировать от больного к больному (межиндивидуальная вариабельность) и даже у одного и того же больного за определенный период времени (внутрииндивидуальная вариабельность). Существуют и другие влияния. Так, поступило ли лекарство во время приема пищи или вне его, повлияет на всасывание препарата. Лекарственные средства, принятые одновременно, могут изменить всасывание и метаболизм в результате первичного прохождения. Кишечная моторика меняет скорость растворения лекарства и влияет на темп его разрушения кишечной микрофлорой. Болезненные состояния, влияющие на метаболизм в печени или функцию желудочно-кишечного тракта, также привносят свой вклад.
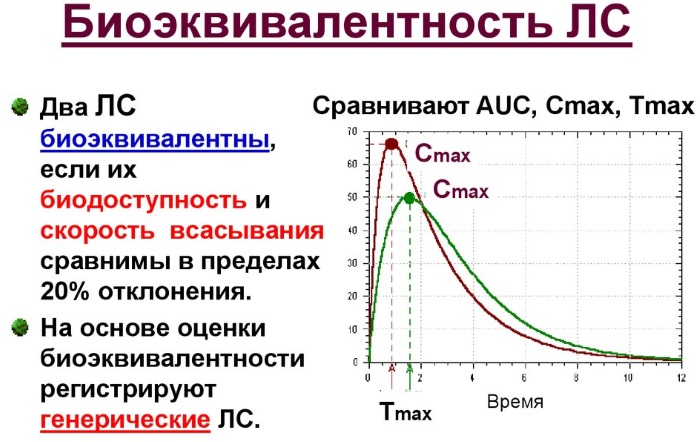
Относительная биодоступность весьма чувствительна к характеру лекарственной формы и применяется для характеристики биоэквивалентности двух лекарственных препаратов, как это видно из соотношения Исследование/Стандарт в ППК. Максимальная концентрация лекарственного препарата, достигнутая в плазме или сыворотке (Cmax) обычно используется для характеристики биоэквивалентности.
Биодоступность лекарственных средств. Что это такое, от чего зависит, примеры при различных путях введения
Большинство лекарственных средств назначают в виде пероральных препаратов или внесосудистых инъекций для лечения системных заболеваний. Следовательно, эти лекарства должны быть абсорбированы, чтобы транспортироваться к тканям-мишеням и вызывать их фармакологические действия.
Биодоступность играет ключевую роль в определении того, оказывает ли лекарство клинический эффект и как быстро он наступает.
Что такое биодоступность лекарств?
Биодоступность лекарственных средств – это количество активного вещества, которое достигло основного места действия в организме человека. Этот термин обозначает количество потерянных и сохраненных питательных или лекарственных веществ, которые необходимы для организма.
Распространенным средством определения биодоступности является измерение концентрации препарата в крови или моче через определенные промежутки времени. Врачи знают спектр биодоступности препаратов и рассчитывают дозировку для получения желаемой терапевтической концентрации лекарства.
Часто 2 термина, абсорбция и биодоступность, рассматриваются как синонимы, но между ними существует небольшая разница. Возможно, что лекарственные препараты будут быстро всасываться перорально из-за хорошей растворимости в липидах, но не будут обладать хорошей биодоступностью из-за обширной пресистемной потери.
Это относится к лекарству, потерянному между пероральным введением и первым появлением в системном кровообращении. Препарат должен пережить среду в желудочно-кишечном тракте, пересечь стенку кишки и затем пройти через воротную вену в печень.
Если молекула лекарства выживет на этом пути, она достигнет системного кровообращения. Метаболизм печени — самая большая проблема с увеличением доступности. Чтобы преодолеть слабую биодоступность, врачи увеличивают введенную дозу, изменяют фармацевтическую композицию или используют другой путь введения.
Типы биодоступности
Не все компании могут производить оригинальные лекарства, и не каждый потребитель может их себе позволить, поэтому необходимы качественные универсальные заменители активных веществ. Чтобы они соответствовали всем стандартам, необходимо проводить исследование биоэквивалентности.
Согласно определению ВОЗ, 2 препарата считаются биоэквивалентными, если они фармацевтически эквивалентны, имеют одинаковую биодоступность и при использовании в одинаковой дозе обеспечивают надлежащую эффективность и безопасность.
Понятие относительной биологической доступности
Биодоступность лекарственных средств — это доля вводимой дозы медицинского препарата, которая в неизменном виде попадает в кровоток. В медицинской практике чаще определяют относительную биодоступность. Стандартом измерения в этом случае является пероральная форма исследуемого препарата, которая хорошо изучена и успешно всасывается.

Относительную доступность препарата определяют при сравнительной оценке лекарственного средства, вводимого в стандартной лекарственной форме (стандартным может быть клинически доказанный препарат) и тестового лекарственного препарата.
Оба препарата должны быть введены одним и тем же путем. Вычисление относительной доступности необходимо в случае изменения технологии производства лекарственного средства, при изготовлении различных лекарственных форм. Относительная биодоступность выражается в процентах.
Понятие абсолютной биологической доступности
Абсолютную биодоступность можно рассчитать путем сравнения общего количества лекарственного средства, которое попадает в системный кровоток после ректального, перорального и других путей введения с общим количеством, которое достигает системного кровообращения после внутривенного введения.
Оно используется в качестве стандарта, эталона, для сравнения системной доступности лекарства, вводимого различными путями.
Когда лекарство вводится внутривенно, введенная доза напрямую поступает в системный кровоток, она не будет сталкиваться с барьерами поглощения, и, следовательно, считается, что она полностью (на 100%) биодоступна. Абсолютная биодоступность также выражается в процентах.
Факторы, влияющие на биодоступность лекарств
Есть много факторов, которые влияют на биодоступность:
Другими факторами, влияющими на биодоступность, являются взаимодействия с пищевыми продуктами, другими лекарственными средствами, а также с лекарственными травами и растительными средствами.
Что такое биоэквивалентность?
Биоэквивалентный лекарственный продукт означает, что биодоступность и клинические результаты тестируемого продукта и лекарственного средства, указанного в перечне как оригинала, существенно не отличаются. Фармакокинетические исследования проводятся для определения общих характеристик коммерчески доступного бренда и версии дженерика.
При этом биоэквивалентность или фармацевтическая эквивалентность должны присутствовать, показывая, что два препарата высвобождают активный ингредиент в кровоток в одинаковом количестве, с одинаковой скоростью и имеют одинаковое качество.
Биоэквивалентность не требует полного процесса клинических испытаний, через который должна была пройти версия оригинального бренда. Вместо этого препараты должны быть только биоэквивалентными. Биоэквивалентность позволяет назначать более дешевые дженерики.
Биоэквивалентность не может быть заявлена на основании только испытаний invitro или только исследований на животных. Биологическая эквивалентность человеческих лекарств должна быть определена у людей с помощью установленных показателей биодоступности. Точно так же препараты для животных должны быть проверены на биоэквивалентность у животных, для которых предназначен препарат.
После того как биоэквивалентность была установлена путем тестирования биодоступности статистически значимым образом, последующие партии одного и того же продукта считаются биоэквивалентными на основе мер invitro, таких как растворение лекарственного средства.
Утверждение о повышенной биологической эквивалентности не имеет смысла. Продукт не может быть более биоэквивалентным или менее биоэквивалентным.
Как определяется показатель?
Биодоступность лекарственных средств – это количество молекул действующего вещества, дошедших до назначенного места. Определяется она путем вычисления фармакокинетической кривой.
Абсолютная биодоступность:
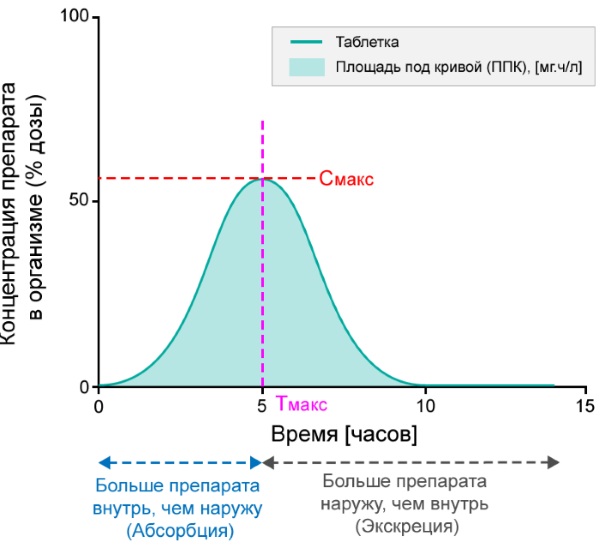
Площадь под кривой представляет собой область концентрации лекарства в плазме крови в зависимости от времени. Эта площадь показывает общее воздействие активного вещества на организм. С её помощью оценивается и сравнивается биодоступность препарата. Символ Тмакс. обозначает время самой высокой концентрации в крови, а C макс. означает максимальную концентрацию.
За меру биодоступности принимается процентное соотношение количества всосавшегося препарата исследуемой формы к количеству абсорбированного средства в той же дозе эталонной формы. Стандартом служит в/в инъекция или раствор. Биодоступность лекарственных средств устанавливается различными путями.
Это 3 основных метода:
Доклинические исследования препарата на людях охватывают несколько фаз:
| Число участников | Продолжительность | Цель |
Фаза I  | ||
| От 12 до 24 человек | Несколько месяцев | Выявление максимально безопасной дозы препарата. |
| От нескольких десятков до нескольких сотен человек | От 1–6 месяцев до 2 лет | Выявление побочных эффектов и проверка эффективности воздействия. |
| От 1 сотни до нескольких тысяч | От 1 года до нескольких лет | Подтверждение эффективности, выявление побочных действий препарата, которые не были выявлены в предыдущие фазы. |
| Несколько тысяч человек | В зависимости от препарата продолжительность опыта может быть разная. | Дополнительные вопросы проверки эффективности и безопасности. |
Испытания, проводимые в 4-й фазе, необязательны для вывода препарата на рынок. Этот период часто совпадает с активным использованием его в повседневной жизни.
Как осуществляется подготовка добровольцев?
Перед началом продажи препарата изучается биоэквивалентность и биодоступность лекарства.
С этой целью проводится следующая процедура:
Отбор кандидатов для исследования должен соответствовать следующим параметрам:
После того как волонтёр подписал договор и соглашение о конфиденциальности, исследователи проводят полный медицинский осмотр добровольцев.
Это включает в себя:
Кто допускается к исследованиям?
К доклиническим исследованиям могут привлекаться:
Испытательный центр должен пройти обязательную аккредитацию, подтверждающую научный уровень специалистов.
Составление отчета о проведенной работе
По завершении всех исследований выдается документ, в котором должны быть отражены следующие пункты:
Индивидуальные вариации различий в метаболизме
На биодоступность препаратов оказывают влияние индивидуальные различия человека, которые также учитываются при разработке новых продуктов.
К ним относятся:
Способы повышения биодоступности
Для улучшения доступности лекарственных веществ, применяются следующие методы:
Все эти способы и приемы улучшают растворимость, проницаемость препаратов через естественные барьеры на различных этапах взаимодействия лекарств в организме.
Биодоступность препаратов при различных путях введения
Биодоступность лекарственных средств – это главный показатель, который характеризует количество потерь вещества в организме. Следовательно, эффективность препарата во многом зависит от способа введения, каждый из которых имеет свои преимущества и недостатки.
Пути введения препаратов и их биодоступность:
Препараты, вводимые внутривенно, имеют биодоступность 100%, в то время как другие имеют меньший показатель, потому что:
Препарат, вводимый в организм, подвергается химическим и метаболическим изменениям, которые снижают биодоступность вещества на его конечном месте действия.
Например, некоторые лекарственные средства могут быть неэффективными при пероральном приёме, но могут быть результативными при введении путем инъекции. Выбор правильного пути поступления лекарства в организм позволяет получить максимальный терапевтический эффект от препарата.
Видео о биодоступности
Фармакология и фармакинетика простыми словами:
Понятие о биодоступности лекарственных средств
Понятие о биодоступности лекарственных средств
Биодоступность (обозначают буквой F) в фармакокинетике и фармакологии — в широком смысле это количество лекарственного вещества, доходящее до места его действия в организме человека (способность препарата усваиваться). Биодоступность это главный показатель, характеризующий количество потерь. То есть чем чем выше биодоступность лекарственного вещества, тем меньше его потерь будет при усвоении и использовании организмом.
Для изучения биодоступности лекарственных средств используют различные методы. Чаще всего проводят сравнительное изучение изменений концентраций лекарственного вещества в исследуемой и стандартной лекарственных формах в плазме крови и/или в моче.
Обычно биодоступность определяют по количеству лекарственного вещества в крови, то есть величине введенной дозы неизмененного лекарства, которая достигла системного кровообращения, и которая является одной из важнейших фармакокинетических характеристик лекарственного средства. При внутривенном введении биодоступность лекарства составляет 100 %. (Но и при этом биодоступность может быть уменьшена введением другого препарата). Если же данное вещество введено другими путями (например, перорально), то его биодоступность уменьшается, в результате его неполного всасывания и метаболизма, которому это лекарственное средство подвергается в результате первого прохождения.
Биодоступность является также одним из существенных параметров, применяемых в фармакокинетике, учитываемых при расчете режима дозирования для путей введения лекарственных средств, отличающихся от внутривенного. Определяя биодоступность некоторого лекарства, мы характеризуем количество терапевтически активного вещества, которое достигло системного кровотока и стало доступно в месте приложения его действия.
Абсолютная биодоступность — это отношение биодоступности, определенной в виде площади под кривой «концентрация-время» (ППК) активного лекарственного вещества в системном кровотоке после введения путем, иным, чем внутривенный (перорально, ректально, чрезкожно, подкожно), к биодоступности того же самого лекарственного вещества, достигнутой после внутривенного введения. Количество лекарственного вещества, всосавшегося после невнутривенного введения, является лишь долей от того количества лекарства, которое поступило после его внутривенного введения.
Такое сравнение возможно лишь после проведения уподобления доз, если применяли разные дозы для разных путей введения. Из этого следует, что каждую ППК корректируют путем деления соответствующей дозы.
В целях определения величины абсолютной биодоступности некоторого лекарственного вещества проводят фармакокинетическое исследование с целью получения графика «концентрация лекарственного вещества по отношению ко времени» для внутривенного и невнутривенного введения. Другими словами, абсолютная биодоступность — это ППК для откорректированной дозы, когда ППК, полученное для невнутривенного введения, разделено на ППК после внутривенного введения (вв). Формула расчета показателя F для некоторого лекарственного вещества, введенного перорально(по), выглядит следующим образом.
Лекарство, введенное внутривенным путем, имеет величину биодоступности, равную 1 (F=1), тогда как лекарственное вещество, введенное другими путями, имеет величины абсолютной биодоступности меньше единицы.
Относительная биодоступность — это ППК определенного лекарства, сравнимая с другой рецептурной формой этого же лекарства, принятой за стандарт, или введенной в организм другим путем. Когда стандарт представляет внутривенно введенный препарат, мы имеем дело с абсолютной биодоступностью.
Для определения относительной биодоступности могут использоваться данные об уровне содержания лекарственного вещества в крови или же его экскреции с мочой после одноразового или многократного введения. Достоверность полученных результатов значительно увеличивается при использовании перекрестного метода исследования, так как при этом устраняются различия, связанные с влиянием физиологического и патологического состояния организма на биодоступность лекарственного вещества.
Факторы, которые влияют на биодоступность. Абсолютная биодоступность некоторого лекарственного средства, введенная несосудистым путем, обычно меньше единицы (F ‹ 1,0). Разные физиологические факторы уменьшают биодоступность лекарств до их попадания в системный кровоток. К числу таких факторов относятся:
· физические свойства лекарственного средства, в частности, гидрофобность, степень диссоциации на ионы, растворимость),
· лекарственные формы препарата (немедленное высвобождение, применение вспомогательных веществ, методы производства, измененное — замедленное, удлиненное или длительное высвобождение,
· введено ли лекарственное средство натощак или после приема пищи,
· различия в течение суток,
· скорость опорождения желудка,
· индуцирование/ингибирование другими лекарственными средствами или пищей:
o взаимодействие с другими лекарствами (антацидами, алкоголем, никотином),
o взаимодействие с отдельными продуктами питания (грейпфрутовый сок, помело, клюквенный сок).
· белки-переносчики, субстрат для белка-переносчика (напр., P-гликопротеин).
· состояние желудочно-кишечного тракта, его функция и морфология.
При превалировании в клинической картине:
Астматического (бронхообструктивного) синдрома:
2. Преднизолон 90-120 мг или дексазон 8-16 мг или гидрокортизон 125-250 мг в/в струйно.
3. Антигистаминные препараты(Н-1- и Н-2-гистаминоблокаторы) в/в (см.выше).
4. 40-80 мг лазикса (фуросемида) в/в.
1.Катехоламины (вазопрессорные препараты) в инъекционных форма (адреналин, норадреналин, дофамин, мезатон). Препараты данной группы оказывают периферическое сосудосуживающее действие за счёт стимуляции альфа-1- (адреналин, мезатон, дофамин в больших дозах, норадреналин) и альфа-2- (норадреналин) адренорецепторов сосудов. Стимулируют сократительную активность миокарда и увеличивают сердечный выброс (адреналин, дофамин в малых и средних дозах) за счёт стимуляции В-1-адренорецепторов миокарда, оказывают бронхолитическое действие (адреналин, дофамин в малых и средних дозах) за счёт стимуляции В-2-адренорецепторов бронхов.
2.Глюкокортикостероиды (ГКС) в инъекционных формах (преднизолон, дексаметазон, гидрокортизон, целестон). Применяемые в больших дозах ГКС оказывают выраженное положительное действие на гемодинамику больного. Применение ГКС в стандартных дозах (1-2 мг/кг массы в расчёте на преднизолон) рассчитано, прежде всего, на гипосенсибилизацию больного и профилактику рецидива ЛАШ. Гипосенсибилизирующий эффект ГКС развивается не ранее чем через 1-2 часа после в/в введения препаратов данной группы (быстрее всего оказывает положительное действие гидрокортизон, как препарат наиболее близкий по свойствам к эндогенному гидрокортизону). Именно такой промежуток времени необходим для синтеза в организме больного специфических иммуносупрессорных белков. 3. Увлажнённый кислород.
5.Плазмозамещающие растворы (0,9 % раствор NaCl, 5 % раствор глюкозы). Струйное введение кристаллоидных растворов способствует уменьшению относительной гиповолемии как за счёт увеличения объёма циркулирующей крови, так и за счёт рефлекторного сосудосуживающего действия при раздражении вводимым струйно препаратом эндотелия сосудов. Преимуществами кристаллоидных плазмозаменителей являются их способность быстро покидать сосудистое русло, что позволяет быстро ликвидировать гиперволемию, а так же их низкая аллергогенность в сравнении с производными декстран.
Используемые в настоящее время антагонисты Н1-гистаминорецепторов 2-го (например, Терфенадин (Селдан), Лоратадин (Кларитин), Астемизол (Гисманал), Цетиризин (Зиртек), Фенкарол) и 3-го поколений (Фексофенадин (Телфаст, Аллегра), Норастемизол (Сепракор), Дескарбоэтоксилоратадин) обладают примерно одинаковой эффективностью, но различаются силой седативного, холинергического эффектов и переносимостью. Напрмер, для препарато 2-го поколения характерным является кардиотоксичекий эффект обусловленный блокадой калиевых каналов, что приводит к удлинению интервала QT и развитию двунаправленной веретенообразной желудочковой тахикардии (типа «пируэт»). Кроме того, препараты 2-го и 3-го поколений Н-1-гистаминоблокаторов выпускаются только в лекарственных формах для приёма внутрь, что ограничивает их применении в ургентных ситуациях, но позволяет использовать эти препараты для профилактики рецидива ЛАШ. Если лечение антагонистами Н1-рецепторов эффективно, дозу препарата необходимо снижать постепенно во избежание обострения заболевания.
7.Блокаторы Н-2-гистаминорецепторов (циметидин, ранитидин) в инъекционных формах. Результаты некоторых исследований свидетельствуют о целесообразности такого сочетания. В качестве монотерапии блокаторы Н2-рецепторов недостаточно эффективны. Назначение этих препаратов целесообразно только при сочетании анафилактического шока с определенными типами крапивницы и ангионевротического отека. В рефрактерных случаях необходим подбор комбинации препаратов.
При лечении бронхиальной астмы используются антагонисты ß2-адренергических рецепторов: короткого (сальбутамол, тербуталин, фенотерол) и длительного (сальметерол, формотерол, кленбутерол) действия. Препараты этой группы уменьшают спазм гладкой мускулатуры бронхов и секрецию. Антагонисты ß,- и (ß2-рецепторов являются соответственно неселективными и потому могут оказывать негативное воздействие на сердечную мышцу. Теофиллин, использующийся для лечения бронхиальной астмы, обладает бронходилатирующим и отхаркивающим свойством, положительно влияет на сократительную способность дыхательной мускулатуры. Теофиллин представлен препаратами короткого и длительного действия.
К патогенетическим методам лечения аллергических заболеваний относится аллергенспецифическая иммунотерапия, которая проводится при лечении сезонных и круглогодичных заболеваний, протекающих как аллергическая реакция I типа: аллергический ринит, конъюнктивит, атопическая бронхиальная астма, атопический дерматит, анафилактическая реакция на ужаление перепончатокрылыми. Этот метод также применяется и при инфекционно-зависимой аллергической реакции, однако его эффективность в этих случаях дискутируется. Метод заключается в подкожном введении причинно-значимого аллергена с постепенным увеличением его концентрации. Аллерген вводят парентерально, перорально, сублингвально, интраназально, эндобронхильно. После аллергенспецифической иммунотерапии происходят снижение тканевой чувствительности к аллергену, неспецифической тканевой гиперреактивности и угнетение аллергического воспаления. аллергенспецифическая иммунотерапия является основным патогенетическим методом лечения больных атопическими заболеваниями. Для проведения аллергенспецифической иммунотерапии необходимы показания, отсутствие противопоказаний и квалифицированный подход к лечению.
Помимо лекарственных средств используются и другие методы лечения. При осложненной бронхиальной астмы с явлениями обструкции эффективны лечебные бронхоскопические процедуры. У пациентов с атопическим дерматитом и токсико-аллергической реакцией применяются экстракорпоральная иммунофармакотерапия, плазмаферез. При аллергическом рините с полипозом необходимо хирургическое лечение. Больным с респираторной аллергией полезны физиотерапевтические методы лечения, лечебный массаж, лечебная гимнастика, плавание.
При внутримышечном и подкожном введении создаются депо препарата в тканях, которые постепенно всасываются (резорбция), распределяются и оказывают эффект. Такой путь широко используется, когда лекарство разрушается (пенициллин) или не всасывается в желудочно-кишечном тракте (аминогликозиды).
Ингаляционный путь введения используется для введения газов и летучих веществ в анестезиологии, а также аэрозолей для лечения бронхиальной астмы.
Аэрозоли представляют собой частицы, взвешенные в газовой среде. Эти частицы могут быть жидкими (пары), твёрдыми (дым) или мелкодисперсным порошком. Аэрозоли позволяют добиться высокой концентрации препарата в дыхательных путях и оказывают быстрое и мощное локальное действие на слизистую бронхов.
Возможно, использование местных аппликаций препаратов на сухую кожу и слизистые. Следует иметь в виду, что часть препарата при местном применении неизбежно всасывается и оказывает резорбтивный эффект.
6.1 Побочные лекарственные эффекты.
Побочный эффект – это любое нежелательное или не предполагаемое следствие применения лекарства.
Все лекарства вызывать побочные эффекты. Риск побочных эффектов должен учитываться по сравнению с ожидаемой терапевтической пользой. Частота побочных эффектов составляет 10-15%. Частота выше при множественной лекарственной терапии и у пожилых.
Различают предсказуемые побочные эффекты. Они связаны с фармакологическими свойствами лекарства и представляют увеличенную, но качественно нормальную реакцию на лекарство.
Это самые распространенные побочные эффекты. Они связаны с дозой и наиболее предотвратимы.
Непредсказуемые побочные эффекты. Они связаны с особенностями пациента, а не с известными лекарственными эффектами. Они включают аллергию и идиосинкразию. Они встречаются реже, обычно не связаны с дозой, более опасны и требуют отмены лекарства.
По степени тяжести побочные реакции различают:
От 10% до 20% больных в больнице имеют побочные реакции. Их делят на дозозависимые и не связанные с дозой.
Лекарственные средства, оказывая полезное терапевтическое действие, могут вызывать и нежелательные реакции организма. Согласно определению ВОЗ, побочный эффект определяется как любое нежелательное или вредное действие лекарственного средства. Побочные действия различной степени выраженности могут возникать при приеме всех лекарственных препаратов, и могут являться причиной снижения качества жизни больного во время лечения, а в отдельных случаях – приводят к серьезным нарушениям здоровья и могут носить жизнеугрожающий характер.
Нет лекарственных средств, полностью лишенных побочных эффектов. Врач должен быть знаком с ними, вовремя их диагностировать, предупреждать, а в случае появления – и лечить их.
Побочные эффекты лекарственных препаратов часто являются причиной отказа больного от лечения.
Различают следующие типы побочных реакций:
1. избыточный фармакологический эффект;
2. сопутствующие нежелательные побочные эффекты;
3. лекарственная зависимость, синдром отмены;
Избыточный фармакологический эффект. Он обусловлен избыточным содержанием препарата в организме вследствие накопления или вследствие передозировки лекарственного средства в результате сниженного выведения или метаболизма. Например, передозировка седативных препаратов ведет к длительному бессознательному состоянию. Передозировка антигипертензионных препаратов ведет к артериальной гипотензии. При передозировке лекарственных средств возможно появление токсических эффектов, не связанных с фармакологическим эффектом. Такого рода эффекты обычно носят органотропный характер и проявляются нарушениями со стороны почек, печени или крови
Так, например, передозировка антибиотиков из группы аминогликозидов ведет к нефротоксичности или ототоксичности. Предрасполагает к развитию органных токсических эффектов заболевание данного органа, а также назначение двух препаратов с однонаправленным токсическим действием, а также нарушение биотрансформации и элиминации.
Митохондриальные субстраты, янтарная, глутаминовая, яблочная кислоты в составе лекарственных средств, способны нормализовать процессы биотрансформации и элиминации лекарств при нарушениях функции печени и почек.
Сопутствующие нежелательные побочные эффекты. Они обусловлены введением лекарственного вещества в терапевтических дозах и обусловлены влиянием на однотипные рецепторы по всему организму. Практически каждый лекарственный препарат наряду с основным лечебным эффектом имеет сопутствующие эффекты, которые не нужны для лечения данного заболевания, но являются неизбежным приложением к основному действию. Например, использование при анафилактических кожных реакциях димедрола неизбежно сопровождается седацией и сонливостью в результате действия на ЦНС. Больного необходимо предупредить о возможных сопутствующих нежелательных эффектах и часто такого рода эффекты являются той ценой, которую платит больной за лечение.
Лекарственная зависимость. Она характеризуется потребностью в повторении приема лекарственных средств. Различают психическую зависимость, при которой прием препарата используется для получения приятных ощущений, связанных с повышением настроения. Постепенно психическая зависимость переходит в физическую, при которой прием препарата необходим для снятия крайне неприятных симптомов абстиненции. Наиболее часто психическая и физическая зависимость развивается к алкоголю, снотворным и наркотическим анальгетикам.
Другой формой лекарственной зависимости является синдром отмены. Резкая отмена препарата может вызвать значительное повышение функций, ранее подавляемых лекарственным препаратом. Так, быстрая отмена антиангинальных препаратов (нитраты, бета-блокаторы) ведет к приступу стенокардии. Поэтому производится постепенная отмена большинства лекарственных препаратов.
Генетически обусловленные побочные эффекты. Повседневная практика показывает, что эффект одного и того же лекарственного средства неодинаков у различных людей. Эти различия могут быть обусловлены генетическими факторами.
При повторном введении некоторых лекарственных веществ возможна лекарственная зависимость. Под лекарственной зависимостью понимают потребность в повторных приемах препарата для того, чтобы воспроизвести его воздействие на психику или избежать симптомов, связанных с прекращением приема этого вещества (синдром отмены).
Лекарственная зависимость может быть психической и физической.
Психическая зависимость характеризуется субъективной потребностью в повторном приеме для воспроизведения эйфории, повышения настроения и положительных эмоций, вызываемых этими веществами.
Физическая зависимость хар-ся крайне неприятными для больного явлениями абстиненции и лишь повторный прием соответствующего препарата снимает симптомы абстиненции. Если при психической зависимости, упрощенно говоря, человек принимает вещество для получения удовольствия, то при физической зависимости человек вынужден принимать вещество для снятия крайне тягостных симптомов абстиненции. Лекарственные вещества, способные вызвать лекарственную зависимость, находятся под контролем, и отпуск их сопряжен с рядом ограничений. Частным видом лекарственной зависимости является наркомания и токсикомания. Толерантность, психическая и физическая зависимость развиваются параллельно.
Критерием эффективности антибактериальной терапии является стойкая нормализация температуры тела не позже, чем на третий день от начала лечения, и нормализация лейкоцитарной формулы. В этом случае общая продолжительность введения антибиотиков составляет 7-10 дней, то есть до рассасывания воспалительного инфильтрата в легких.
Дезинтоксикационная терапия. При нетяжелых пневмониях достаточно приема жидкости внутрь в объеме 1.5-2 л в сутки. При тяжелых пневмониях проводится инфузионная терапия. Во избежании развития отека легких следует строго контролировать количество вводимой жидкости. Ориентиром служат прежде всего клинические признаки, а не центральное венозное давление. Предпочтение отдается осмотически активным жидкостям. Эффективны препараты, изготовленные на основе поливинилпирролина (гемодез, неогемодез), поливинилового спирта (полидез). Их вводят в/в капельно по 200-400 мл два раза в сутки. При низком артериальном давлении показано вливание 100-200 мл полиглюкина среднемолекулярного декстрана, который благодаря относительно большой молекулярной массе циркулирует в крови до двух суток, удерживая жидкость в кровяном русле. К осмотически активным жидкостям можно добавить вливание в вену изотонического раствора NaCl, 5% раствора глюкозы. При снижении температуры тела и улучшении общего состояния больного инфузии жидкостей следует заменить обильным питьем.
Коррекция иммунных нарушений При пневмококковой долевой (крупозной)пневмонии нередко выражен гиперергичекий компонент воспаления. В этом случае благоприятное действие может оказать добавление к терапии после снижения температуры глюкокортикоидов —преднизолона в дозе 15-20 мг в сутки. В ряде случаев это значительно ускоряет рассасывание воспалительного инфильтрата.
Физиотерапия Играет существенную роль в лечении пневмонии. При нормализации температуры или снижении ее до субфебрильных величин, уменьшении выраженности интоксикации назначается электрическое поле УВЧ.
В последние годы интерес к макролидам значительно возрос, что объясняется не только их исключительной эффективностью при лечении атипичных пневмоний, но и возможностью применения при пневмококковых и стрептококковых пневмониях. Было установлено, что макролиды накапливаются в легочной паренхиме, слизистой оболочке бронхов, альвеолярных макрофагах, создавая высокие местные концентрации.
Таблетированные макролиды представлены в России широким спектром препаратов. Родоначальником этих антибиотиков является эритромицин, который назначается по 400-500 мг каждые 6 ч. Джозамицин применяется по 500 мг 3-4 раза в сутки. Мидекамицин назначается по 400 мг каждые 8 ч. Спирамицин выпускается в таблетках по 1,5 и 3,0 млн МЕ. При лечении атипичных пневмоний спирамицин назначают по 3,0 млн МЕ 2 раза в сутки. Рокситромицин используется по 150 мг каждые 12 ч, а в легких случаях может применяться по 300 мг 1 раз в сутки. Кларитромицин назначают по 250 мг каждые 12 ч. Кларитромицин также выпускается и в таблетках по 500 мг. Эта лекарственная форма может использоваться каждые 12 ч при пневмониях средней тяжести. Близким по спектру действия к макролидам является антибиотик из группы азалидов азитромицин. Этот антибиотик выпускается в капсулах по 250 мг и таблетках по 500 мг. Существуют две схемы лечения азитромицином. Препарат можно назначать по 500 мг в первые сутки и по 250 мг каждые 24 ч в последующие дни лечения. Другая схема предусматривает использование азитромицина по 500 мг каждые 24 ч. При таком режиме дозирования доказан длительный постантибиотический эффект, достигающий 72 ч, если азитромицин применяли не менее 3 дней. В случаях, когда предполагается бактериемия, азитромицин не используют и предпочтение отдают кларитромицину.
При аспирационных ГП высока вероятность этиологической роли анаэробов, поэтому в схему лечения включают антианаэробные препараты широкого спектра действия (защищенные b-лактамы, цефокситин, цефотетан, цефметазол, карбапенемы) или узкой направленности (метронидазол, тинидазол, линкомицин, клиндамицин) в комбинации с другими антибиотиками.
Длительность антибиотикотерапии при ГП, определяеемая обычно индивидуально, варьирует в зависимости от характера течения и колеблется от 7-10 до 14-21 дня. Клиническое улучшение не бывает явным в течение первых 48-72 часов и, следовательно, выбранную схему антимикробного лечения в этот период не следует менять; корректировать терапию лишь тогда, когда будет отмечено прогрессирующее ухудшение или будут получены соответствующие результаты первичного микробиологического исследования. Основным критерием завершения антибиотикотерапии является стойкая (в течение 3-4 дней) нормализация температуры. Сохранение отдельных клинических, лабораторных и/или рентгенологических признаков заболевания не является абсолютным показанием к продолжению антибактериальной терапии или ее модификации. В подавляющем большинстве случаев их разрешение происходит самопроизвольно или под влиянием патогенетической и симптоматической терапии.
Фармакотерапия острой астмы
Итак, все препараты, которые используются для лечения бронхиальной астмы, принято делить на две группы: базисные или лечебные, то есть обладающие противовоспалительным эффектом, и симптоматические, обладающие преимущественно быстрой бронхолитической активностью.
Препараты бронхолитического действия применяются как для купирования острого приступа астмы при хроническом ее течении, так и для профилактики астмы физических нагрузок, острой астмы, индуцированной аллергеном, а также для снятия тяжелого бронхоспазма при обострении бронхиальной астмы.
Ключевые положения в бронхолитической терапии бронхиальной астмы:
* β2-агонисты короткого действия являются наиболее эффективными бронхолитиками;
* ингаляционные формы бронхолитических препаратов предпочтительнее по сравнению с оральными и парентеральными формами.
1. Глюкокортикоиды (ГК)— Триамцинолон (азмакорт), Будесонид (пульмикорт), Преднизолон. принадлежат к числу наиболее эффективных противоастматических средств. Механизм их действия сложный. При лечении бронхиальной астмы на первом плане следующие эффекты: