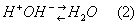Что такое буферная система
Введение в метрологию. Единство измерений. Контроль качества измерений. Аналитические технологии.в КЛД
Растворы
1. Концентрации раствора
Концентрацию растворов можно выражать следующими способами:
1. Процентная концентрация по массе (ω, %) — число единиц массы (например, число граммов) растворенного вещества (mр.в.), содержащихся в 100 единицах массы (например, в 100 граммах) раствора (mр-ра):
ω= (mр.в.·100%)/mр-ра.
Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
2. Молярность(См) — число моль (n) растворенного вещества, содержащихся в 1 л раствора:
С м = n/V.
3. Молярная концентрация эквивалента (нормальность)(СН):— число моль эквивалентов (nэкв) растворенного вещества, содержащихся в одном литре раствора: Так, 2н. H2SO4 означает раствор серной кислоты, в каждом литре которого содержится два эквивалента, т. е. 98 г H2SO4.
4. Моляльность(Сm) — число молей растворенного вещества, приходящихся на 1000 г растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000 г воды приходится два моля H2SO4. Мольно-массовая концентрация раствора – моляльность, в отличие от его молярности, не изменяется при изменении температуры.
5. Мольная доля(Ni) — отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе:
N1=n1/(n1+n2).
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2,
где СН1, СН2 – молярные концентрации эквивалента (моль) растворенного вещества 1 и 2 соответственно; V1, V2 – объемы растворов (л) 1 и 2 соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
m растворенного компонента
Для еще более разбавленных растворов или более низких содержаний компонента результаты чаще представляют числом частей на мллиард:
m растворенного компонента
При еще меньших содержаниях компонента, оперируют триллионными долями:
Что такое буферная система
Организм можно определить как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Для обеспечения стационарного состояния у всех организмов выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели – сохранению постоянства внутренней среды. Это относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций организма человека и животных называется гомеостазом.
Этот процесс осуществляется преимущественно деятельностью лёгких и почек за счёт дыхательной и выделительной функции. В основе гомеостаза лежит сохранение кислотно-основного баланса. Для нормальной жизнедеятельности большинства клеток необходимы достаточно узкие пределы рН (6,9 – 7,8), и организм вынужден постоянно осуществлять нейтрализацию образующихся кислот. Этот процесс выполняют буферные системы, которые связывают избыток ионов водорода и контролируют их дальнейшие перемещения в организме. Буферные системы играют очень важную роль, т.к. в результате различных метаболических процессов в организме постоянно образуются различные кислоты, которые сразу же нейтрализуются буферными системами: гидрокарбонатной, фосфатной, белковой и гемоглобиновой.
Главной буферной системой организма является гидрокарбонатный буфер, состоящий из Н2СО3 и NaHCО3. При рН около 7,4 в организме преобладает гидрокарбонат-ион, и его концентрация может в 20 раз превышать концентрацию угольной кислоты. По своей природе угольная кислота очень нестойкая и сразу же после образования расщепляется на углекислый газ и воду. Реакции образования и последующего быстрого расщепления угольной кислоты в организме настолько совершенны, что им часто не придают особого значения. Эти реакции катализируется ферментом карбоангидразой, который находится в эритроцитах и в почках. Особенность гидрокарбонатной буферной системы состоит в том, что она открыта. Избыток ионов водорода связывается с гидрокарбонат-ионом, образующийся при этом углекислый газ стимулирует дыхательный центр, вентиляция лёгких повышается, а излишки углекислого газа удаляются при дыхании. Так в организме поддерживается баланс рН. Чем больше в клетках образуется ионов водорода, тем больше расход буфера. На этом этапе метаболизма подключаются почки, которые выводят избыток ионов водорода, и количество гидрокарбоната в организме восстанавливается.
Фосфатный буфер может действовать как в составе органических молекул, так и в качестве свободных ионов. Одна его молекула способна связывать до трёх катионов водорода. Белки могут присоединять к своей полипептидной цепочке как кислотные, так и основные группы.
Буферная ёмкость белковой буферной системы может охватывать широкий диапазон рН. В зависимости от имеющейся величины рН она может связывать как гидроксильные группы, так и ионы водорода. Третья часть буферной ёмкости крови приходится на гемоглобин. Каждая молекула гемоглобина может нейтрализовать несколько ионов водорода. Когда кислород переходит из гемоглобина в ткани, способность гемоглобина связывать ионы водорода возрастает и наоборот: когда в лёгких происходит оксигенация гемоглобина, он теряет присоединённые ионы водорода. Освободившиеся ионы водорода реагируют с гидрокарбонатом, и в результате образуется углекислый газ и вода. Образовавшийся углекислый газ удаляется из лёгких при дыхании.
Буферные свойства гемоглобина обусловлены соотношением восстановленного гемоглобина (ННb) и его калиевой соли (КНb). В слабощелочных растворах, каким является кровь, гемоглобин и оксигемоглобин имеют свойства кислот и являются донорами Н+ или К+. Эта система может функционировать самостоятельно, но в организме она тесно связана с гидрокарбонатной. Когда кровь находится в тканевых капиллярах, откуда поступают кислые продукты, гемоглобин выполняет функции основания: КНb + Н2СО3 ↔ ННb + КНСО3. В легких гемоглобин, напротив, ведет себя, как кислота, предотвращая защелачивание крови после выделения углекислоты.
Таким образом, механизм регуляции кислотно-основного равновесия крови в целостном организме заключается в совместном действии внешнего дыхания, кровообращения, выделения и буферных систем.
Буферные системы крови
Циркулирующая кровь представляет собой взвесь живых клеток в жидкой среде, химические свойства которой очень важны для их жизнедеятельности. У человека за норму принят диапазон колебаний pH крови 7,37-7,44 со средней величиной 7,4. Буферные системы крови слагаются из буферных систем плазмы и клеток крови и представлены [1] :
Содержание
Бикарбонатная буферная система
Фосфатная буферная система
В крови емкость фосфатной буферной системы невелика (составляет не более 1% общей буферной емкости), в связи с низким содержанием фосфатов в крови. Фосфатный буфер выполняет значительную роль в поддержании физиологических значений рН во внутриклеточных жидкостях и моче.
Буфер образован неорганическими фосфатами. Роль кислоты в этой системе выполняет одноосновный фосфат (NaH2PО4). А роль сопряженного основания — двухосновный фосфат (Na2HPО4).
При рН = 7,4 соотношение [Н2РО4-/ НРО42-] равняется 1:4.
Буферные свойства системы при увеличении в крови содержания водородных ионов реализуются за счет их связывания с ионами НРО42- с образованием Н2РО4- (Н+ + НРО42- → Н2РО4-), а при избытке ионов ОН- — за счет связывания их с ионами Н2Р04- (ОН- + Н2РО4- → НРО4-2 + Н2О).
Фосфатная буферная система крови тесно взаимосвязана с бикарбонатной буферной системой.
Белковая буферная система
В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия.
Гемоглобиновая буферная система
Самая мощная буферная система крови (в 9 раз мощнее бикарбонатной), на долю которой приходится 75 % всей буферной ёмкости крови. [H+]=K*[HHbO2]/[KHb]
Механизм действия гемоглобинового буфера 1. [общий механизм] Hb- + H+ = HHb HHbO2 + OH- = H2O + HbO2- 2. Гемоглобин является белком, он амфотерен
Протеин протеин протеин H2CO3 > HHb
См. также
Примечания
Литература
Использованная литература
Ссылки
Полезное
Смотреть что такое «Буферные системы крови» в других словарях:
Буферные системы — буферные растворы, буферные смеси, системы, поддерживающие определённую концентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним … Большая советская энциклопедия
БУФЕРНЫЕ СВОЙСТВА — БУФЕРНЫЕ СВОЙСТВА, способность многих веществ ослаблять изменение активной реакции (см.) раствора, к рое без них произошло бы при прибавлении к раствору кислот или щелочей. Это стабилизирующее влияние на реакцию раствора называется буферным… … Большая медицинская энциклопедия
БУФЕРНЫЕ РАСТВОРЫ — буферные системы, р ры, поддерживающие постоянный водородный показатель (рН) среды при разбавлении, концентрировании или добавлении к т или щелочей (не превышая нек рого предела). Примеры Б. р.: р р уксусной к ты и её натриевой соли, р р борной к … Большой энциклопедический политехнический словарь
Газы крови — газы, содержащиеся в крови животных и человека в растворённом состоянии и в химически связанном виде. Полное исследование Г. к. человека было впервые проведено И. М. Сеченовым (1859). Г. к. состоят из газов, поступающих из окружающей… … Большая советская энциклопедия
Группа крови — У этого термина существуют и другие значения, см. Группа крови (значения). Нашивка над левым нагрудным карманом на форме военнослужащего РФ содержит информацию о группе крови и резус факторе бойца (на снимке во … Википедия
Общий анализ крови — Клетки крови под электронным микроскопом. Клинический анализ крови анализ, позволяющий оценить содержание гемоглобина в системе красной крови, количество эритроцитов, цветовой показатель, количество лейкоцитов, тромбоцитов. Клинический анализ… … Википедия
Плазма крови — (от греч. πλάσμα нечто сформированное, образованное) жидкая часть крови, в которой взвешены форменные элементы вторая часть крови. Процентное содержание плазмы в крови составляет 52 61 %. Макроскопически представляет собой… … Википедия
Компоненты крови — составляющие цельной крови, используемые в медицинских учреждениях. В современной службе крови цельная кровь практически не используется, так как ее переливание плохо соответствует принципам этиотропной терапии, дает слишком большое число… … Википедия
Заболевания крови — большая и разнородная группа заболеваний, сопровождающихся тем или иным нарушением функций или строения тех или иных клеток крови эритроцитов, лейкоцитов или тромбоцитов, или патологическим изменением их числа повышением либо снижением, или… … Википедия
Кислородная емкость крови — Кислородная емкость крови количество кислорода, которое может быть связано кровью при её полном насыщении; выражается в объёмных процентах (об%); зависит от концентрации в крови гемоглобина. Определение Кислородной емкости крови важно для… … Википедия
Буферные системы
Полезное
Смотреть что такое «Буферные системы» в других словарях:
Буферные системы крови — (от англ. buffer, buff смягчать удар) физиологические системы и механизмы, обеспечивающие кислотно основное равновесие в крови[1]. Они являются «первой линией защиты», препятствующей резким перепадам pH внутренней среды живых… … Википедия
БУФЕРНЫЕ СВОЙСТВА — БУФЕРНЫЕ СВОЙСТВА, способность многих веществ ослаблять изменение активной реакции (см.) раствора, к рое без них произошло бы при прибавлении к раствору кислот или щелочей. Это стабилизирующее влияние на реакцию раствора называется буферным… … Большая медицинская энциклопедия
БУФЕРНЫЕ РАСТВОРЫ — буферные системы, р ры, поддерживающие постоянный водородный показатель (рН) среды при разбавлении, концентрировании или добавлении к т или щелочей (не превышая нек рого предела). Примеры Б. р.: р р уксусной к ты и её натриевой соли, р р борной к … Большой энциклопедический политехнический словарь
Буферные растворы — см. Буферные системы … Большая советская энциклопедия
Буферный раствор — Буферные растворы (англ. buffer, от buff смягчать удар) растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и… … Википедия
Кислотно-щелочное равновесие — I Кислотно щелочное равновесие (синоним: кислотно основное равновесие, кислотно щелочной баланс, равновесие кислот и оснований) относительное постоянство концентрации водородных ионов во внутренних средах организма, обеспечивающее полноценность… … Медицинская энциклопедия
Кровь — I (sanguis) жидкая ткань, осуществляющая в организме транспорт химических веществ (в т.ч. кислорода), благодаря которому происходит интеграция биохимических процессов, протекающих в различных клетках и межклеточных пространствах, в единую систему … Медицинская энциклопедия
Гомеостаз — (др. греч. ὁμοιοστάσις от ὁμοιος одинаковый, подобный и στάσις стояние, неподвижность) саморегуляция, способность открытой системы сохранять постоянство своего внутреннего состояния посредством скоординированных реакций,… … Википедия
Электрофорез белков в полиакриламидном геле — Фотография полиакриламидного геля, иллюстрирующая разделение белков по молекулярной массе. Маркеры на левой дорожке У этого термина существуют и другие значения, см. Электрофорез в полиакриламидном геле. Электрофорез белков в полиакриламидном… … Википедия
Бу́ферные раство́ры — (синоним: буферные смеси, буферные системы, буферы) растворы с определенной концентрацией водородных ионов, содержащие сопряженную кислотно основную пару, обеспечивающую устойчивость величины их водородного показателя при незначительных… … Медицинская энциклопедия
Введение в метрологию. Единство измерений. Контроль качества измерений. Аналитические технологии.в КЛД
Растворы
1. Концентрации раствора
Концентрацию растворов можно выражать следующими способами:
1. Процентная концентрация по массе (ω, %) — число единиц массы (например, число граммов) растворенного вещества (mр.в.), содержащихся в 100 единицах массы (например, в 100 граммах) раствора (mр-ра):
ω= (mр.в.·100%)/mр-ра.
Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
2. Молярность(См) — число моль (n) растворенного вещества, содержащихся в 1 л раствора:
С м = n/V.
3. Молярная концентрация эквивалента (нормальность)(СН):— число моль эквивалентов (nэкв) растворенного вещества, содержащихся в одном литре раствора: Так, 2н. H2SO4 означает раствор серной кислоты, в каждом литре которого содержится два эквивалента, т. е. 98 г H2SO4.
4. Моляльность(Сm) — число молей растворенного вещества, приходящихся на 1000 г растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000 г воды приходится два моля H2SO4. Мольно-массовая концентрация раствора – моляльность, в отличие от его молярности, не изменяется при изменении температуры.
5. Мольная доля(Ni) — отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе:
N1=n1/(n1+n2).
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2,
где СН1, СН2 – молярные концентрации эквивалента (моль) растворенного вещества 1 и 2 соответственно; V1, V2 – объемы растворов (л) 1 и 2 соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
m растворенного компонента
Для еще более разбавленных растворов или более низких содержаний компонента результаты чаще представляют числом частей на мллиард:
m растворенного компонента
При еще меньших содержаниях компонента, оперируют триллионными долями: