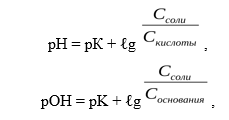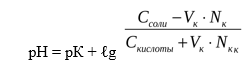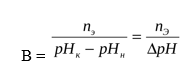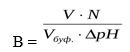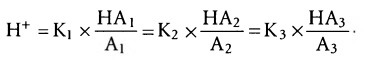Что такое буферные системы каким образом проявляется буферность клетки
Что такое буферные системы каким образом проявляется буферность клетки
Организм можно определить как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Для обеспечения стационарного состояния у всех организмов выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели – сохранению постоянства внутренней среды. Это относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций организма человека и животных называется гомеостазом.
Этот процесс осуществляется преимущественно деятельностью лёгких и почек за счёт дыхательной и выделительной функции. В основе гомеостаза лежит сохранение кислотно-основного баланса. Для нормальной жизнедеятельности большинства клеток необходимы достаточно узкие пределы рН (6,9 – 7,8), и организм вынужден постоянно осуществлять нейтрализацию образующихся кислот. Этот процесс выполняют буферные системы, которые связывают избыток ионов водорода и контролируют их дальнейшие перемещения в организме. Буферные системы играют очень важную роль, т.к. в результате различных метаболических процессов в организме постоянно образуются различные кислоты, которые сразу же нейтрализуются буферными системами: гидрокарбонатной, фосфатной, белковой и гемоглобиновой.
Главной буферной системой организма является гидрокарбонатный буфер, состоящий из Н2СО3 и NaHCО3. При рН около 7,4 в организме преобладает гидрокарбонат-ион, и его концентрация может в 20 раз превышать концентрацию угольной кислоты. По своей природе угольная кислота очень нестойкая и сразу же после образования расщепляется на углекислый газ и воду. Реакции образования и последующего быстрого расщепления угольной кислоты в организме настолько совершенны, что им часто не придают особого значения. Эти реакции катализируется ферментом карбоангидразой, который находится в эритроцитах и в почках. Особенность гидрокарбонатной буферной системы состоит в том, что она открыта. Избыток ионов водорода связывается с гидрокарбонат-ионом, образующийся при этом углекислый газ стимулирует дыхательный центр, вентиляция лёгких повышается, а излишки углекислого газа удаляются при дыхании. Так в организме поддерживается баланс рН. Чем больше в клетках образуется ионов водорода, тем больше расход буфера. На этом этапе метаболизма подключаются почки, которые выводят избыток ионов водорода, и количество гидрокарбоната в организме восстанавливается.
Фосфатный буфер может действовать как в составе органических молекул, так и в качестве свободных ионов. Одна его молекула способна связывать до трёх катионов водорода. Белки могут присоединять к своей полипептидной цепочке как кислотные, так и основные группы.
Буферная ёмкость белковой буферной системы может охватывать широкий диапазон рН. В зависимости от имеющейся величины рН она может связывать как гидроксильные группы, так и ионы водорода. Третья часть буферной ёмкости крови приходится на гемоглобин. Каждая молекула гемоглобина может нейтрализовать несколько ионов водорода. Когда кислород переходит из гемоглобина в ткани, способность гемоглобина связывать ионы водорода возрастает и наоборот: когда в лёгких происходит оксигенация гемоглобина, он теряет присоединённые ионы водорода. Освободившиеся ионы водорода реагируют с гидрокарбонатом, и в результате образуется углекислый газ и вода. Образовавшийся углекислый газ удаляется из лёгких при дыхании.
Буферные свойства гемоглобина обусловлены соотношением восстановленного гемоглобина (ННb) и его калиевой соли (КНb). В слабощелочных растворах, каким является кровь, гемоглобин и оксигемоглобин имеют свойства кислот и являются донорами Н+ или К+. Эта система может функционировать самостоятельно, но в организме она тесно связана с гидрокарбонатной. Когда кровь находится в тканевых капиллярах, откуда поступают кислые продукты, гемоглобин выполняет функции основания: КНb + Н2СО3 ↔ ННb + КНСО3. В легких гемоглобин, напротив, ведет себя, как кислота, предотвращая защелачивание крови после выделения углекислоты.
Таким образом, механизм регуляции кислотно-основного равновесия крови в целостном организме заключается в совместном действии внешнего дыхания, кровообращения, выделения и буферных систем.
Буферность и кислотность
1. Буферность — свойство клетки поддерживать определенный уровень концентрации ионов водорода (pH).
2. В клетке сохраняется слабощелочная реакция — 7,2.
3. Буферным называют такой раствор, в котором содержится смесь какой-либо слабой кислоты и ее растворимой соли.
4. Механизм поддержания кислотности таков — когда в клетке увеличивается кислотность, анионы, источником которых служит соль, соединяются с ионами водорода и устраняют их из раствора. Если же кислотность снижается, ионы водорода высвобождаются.
Кислотность в клетке
1. В процессе жизнедеятельности в клетке возникают разнообразные соединения, в том числе кислоты и щелочи. Значения pH ниже 7 указывают на кислый раствор, значения выше делают раствор щелочным.
2. Шкала кислотности включает значения от 0 до 14. Эта шкала логарифмическая — изменения pH на одну единицу соответствует изменению концентрации ионов водорода в 10 раз.
3. Важно запомнить, что буферные свойства цитоплазмы зависят от концентрации анионов слабых кислот. При большом количестве анионов они легко могут удалить протоны водорода и понизить кислотность в клетке.
Фосфатная буферная система
2. Главная роль фосфатной буферной системы состоит в том, что она поддерживает кислотно-щелочной баланс в просвете канальцев почки, а также внутриклеточной жидкости.
3. Фосфатов вообще больше внутри клетки, чем вне ее. Эта буферная система имеет мало отношения к внеклеточной жидкости.
Бикарбонатная буферная система
Содержание химических соединений в клетке
1. На первом месте по массе в процентах на сырую массу стоит вода — 75–85 процентов.
2. Далее идут белки — 10–20 процентов, жиры — 1–5 процентов, углеводы — 0,2–2 процента.
3. При потере части воды организмы могут утрачивать признаки жизни — такое состояние называется анабиозом. При улучшении условий они могут снова стать активными. Гибель организмов происходит при потере значительной части воды.
Буферные растворы в организме человека
Буферные растворы − это растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания.
Протолитические буферные растворы представляют собой смеси электролитов, содержащие одноимённые ионы.
Существует два типа протолитических буферных растворов:
Уравнение буферной системы рассчитывается по формуле Гендерсона-Гассельбаха:
С – молярная или эквивалентная концентрация электролита (C = V N)
Механизм действия буферных растворов можно рассмотреть на примере ацетатного буфера: СН3СООН + СН3СООNa [1].
Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде.
Из уравнения видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н + в буфере увеличивается, но очень незначительно, при этом рН сохраняется постоянным.
При добавлении кислоты к буферу рН определяется по формуле:
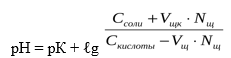
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В. Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н + практически не изменяется, и рН остаётся постоянным.
При добавлении щелочи рН определяется по формуле:
Таким образом, рН буфера зависит от константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. Стоит отметить, что рН буфера будет наибольшим при соотношении компонентов равным единице [2].
Буферная ёмкость − это способность буферной системы противодействовать изменению рН среды.
Буферная ёмкость (В) выражается количеством моль-эквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу.
где В – буферная ёмкость, nЭ– количество моль-эквивалента сильной кислоты или щелочи, рНН – начальное значение рН ( до добавления кислоты или щелочи), рНК– конечное значение рН (после добавления кислоты или щелочи), ΔрН – изменение рН.
На практике буферная ёмкость рассчитывается по формуле:
где V – объём кислоты или щелочи, N – эквивалентная концентрация кислоты или щелочи, Vбуф.— объём буферного раствора, Δ рН – изменение рН.
Буферная ёмкость зависит от концентрации электролитов и соотношения компонентов буфера. Наибольшей буферной ёмкостью обладают растворы с большей концентрацией компонентов и соотношением компонентов, равным единице [3].
В организме человека действуют следующие буферные системы:
Белок – это амфотерный электролит и поэтому проявляет собственное буферное действие. Взаимодействие буферных систем в организме по стадиям:
который нейтрализуется гидрофофат-ионами и аммиаком (аммиачный буфер):
Следует отметить, что на поддержание постоянства рН различных жидких систем организма оказывают влияние не столько буферные системы, сколько функционирование ряда органов и систем: легких, почек, кишечника, кожи и др. [5].
2. Бончев П. Р. Введение в аналитическую химию. Л.: Химия, 1978.-
4. Крешков А.Н. «Основы аналитической химии» 1-2 том. М.:Химия, 1965.-285 с.
5. Лурье Ю. Ю. Справочник по аналитической химии. М.:Химия, 1989.- 297 с.
6. Янсон Э. Ю., Путнинь Я. К. Теоретические основы аналитической химии. М.: Высшая школа, 1980.
Что такое буферные системы каким образом проявляется буферность клетки
а) Внутриклеточные буферные системы и роль белков. Белки вследствие высокого содержания во внутриклеточной жидкости являются наиболее важными компонентами внутриклеточных буферных систем.
Несмотря на то, что рН в клетках немного ниже, чем снаружи, его величина внутри клеток изменяется в соответствии с колебаниями во внеклеточной жидкости. Протоны и бикарбонаты медленно и в небольшом количестве диффундируют через клеточную мембрану, поэтому для восстановления равновесия обычно требуется несколько часов. Исключение составляют лишь эритроциты, в которых равновесие восстанавливается очень быстро.
СО2, тем не менее, способен к быстрой диффузии через мембрану. Диффузия компонентов бикарбонатной буферной системы изменяет рН внутри клеток в соответствии с колебаниями во внеклеточной жидкости. По этой причине внутриклеточные буферные системы препятствуют изменению рН во внеклеточной жидкости, хотя для достижения максимального результата может потребоваться несколько часов.
В эритроцитах главным является гемоглобиновый буфер (Нb), действующий следующим образом:
В дополнение к высокой концентрации белков в клетках другим фактором, увеличивающим буферную емкость, является значение рК белков, близкое к 7,4.
б) Изогидрическое правило: в растворе, содержащем несколько буферных систем, поддерживается одна и та же концентрация ионов водорода. Ранее мы исследовали индивидуальные свойства каждой из буферных систем в отдельности, без учета их взаимодействий с другими. Тем не менее, все они работают слаженно, поскольку уровень содержания ионов Н+ во всех жидких средах одинаков. Но каждый раз, когда возникает изменение концентрации протонов во внеклеточной жидкости, этому препятствуют все буферные системы. Это явление называют изогидрическим правилом, которое выражается следующим уравнением:
где K1, К2, К3 — константы диссоциации трех соответствующих кислот, HA1, HA2, HA3 и A1, A2, A3 — концентрация свободных анионов, которые составляют основания трех буферных систем.
Согласно этому правилу любое условие, изменяющее равновесие в одной из буферных систем, также смещает его и во всех остальных, поскольку буферные системы взаимодействуют между собой, перераспределяя ионы Н+.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»
БУФЕРНЫЕ СИСТЕМЫ И ИХ РОЛЬ В ЖИЗНЕДЕЯТЕЛЬНОСТИ ОРГАНИЗМА
Этот процесс осуществляется преимущественно деятельностью лёгких и почек за счёт дыхательной и выделительной функции. В основе гомеостаза лежит сохранение кислотно-основного баланса. Для нормальной жизнедеятельности большинства клеток необходимы достаточно узкие пределы рН (6,9 – 7,8), и организм вынужден постоянно осуществлять нейтрализацию образующихся кислот. Этот процесс выполняют буферные системы, которые связывают избыток ионов водорода и контролируют их дальнейшие перемещения в организме. Буферные системы играют очень важную роль, т.к. в результате различных метаболических процессов в организме постоянно образуются различные кислоты, которые сразу же нейтрализуются буферными системами: гидрокарбонатной, фосфатной, белковой и гемоглобиновой.
Главной буферной системой организма является гидрокарбонатный буфер, состоящий из Н2СО3 и NaHCО3. При рН около 7,4 в организме преобладает гидрокарбонат-ион, и его концентрация может в 20 раз превышать концентрацию угольной кислоты. По своей природе угольная кислота очень нестойкая и сразу же после образования расщепляется на углекислый газ и воду. Реакции образования и последующего быстрого расщепления угольной кислоты в организме настолько совершенны, что им часто не придают особого значения. Эти реакции катализируется ферментом карбоангидразой, который находится в эритроцитах и в почках. Особенность гидрокарбонатной буферной системы состоит в том, что она открыта. Избыток ионов водорода связывается с гидрокарбонат-ионом, образующийся при этом углекислый газ стимулирует дыхательный центр, вентиляция лёгких повышается, а излишки углекислого газа удаляются при дыхании. Так в организме поддерживается баланс рН. Чем больше в клетках образуется ионов водорода, тем больше расход буфера. На этом этапе метаболизма подключаются почки, которые выводят избыток ионов водорода, и количество гидрокарбоната в организме восстанавливается.
Фосфатный буфер может действовать как в составе органических молекул, так и в качестве свободных ионов. Одна его молекула способна связывать до трёх катионов водорода. Белки могут присоединять к своей полипептидной цепочке как кислотные, так и основные группы.
Буферная ёмкость белковой буферной системы может охватывать широкий диапазон рН. В зависимости от имеющейся величины рН она может связывать как гидроксильные группы, так и ионы водорода. Третья часть буферной ёмкости крови приходится на гемоглобин. Каждая молекула гемоглобина может нейтрализовать несколько ионов водорода. Когда кислород переходит из гемоглобина в ткани, способность гемоглобина связывать ионы водорода возрастает и наоборот: когда в лёгких происходит оксигенация гемоглобина, он теряет присоединённые ионы водорода. Освободившиеся ионы водорода реагируют с гидрокарбонатом, и в результате образуется углекислый газ и вода. Образовавшийся углекислый газ удаляется из лёгких при дыхании.
Таким образом, механизм регуляции кислотно-основного равновесия крови в целостном организме заключается в совместном действии внешнего дыхания, кровообращения, выделения и буферных систем.
Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для медицинских вузов. /Ю.А.Ершов, В.А.Попков, А.С.Берлянд и др. Под ред. Ю.А.Ершова), 8 изд. – М.: Высшая школа, 2010. – 560 с.