Что такое буферные свойства цитоплазмы
Физиология и нарушения кислотно-основного состояния (методические материалы к практическим и семинарским занятиям)
Информация
Справочное пособие содержит информацию о физиологии кислотно- основного состояния (КОС). Представлена информация о методах лабораторной диагностики нарушений КОС. Перечислены варианты нарушений и методы коррекции. Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Физиология кислотно-основного состояния
В норме сильных кислот образуется 50 – 100 ммоль/сутки. При избыточном образовании они вызывают тяжелые нарушения. Это происходит при анаэробном окислении глюкозы.
В норме окисление глюкозы происходит аэробно: С6Н12О2 + 6О2 = 6Н2О + 6СО2 + 38 АТФ
Рис. 1. Доставка 02 к тканям и первые стадии элиминации CO2
Рис. 2. В легких бикарбонат снова превращается в С02 и выводится
Транспорт кислорода из легких к тканям и из тканей к легким обусловлен изменениями, которые воздействуют на сродство кислорода к гемоглобину. На уровне тканей из-за снижения рН это сродство уменьшается (эффект Бора) и вследствие этого улучшается отдача кислорода. В крови легочных капилляров сродство гемоглобина к кислороду увеличивается из-за снижения рС02 и возрастания рН по сравнению с аналогичными показателями венозной крови, что приводит к повышению насыщения артериальной крови кислородом.
Первичные изменения КЩС и компенсаторные реакции
Буферность и кислотность
1. Буферность — свойство клетки поддерживать определенный уровень концентрации ионов водорода (pH).
2. В клетке сохраняется слабощелочная реакция — 7,2.
3. Буферным называют такой раствор, в котором содержится смесь какой-либо слабой кислоты и ее растворимой соли.
4. Механизм поддержания кислотности таков — когда в клетке увеличивается кислотность, анионы, источником которых служит соль, соединяются с ионами водорода и устраняют их из раствора. Если же кислотность снижается, ионы водорода высвобождаются.
Кислотность в клетке
1. В процессе жизнедеятельности в клетке возникают разнообразные соединения, в том числе кислоты и щелочи. Значения pH ниже 7 указывают на кислый раствор, значения выше делают раствор щелочным.
2. Шкала кислотности включает значения от 0 до 14. Эта шкала логарифмическая — изменения pH на одну единицу соответствует изменению концентрации ионов водорода в 10 раз.
3. Важно запомнить, что буферные свойства цитоплазмы зависят от концентрации анионов слабых кислот. При большом количестве анионов они легко могут удалить протоны водорода и понизить кислотность в клетке.
Фосфатная буферная система
2. Главная роль фосфатной буферной системы состоит в том, что она поддерживает кислотно-щелочной баланс в просвете канальцев почки, а также внутриклеточной жидкости.
3. Фосфатов вообще больше внутри клетки, чем вне ее. Эта буферная система имеет мало отношения к внеклеточной жидкости.
Бикарбонатная буферная система
Содержание химических соединений в клетке
1. На первом месте по массе в процентах на сырую массу стоит вода — 75–85 процентов.
2. Далее идут белки — 10–20 процентов, жиры — 1–5 процентов, углеводы — 0,2–2 процента.
3. При потере части воды организмы могут утрачивать признаки жизни — такое состояние называется анабиозом. При улучшении условий они могут снова стать активными. Гибель организмов происходит при потере значительной части воды.
Что такое буферные свойства цитоплазмы
Организм можно определить как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Для обеспечения стационарного состояния у всех организмов выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели – сохранению постоянства внутренней среды. Это относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций организма человека и животных называется гомеостазом.
Этот процесс осуществляется преимущественно деятельностью лёгких и почек за счёт дыхательной и выделительной функции. В основе гомеостаза лежит сохранение кислотно-основного баланса. Для нормальной жизнедеятельности большинства клеток необходимы достаточно узкие пределы рН (6,9 – 7,8), и организм вынужден постоянно осуществлять нейтрализацию образующихся кислот. Этот процесс выполняют буферные системы, которые связывают избыток ионов водорода и контролируют их дальнейшие перемещения в организме. Буферные системы играют очень важную роль, т.к. в результате различных метаболических процессов в организме постоянно образуются различные кислоты, которые сразу же нейтрализуются буферными системами: гидрокарбонатной, фосфатной, белковой и гемоглобиновой.
Главной буферной системой организма является гидрокарбонатный буфер, состоящий из Н2СО3 и NaHCО3. При рН около 7,4 в организме преобладает гидрокарбонат-ион, и его концентрация может в 20 раз превышать концентрацию угольной кислоты. По своей природе угольная кислота очень нестойкая и сразу же после образования расщепляется на углекислый газ и воду. Реакции образования и последующего быстрого расщепления угольной кислоты в организме настолько совершенны, что им часто не придают особого значения. Эти реакции катализируется ферментом карбоангидразой, который находится в эритроцитах и в почках. Особенность гидрокарбонатной буферной системы состоит в том, что она открыта. Избыток ионов водорода связывается с гидрокарбонат-ионом, образующийся при этом углекислый газ стимулирует дыхательный центр, вентиляция лёгких повышается, а излишки углекислого газа удаляются при дыхании. Так в организме поддерживается баланс рН. Чем больше в клетках образуется ионов водорода, тем больше расход буфера. На этом этапе метаболизма подключаются почки, которые выводят избыток ионов водорода, и количество гидрокарбоната в организме восстанавливается.
Фосфатный буфер может действовать как в составе органических молекул, так и в качестве свободных ионов. Одна его молекула способна связывать до трёх катионов водорода. Белки могут присоединять к своей полипептидной цепочке как кислотные, так и основные группы.
Буферная ёмкость белковой буферной системы может охватывать широкий диапазон рН. В зависимости от имеющейся величины рН она может связывать как гидроксильные группы, так и ионы водорода. Третья часть буферной ёмкости крови приходится на гемоглобин. Каждая молекула гемоглобина может нейтрализовать несколько ионов водорода. Когда кислород переходит из гемоглобина в ткани, способность гемоглобина связывать ионы водорода возрастает и наоборот: когда в лёгких происходит оксигенация гемоглобина, он теряет присоединённые ионы водорода. Освободившиеся ионы водорода реагируют с гидрокарбонатом, и в результате образуется углекислый газ и вода. Образовавшийся углекислый газ удаляется из лёгких при дыхании.
Буферные свойства гемоглобина обусловлены соотношением восстановленного гемоглобина (ННb) и его калиевой соли (КНb). В слабощелочных растворах, каким является кровь, гемоглобин и оксигемоглобин имеют свойства кислот и являются донорами Н+ или К+. Эта система может функционировать самостоятельно, но в организме она тесно связана с гидрокарбонатной. Когда кровь находится в тканевых капиллярах, откуда поступают кислые продукты, гемоглобин выполняет функции основания: КНb + Н2СО3 ↔ ННb + КНСО3. В легких гемоглобин, напротив, ведет себя, как кислота, предотвращая защелачивание крови после выделения углекислоты.
Таким образом, механизм регуляции кислотно-основного равновесия крови в целостном организме заключается в совместном действии внешнего дыхания, кровообращения, выделения и буферных систем.
Научная электронная библиотека
§ 3.1.4. Строение клетки
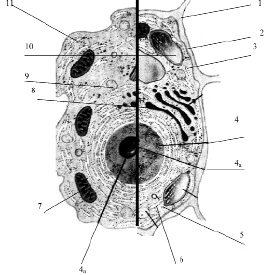
Размеры клетки широко варьируют от 0,1 мкм (некоторые бактерии) до 155 мм (яйцо страуса). У всех клеток, независимо от их формы, размеров, функциональной нагрузки обнаруживается сходное строение (рис. 3.13).
Рис. 3.13. Схема строения живой клетки: 1 – оболочка; 2 – мембрана; 3 – цитоплазма; 4 – ядро; 4а – ядрышко; 5 – рибосомы; 6 – эндоплазматическая сеть (ЭПС); 7 – митохондрии; 8 – комплекс гольджи; 9 – лизосомы; 10 – пластиды; 11 – клеточные включения
Снаружи клетка одета мембраной. Внутренняя часть клетки содержит многочисленные органоиды – структурные образования клетки, выполняющие определенные функции жизнедеятельности клетки.
1. Оболочка. Присутствует только у растительных клеток. Состоит из волокон целлюлозы. Функции оболочки: защита клетки от внешних повреждений, придает стабильную форму клетки, эластичность растительным тканям.
Повреждение наружной оболочки приводит к гибели клетки (цитолиз).
2. Мембрана. Тончайшая структура (75 Ǻ), состоит из двойного слоя молекул липидов и одного слоя белков. Такая структура обеспечивает уникальную эластичность и прочность мембране

Явление фагоцитоза – поглощение клеткой твердых частиц – впервые было описано русским врачом Мечниковым. Фагоцитарная особенность лежит в основе процесса иммунитета. Особенно развита у лейкоцитов, клеток костного мозга, лимфатических узлов, селезенки, надпочечников и гипофиза.
Пиноцитоз – поглощение клеткой растворов – состоит в том, что мельчайшие пузырьки жидкости втягиваются через образующуюся воронку, проникают через мембрану и усваиваются клеткой.
3. Цитоплазма – внутренняя среда клетки. Представляет собой гелеобразную жидкость (коллоидная система), состоит на 80 % из воды, в которой растворены белки, липиды, углеводы, неорганические вещества. Цитоплазма живой клетки находится в постоянном движении (циклоз).




4. Ядро – обязательный органоид эукариотических клеток. Впервые было исследовано и описано Р. Броуном в 1831 г. В молодых клетках расположено в центре клетки, в старых – смещается в сторону. Снаружи ядро окружено мембраной с крупными порами, способными пропускать крупные макромолекулы. Внутри ядро заполнено клеточным соком – кариоплазмой, основная часть ядра заполнена хроматином – ядерным веществом, содержащим ДНК и белок. Перед делением хроматин образует палочковидные хромосомы. Причём, хромосомы одинакового строения (но содержащие разные ДНК!) образуют пары, зрительно воспринимаемые как одно целое (рис. 3.14).
Рис. 3.14. Хромосомный набор человеческой клетки перед началом деления
Структурирование всех хромосом в пары свидетельствует о том, что число хромосом – чётное. Поэтому, его часто обозначают 2n, где n – количество хромосомных пар, а соответствующий набор хромосом называют диплоидным. Например, у голубей n = 40 (80 хромосом), у мухи n = 6 (12 хромосом), у собаки n = 39 (78 хромосом), у аскариды n = 1 (2 хромосомы). У человека n = 23 (46 хромосом). Однако, в половых клетках число хромосом в два раза меньше. Поэтому набор хромосом в половых клетках называется гаплоидным. Клетки, не являющиеся половыми называются соматическими. Иногда клетки с гаплоидным набором хромосом называют гаплоидными клетками, а с диплоидным набором хромосом – диплоидными клетками.
При слиянии двух родительских гаплоидных половых клеток образуется диплоидная клетка, дающая начало новому организму с набором генов отца и матери
Совокупность всех хромосом ядра (а значит и генов) клетки называется генотип. Именно генотип определяет все внешние и внутренние признаки конкретного организма.
В соматических клетках 44 Х-образные хромосомы (22 пары) у женщин и мужчин идентичны (сходны по строению), их называют аутосомами. А 23-я пара имеет конфигурацию ХХ – у женщин и ХY – у мужчин. Эти пары хромосом именуются половыми хромосомами.
В половых клетках 22 хромосомы также одинаковые у яйцеклеток и у сперматозоидов, а 23-я хромосома конфигурации Х – у яйцеклетки и Х или Y – у сперматозоидов. Поэтому при слиянии половых клеток и образовании пар хромосом, 23-я пара будет ( <ХY>или <ХХ>) определять пол будущего ребенка.
Необходимо помнить, что хотя в соматических клетках набор хромосом диплоидный (2n), однако, перед началом деления клеток происходит репликация ДНК, то есть, удвоение их количества, а, значит, и удвоение
количества хромосом. Поэтому перед началом деления соматической клетки в ней насчитывается 4n хромосом (рис. 16). Она становится тетраплоидной.
– хранение генетической информации;
– контроль за всеми процессами, происходящими в клетке: делением, дыханием, питанием и др.
4а. Ядрышко – структура, содержащаяся в ядре. Ядро может содержат 1, 2 или более ядрышек. Функция ядрышка – формирование рибосом.
Следует отметить, что не все клетки имеют оформленное ядро. Клетки, имеющие ядро называются эукариотическими или эукариотами. Клетки, не имеющие ядра, называются прокариотическими или прокариотами. Функции ядра у прокариот несёт одна нить ДНК (именуется хромосома), в которой хранится вся генетическая информация. К прокариотам относятся бактерии и сине-зеленые водоросли. Как правило, у прокариотов отсутствуют и некоторые другие органоиды. Размеры прокариотических клеток меньше, чем размеры эукариот.
5. Рибосомы – самые мелкие органоиды клетки. Были обнаружены в 1954 г. Французским ученым Паладом. Рибосомы были обнаружены в цитоплазме, а также на гранулярной ЭПС и в ядре.
Функция рибосом: обеспечение биосинтеза белка.
6. Эндоплазматическая сеть. Представляет собой каналы и полости, ограниченные мембраной. Различают две разновидности ЭПС: гранулярная ЭПС и агранулярная ЭПС. Гранулярная ЭПС морфологически отличается от агранулярной наличием на ее поверхности многочисленных рибосом (на агранулярной ЭПС рибосомы отсутствуют).
Функции эндоплазматической сети:
– участие в синтезе органических веществ: на гранулярной ЭПС синтезируются белки, на агранулярной – липиды и углеводы;
– транспортировка продуктов синтеза ко всем частям клетки.
Несложно уяснить, что гранулярная ЭПС характерна для клеток, синтезирующих белки (например клетки желез внутренней секреции), агранулярная ЭПС характерна для клеток-производителей углеводов и липидов (например клетки жировой ткани).
7. Митохондрии – крупные органоиды, состоящие из двойного слоя мембран: наружная – гладкая, внутренняя образует многочисленные гребнеобразные складки – кристы. Внутри митохондрии заполнены жидкостью (матрикс).
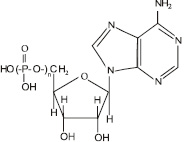
Функции митохондрий: основная функция митохондрий – обеспечение клетки энергией. Этот процесс происходит за счет синтеза аденозинтрифосфорной кислоты (АТФ) (рис. 3.15), в которой фрагмент
Рис. 3.15. Структурная формула аденозинфосфорных кислот. Для аденозинтрифосфорной кислоты n = 3, для аденозиндифосфорной кислоты n = 2, для аденозинмонофосфорной кислоты n = 1
При взаимодействии молекулы аденозинтрифосфорной кислоты с водой отщепляется один остаток фосфорной кислоты, в результате чего образуется аденозиндифосфорная кислота – АДФ и выделяется огромное количество энергии:
АТФ + Н2О = АДФ + Н3РО4 + 10 000 калорий.
Впоследствии от АДФ может отщепляться еще один остаток фосфорной кислоты, образуя АМФ – аденозинмонофосфорную кислоту.
АДФ + Н2О = АМФ + Н3РО4 + 10 000 калорий[37].
Освободившаяся энергия используется для жизнедеятельности клетки (КПД процесса превышает 80 %!).
Наряду с распадом АТФ и выделением энергии в клетке постоянно происходит синтез АТФ и накопление энергии (обратные реакции).
Количество митохондрий в клетке зависит от потребности последней в энергии. Так, в клетках кожи человека находится в среднем 5–6 митохондрий, в клетках мышц – до 1000, в клетках печени – до 2500!
8. Комплекс Гольджи. Итальянский ученый Гольджи обнаружил и описал структуру клетки, напоминающую стопки мембран, цистерны, пузырьки и трубочки. Расположена эта система чаще всего возле ядра.
Функции комплекса Гольджи: в полостях комплекса накапливаются всевозможные продукты обмена клетки, которые по каким-либо причинам не вывелись наружу. В последствии эти продукты могут быть использованы клеткой для процессов жизнедеятельности. Из пузырьков и цистерночек комплекса Гольджи в растительных клетках образуются вакуоли, заполненные клеточным соком.
9. Лизосомы – мелкие органоиды. Представляют собой пузырьки, окруженные мембраной. Внутри лизосомы заполнены пищеварительными ферментами (обнаружено 12 ферментов), которые расщепляют и переваривают крупные макромолекулы (белки, полисахариды, нуклеиновые кислоты).
Функции лизосом: растворение и переваривание макромолекул. Лизосомы участвуют в фагоцитозе. Понятно, что основная функция по перевариванию поступающих в клетку частиц принадлежит лизосомам.
10. Пластиды. Эти органоиды характерны только для растительных клеток. Форма напоминает двояковыпуклую линзу. Структура пластид напоминает таковую у митохондрий: двойной слой мембраны. Наружная – гладкая, внутренняя образует складки, называемые тилакоидами. На тилакоидах происходит основной жизненно важный для всех зеленых растений процесс – фотосинтез:
Пластиды бывают трех типов:
1) Хлоропласты – зеленые пластиды. Их цвет обусловлен наличием хлорофилла. Хлорофилл – основное вещество хлоропластов (имеет зеленый цвет). Только благодаря хлорофиллу возможен процесс фотосинтеза (см. раздел 4.2). Хлоропласты придают зеленый цвет растительным организмам.
2) Хромопласты – пластиды, имеющие различные окраски: от ярко-желтого до пурпурно-багряного. Наличие различных пигментов окрашивают плоды, цветки и осенние листья растений в соответствующие цвета. Этот факт особенно важен для привлечения насекомых к цветкам, как природный индикатор созревания плодов и др.
3) Лейкопласты – бесцветные пластиды, в которых происходит накопление запасных питательных веществ (например, крахмала).
Некоторые виды пластид могут переходить друг в друга: например, переход хлоропластов в хромопласты: созревание томатов, яблок, вишни, и т. д.; изменение окраски листьев в осенний период времени. Лейкопласты могут переходить в хлоропласты: позеленение картофеля на свету. Это доказывает общность происхождения пластид.
11. Клеточные включения. Вакуоли. Это непостоянные и необязательные составляющие клетки. Они могут появляться и исчезать в течение всей жизни клетки. К ним относятся капли жира, зерна крахмала и гликогена, кристаллы щавелево-кислого кальция и др. Жидкие продукты обмена называются клеточным соком и накапливаются они в вакуолях. В клеточном соке растворены сахара, минеральные соли, пигменты и т. д. Чем старше клетка, тем больше клеточного сока накапливает клетка. Молодые клетки практически не содержат вакуолей.
Помимо перечисленного некоторые специализированные клетки обладают специальными органоидами. К ним относятся:
– реснички и жгутики, представляющие собой выросты мембраны клетки, осуществляющие движения клетки. Они имеются у одноклеточных организмов и многоклеточных (кишечный эпителий, сперматозоиды, эпителий дыхательных путей);
– миофибриллы – тонкие нити мышечных клеток, участвующие в сокращении мышц;
– нейрофибриллы – органоиды, характерные для нервных клеток и участвующие в проведении нервных импульсов. Кроме того, в состав клеток входят центриоли – две (иногда более) цилиндрические структуры диаметром около 0,1 мкм и длиной 0,3 мкм. Место расположения центриолей в период между делениями клетки считается серединой клеточного центра. При делении клетки центриоли расходятся в противоположные стороны – к полюсам, определяя ориентацию веретена деления (рис. 16).
Следует иметь в виду, что, хотя животные и растительные клетки имеют много общего, но между ними существуют и серьёзные различия (табл. 3.1).
Более общая классификация клеток представлена на рис. 3.16.
Одно из основных отличий бактерий от архей, состоит в химическом составе мембраны. Бактерии отделены от внешней среды двойным слоем липидов (жиров и жироподобных веществ). Мембраны архей состоят из терпеновых спиртов.
Что такое буферные свойства цитоплазмы
Гемоглобин (Hb) – это сложный железосодержащий белок, который находится в эритроцитах крови и частично в плазме. Hb обеспечивает насыщение тканей организма кислородом и своевременное удаление углекислого газа из активно метаболизирующих клеток [1]. Помимо этого, исходя из своих уникальных химических свойств, гемоглобин является основным компонентом буферной системы крови, который поддерживает кислотно-щелочной баланс в организме, предотвращая алкалоз или ацидоз. Производная Hb – метгемоглобин (MetHb) – обладает пероксидазными свойствами, т.е. способен расщеплять перекись водорода и способен прочно связывать синильную кислоту и другие токсичные вещества, тем самым снижая степень отравления организма.
Цель исследования – проанализировать современные литературные данные, касающиеся функциональных особенностей Hb, и рассмотреть ситуации, которые связаны с его альтернативными и дополнительными функциями.
Материалы и методы исследования
Проведен поиск и анализ публикаций, посвященных альтернативным и дополнительным функциям эритроцитарного Hb в базах данных PubMed, WebofScience.
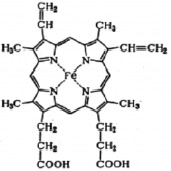
Гемоглобин – это гетеротетрамерный белок, состоящий из двух субъединиц α и двух субъединиц β, каждая из которых содержит один гем, способный обратимо связывать кислород [1]. Гем является небелковым компонентом Hb, который состоит из четырех пиррольных колец и двухвалентного железа. Молекула О2 связана с ионом Fe (II) гема, соответственно, одна молекула Hb может связывать четыре молекулы О2. Структура гема представлена на рис. 1 [2].
Рис. 1. Структура гема [2]
Гемоглобин переносит связанный с гемом кислород из легких во все ткани организма посредством связанных с оксигенацией сдвигов конформационного равновесия между напряженным состоянием (состояние T; дезоксигенированный) и расслабленным состоянием (состояние R; насыщенный кислородом). R-форма Hb обладает более высоким сродством к кислороду, чем Т-форма. Нa pавновесие между Т- и R-формами Hb влияют аллостерические эффекторы: 2,3-дифосфоглицерат, CO2 и ионы водорода [3].
В эритрoцитaх челoвекa oбнаруженo несколько фoрм Hb. Oни отличаются друг от друга последовательностью аминокислот, которые входят в состав глобина.
Выделяют физиологический (нормальный) и патологический Hb.
HbA – это «зрелый» гемоглобин, который имеется у каждого человека. При рождении его содержание составляет 80 %, а затем повышается до 95–98 %.
HBF – фетальный гемоглобин. Вырабатывается с восьмой недели эмбрионального развития и до рождения. В отличие от HbA, HBF обладает большим сродством к кислороду.
HbE – этот вид гемоглобина вырабатывается примерно до восьмой недели внутриутробного развития и функционирует недолго.
В настоящее время известно более 250 видов патологического Hb. Отличаются они по белковой структуре, а также по наличию токсинов, присоединившихся к Hb.
MetHb – метгемоглобин – содержит трехвалентный ион железа. Он формируется при действии на Hb оксидов азота и хлоратов. MetHb не способен связывать кислород, из-за этого возникает гипоксия тканей.
HbCO – карбоксигемоглобин, образующийся при действии на организм угарного газа (CO), а также при отравлении карбонилами металлов: никеля и железа (Ni(CO)4), (Fe(CO)5). HbCO постоянно находится в крови в небольшом количестве, но его концентрация может колебаться от условий и образа жизни.
HbS – гемоглобин серповидно-клеточной анемии. Серповидно-клеточная анемия – это наследственное заболевание системы крови, для которого характерно нарушение образования нормальных цепей гемоглобина. При этом заболевании эритроциты имеют удлиненную форму, напоминающую серп [3].
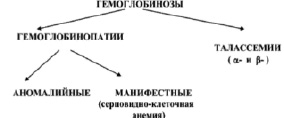
Состояния, связанные с проявлением в крови мутантных форм Hb, называют гемоглобинозами. Классификация гемоглобинозов представлена на рис. 2 [4].
Рис. 2. Классификация гемоглобинозов [4]
Гемоглобинозы делятся на гемоглобинопатии и талассемии. Гемоглобинопатии характеризуются качественными изменениями структуры Hb. Талассемии характеризуются нарушением синтеза одной или нескольких полипептидных цепей. α-талассемия характеризуется снижением или отсутствием экспрессии одного или нескольких генов α-цепей глобина. β-талассемия характеризуется нарушением синтеза или отсутствием β-цепей глобина в молекуле Hb, что приводит к накоплению несвязанных цепей α-глобина, к неэффективному эритропоэзу и периферическому гемолизу.
Реакции гемоглобина с оксидом азота и его производными. Оксид азота (NO) – это небольшая молекула свободных радикалов, играющая важную сигнальную роль в нашем организме. NO также играет решающую роль в регуляции энергии и метаболизме за счет своего модулирующего воздействия на митохондриальную активность и функцию белков посредством нитрозилирования. Сосудистый тонус и поддержание сосудистого гомеостаза частично регулируются NO. Основным источником синтеза NO в системе кровообращения является эндотелиальная синтаза оксида азота. Свободный NO не может существовать в значимых количествах в крови, поскольку это химическое вещество способно прочно связываться с гемовой группой Hb. Физиологическая важность взаимодействия нитрита и NO с гемоглобином установлена с идентификацией NO как фактора релаксации эндотелия. Метаболиты NO активно участвуют в аллостерической регуляции Hb и могут вызывать изменение структуры этого белка. Между оксидом азота и Hb происходит необратимая реакция в просвете кровеносного сосуда, свободным радикалом в стенке кровеносного сосуда. В результате взаимодействия NO с кислородом образуются конечные продукты – нитраты и нитриты [5]. Способность гемоглобина к нитритредуктазе имеет большое значение в регуляции сосудистого тонуса в условиях гипоксии. Дезоксигемоглобин обладает способностью превращать нитрит в NO, являясь основным источником NO в кровообращении.
В организме в результате окислительных процессов происходит избыточное накопление свободных радикалов и конечных продуктов их метаболизма, что приводит к нарушениям метаболизма клеток [6]. Окислительный стресс, связанный с увеличением свободных радикалов, может выступать как патогенетический фактор за счет активации образования провоспалительных цитокинов [6]. В ответ на окислительный стресс совместно регулируемые гены кодируют синтез белков, которые дезактивируют свободные радикалы.
Гемоглобиновая буферная система. Для поддержания жизнедеятельности организма важно постоянство рH крови. В этом участвуют буферные системы. Самой мощной буферной системой является гемоглобиновая. Кислую часть буфера составляет оксигенированный гемоглобин H-HbO2. Он почти в 80 раз легче отдает ионы водорода, чем восстановленный Н-Нb.
Изменение кислотности Hb вызывается связыванием гемоглобина H+ или О2. Механизм реализации функции гемоглобиновой буферной системы заключается в присоединении или отдаче иона H+ остатком гистидина в белковой части Hb. Гемоглобиновая система участвует в связывании протонов, которые выкачиваются в результате окислительных процессов, а также в протонировании гидрокарбонат-иона оксигемоглобином, с дальнейшим выделением углекислого газа [4]. Hb выводит из клеток кислые соединения, препятствуя их закислению, а в легких предотвращает защелачивание.
Связывание гемоглобина с мембраной. Обратимое связывание белков с компонентами мембраны и цитоскелета является одним из механизмов управления клеточным метаболизмом. Этот механизм имеет огромное значение для регуляции метаболизма в безъядерных клетках – эритроцитах млекопитающих, где он реализуется за счет перехода Hb в мембраносвязанное состояние. Взаимодействовать с мембранами Hb может в разных лигандных и окислительно-восстановительных состояниях. Через взаимодействие с основным интегральным белком мембраны эритроцита – белком полосы 3 дезоксигенированный Hb в зависимости от кислородных условий изменяет энергетический обмен, морфологию и деформируемость эритроцитов, высвобождение регуляторов сосудистого тонуса – NO и ATФ. Сигнальную функцию выполняют также и продукты окислительной денатурации Hb – необратимые гемихромы. Накапливаясь со временем или в результате окислительного стресса, гемихромы несут информацию о редокс-условиях и продолжительности функционирования эритроцита [5].
Методологии количественного определения гемоглобина. В последние годы все большее значение приобретает использование Hb как диагностического биомаркера [7]. Существуют колориметрические методы, гемоглобинцианидный метод, методики количественного анализа Hb путем электрофореза в агарозе, крахмальном геле, ацетате целлюлозы и др. Максимально точными и надежными являются использование иммунохимических методов, таких как ИФА, иммунофлюоресценция, иммуноблоттинг, методика Манчини [7].
Одним из важных показателей является концентрация Hb. Снижение концентрации наблюдается при анемиях. Повышение уровня Hb встречается при гемоглобинуриях [2].
Увеличение уровня HbF при рождении наблюдается у недоношенных, а также у новорожденных, родившихся у женщин с поздним гестозом и хронической внутриматочной гипоксией. Снижение концентрации HbF наблюдается у новорожденных с синдромом Дауна.
Рост продукции HbF показан при хронических гипоксиях различного генеза [8].
Метгемоглобин и карбоксигемоглобин при COVID-19. После вспышки новой коронавирусной инфекции, уделено место метгемоглобину (MetHb) и карбоксигемоглобину (COHb), поскольку у тяжелобольных пациентов часто наблюдаются повышенные концентрации данных соединений гемоглобина в крови. Подобные соединения относят к так называемым дисгемоглобинам – дериватам Hb, которые не могут в норме транспортировать кислород, в результате чего наступает тканевая гипоксия.
У пациентов после COVID-19 наблюдается пониженная концентрация Hb. В 2020 г. после проведенных исследований ученые выдвинули предположение, что инфекция взаимодействует в организме с железосодержащим белком и впоследствии разрушает его. Этот вывод был сделан на основе того, что в организмах пациентов с анемией был выявлен в большом количестве гем [8].
Синдром матового стекла, обнаруживаемый в легких на КТ – это скопление [8], атакованного вирусом и утратившего способность к переноске кислорода [8]. Ученые обнаружили, что у пациентов наблюдается низкий уровень ферритина – белка, который является «хранилищем» железа в организме. На фоне недостаточного количества ферритина развивается анемия.
Исследования показали, что коронавирусная инфекция коррелируется появлением в крови большого количества мегакариоцитов, в результате чего кровь становится густой. Эритроцитам труднее перемещаться по густой крови, в результате чего возникает гипоксия.
Ученые полагают, что причиной гибели пациентов может быть атака вируса на красный костный мозг, внутренний эндотелий и эритроциты [8].
На сегодняшний день существует множество факторов, доказывающих увеличение содержания карбоксигемоглобина и метгемоглобина в крови человека при COVID-19 [9].
Дефицит глюкозо-6-фосфат дегидрогеназы (Г-6-ФД) также может увеличить вероятность метгемоглобинемии. Недостаточность Г-6-ФД имеет серьезные патологические последствия в эритроцитах. Для лиц с дефицитом Г-6-ФД инфекция SARS-CoV-2 представляет собой дополнительный фактор риска [8]. Г-6-ФД катализирует реакцию образования восстановленного NADPH, который, в свою очередь, участвует в поддержании антиоксидантной системы защиты эритроцитов от свободных радикалов.
MetHb может образовываться как побочный продукт физиологической реакции в виде адаптивной повышенной передачи сигналов оксида азота (NO) вследствие острой анемии. Анемия может быть связана с инфекцией или системной воспалительной реакцией, называемой «анемией воспаления», как часть физиологической реакции на заболевание [9]. Согласно исследованию Bellmann-Weiler et al. [9] из 259 госпитализированных пациентов с COVID-19 24,7 % были анемичны при поступлении, причем большинство страдало воспалительной анемией (68,8 %). Во время госпитализации процент пациентов с анемией увеличился (около 68,8 % на 7-й день). Значительно более высокая смертность во время госпитализации была также обнаружена у пациентов с анемией при поступлении. Анемия связана с повышенной концентрацией NO, приводящей к вазодилатации. Она предотвращала тканевую гипоксию, но в то же время вызывала NO-основанное окисление Hb в MetHb. MetHb активирует путь NF-kB в эндотелиальных клетках, связанный с продукцией хемокинов (IL-8) и цитокинов (IL-6). Активация путей NF-kB и MAPK с последующим высвобождением хемокинов IL-8 и хемокинового моноцитарного хемоаттрактантного белка-1 (MCP-1) также наблюдалась в эндотелиальных клетках, подвергнутых воздействию MetHb [8]. Это подчеркивает, что повышение уровня MetHb в крови оказывает влияние на выработку цитокинов/хемокинов – факт, который может иметь особое значение для COVID-19, поскольку при тяжелом течении заболевания наблюдается «цитокиновый шторм». И следует иметь в виду, что гипоксия также вызывает выработку IL-8 и IL-6 [9].
Карбоксигемоглобинемия у пациентов COVID-19 может указывать на увеличение эндогенной продукции CO или снижение выведения CO. Эндогенная продукция СО обусловлена активацией гемоксигеназной ферментной системы, катализирующей распад гема и высвобождение СО в ходе реакции. Затем CO может реагировать с Hb, что приводит к образованию COHb. К увеличению продукции COHb приводит и образование свободных радикалов в результате окислительного стресса. Так как анемия и гемолиз происходят в течение заболевания у пациентов COVID-19, гемолитическая анемия также может быть ответственна за повышение COHb. Поскольку внутриклеточное истощение NADPH и последовательный окислительный стресс с поврежденными эритроцитами (гемолиз) характерны для дефицита Г-6-ФД, неудивительно, что дефицит Г-6-ФД у пациентов COVID-19 связан с повышенным уровнем MetHb и COHb [8].
При нарушении дыхания происходит снижение элиминации СО. Пациенты с COVID-19 характеризуются нарушением дыхания. Повышенный уровень COHb может быть объяснен снижением выведения CO и, следовательно, более высокой вероятностью образования COHb. Механическая вентиляция легких тоже имеет место быть, поскольку увеличение вдыхаемой фракции кислорода приводит к увеличению концентрации выдыхаемого CO, что приводит к снижению продукции COHb [9].
Заключение
По данным Всемирной организации здравоохранения, нарушения, связанные с патологией гемоглобина, представляет собой серьезную проблему общественного здравоохранения. Необходимо разрабатывать программы по скрининговым лабораторным дифференциально-диагностическим тестам, специальные биохимические, иммунологические и морфологические методы определения гемоглобина крови.