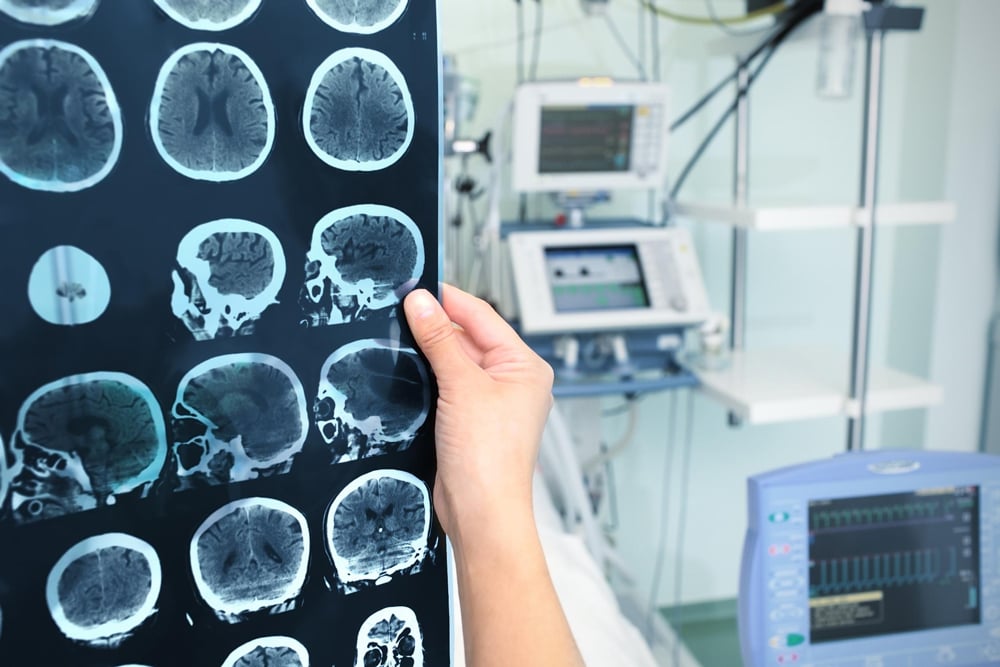
Что такое дегенерация мозга
Атрофия головного мозга, сенильная дегенерация
Церебральная атрофия (атрофия головного мозга) — это симптом, который является общим признаком многих заболеваний, повреждающих мозг или нарушающих его функцию.
Атрофия любого типа ткани в организме человека означает прогрессирующую потерю цитоплазматических белков. По отношению к мозговой ткани атрофия означает гибель (отмирание) нейронов и потерю связей между ними.
Мозговая атрофия может быть общей — то есть, размер мозга сокращается равномерно. Также атрофия может быть очаговой, в этом случае она относится лишь к одной области мозга, приводя к угнетению определенных участков, следовательно, вызывая симптомы, связанные с деградацией этой области мозга. Если поражаются оба полушария мозга, нарушается привычное течение процесса мышления и множества привычных физиологических процессов.
Что такое атрофия головного мозга и сенильная дегенерация, диагностика
С возрастом мозг людей теряет определенное количество клеток, однако такая потеря физиологична и допустима. Однако когда количество потерянных нейронов превышает определенный предел, и мозг уменьшается в размерах, возникает состояние, которое можно называть церебральной атрофией.
Мозг постепенно уменьшается в размерах с каждым десятилетием жизни, однако до 60-летнего возраста скорость такой потери очень медленная и практически незаметна. В год от первоначального объема теряется от 0,5 до 1% мозговой ткани.
В возрасте 75 лет мозг в среднем на 15% меньше, чем в 25-летнем возрасте.
Области мозга, отвечающие за кратковременную память, обычно более подвержены дегенеративным процессам, к тому же у мужчин потеря нейронов происходит активнее, чем у женщин, а значит, и дегенеративные процессы протекают более интенсивно.
Для выявления аномалий используют такие диагностические манипуляции:
Церебральная атрофия может быть только одним из множества признаков, свидетельствующих о серьезном заболевании: раковой опухоли мозга, нейродегенеративных процессах, ранней болезни Паркинсона или других расстройствах.
Потеря нейронов головного мозга — процесс крайне нежелательный, поскольку это неминуемо влечет за собой поведенческие и когнитивные нарушения. При тенденции мозга к потере нейронов пациенты обязаны проходить диагностику раз в полгода — для отслеживания процессов и контроля или предупреждения симптомов, вызванных этим состоянием.
Сенильная дегенерация мозга — это состояние, являющееся синонимом старческого слабоумия. Старческое слабоумие — это заболевание, вызываемое дегенерацией клеток головного мозга. Данное заболевание отличается от обычного маразма, развивающегося у пожилых людей. В случае сенильной дегенерации активность функции мозга пациента постепенно снижается, что приводит к прогрессирующей потере памяти и торможению умственных способностей, а также заметным изменениям личности.
Причины мозговой атрофии и сенильной дегенерации головного мозга
Причины мозговой атрофии
Причины сенильной дегенерации
Сенильная деменция всегда вызвана основным заболеванием. Мозговая ткань повреждается, значит, уменьшается функциональная мощность организма. Наиболее частой причиной деменции является болезнь Альцгеймера — нейродегенеративное расстройство, вызывающее ухудшение когнитивных функций, в частности, памяти и мышления.
Основные причины сенильной дегенерации следующие:
Вызывать сенильную деменцию могут такие нарушения обмена веществ или состояния:
В некоторых из этих случаев деменция может быть предупреждена путем удаления токсичного агента. В результате таких манипуляций состояние мозга возвращается к норме.
Симптомы атрофии головного мозга и сенильной дегенерации
Симптомы мозговой атрофии
Многие заболевания, которые вызывают церебральную атрофию, сопровождаются прежде всего развитием слабоумия.
Основные симптомы это:
Симптомы сенильной дегенерации
Симптомы ранней стадии:
Симптомы серединной стадии:
Симптомы поздней стадии:
Лечение мозговой атрофии и сенильной дегенерации мозга
Лечение мозговой атрофии
Церебральная атрофия неизлечима, однако существуют способы замедления данного процесса.
Рекомендуется:
Существуют случаи спонтанного восстановления после диагностики мозговой атрофии, однако происходят подобные процессы крайне редко и представляют собой случаи спонтанной ремиссии.
Лечение сенильной дегенерации
Старческое слабоумие, вызванное депрессией, плохим питанием, нарушением функции щитовидной железы, отравлением наркотическими веществами и алкоголизмом, может быть остановлено одним лишь устранением основной проблемы.
Развитие сенильной дегенерации можно замедлить следующим образом:
5 неожиданных способов увеличить продолжительность жизни
Ученые обнаружили заболевание, которое способно манипулировать клетками мозга
В Великобритании родился ребенок, у которого некоторые органы были наружу
Признаки, которые укажут на наличие камней в почках
Ученые доказали пользу прерывистого голодания для здоровья сердца
Паспорт вакцинации могут «выдавать» в виде чипа, вводимого под кожу
Дегенеративные заболевания ЦНС
Дегенерация центральной нервной системы представляет собой необратимые органические и функциональные изменения в спинном и головном мозге, которые приводят к психической дегенерации. Выделяют множество видов заболеваний, последствием которых являются нарушения работы нервной системы. Соответственно, лечение будет зависеть от вида заболевания и причин, его вызывающих. К сожалению, далеко не все болезни ЦНС поддаются лечению. Успешную терапию дегенеративных заболеваний ЦНС выполняют в Юсуповской больнице.
Дегенеративные заболевания ЦНС: общие понятия
Основными характеристиками группы дегенеративных заболеваний ЦНС являются следующие критерии:
Различные заболевания ЦНС, список которых достаточно длинный, остаются на стадии изучения. Достоверно неизвестны причины возникновения атрофических процессов при нормальном функционировании нервной системы большую часть жизни человека. Тем не менее, существует ряд факторов, которые могут провоцировать дегенерацию головного мозга:
Органические заболевания ЦНС
Наличие органического заболевания центральной нервной системы означает, что головной мозг неполноценен. Патология может быть врожденной или приобретенной. Неврологи утверждают, что органические нарушения ЦНС первой стадии можно найти у 98% населения, однако они не требуют лечения. Вторая и третья стадии характеризуется более серьезными поражениями и сопровождаются значительными отклонениями.
Врожденные органические поражения головного мозга происходят в период эмбрионального развития или во время родов в результате родовой травмы. Причинами их появления могут быть неблагоприятные факторы, которые влияли на беременную женщину:
Приобретенные органические поражения могут возникнуть после инсульта, черепно-мозговой травмы, злоупотребления алкоголем и наркотиками, инфекционных заболеваний с поражением головного мозга.
Среди болезней, которые вызваны органическими поражениями ЦНС, выделяют олигофрению и деменцию. При олигофрении происходит задержка умственного развития. Заболевание возникает в период внутриутробного развития или на первом году жизни. У детей снижен интеллект, плохо развивается речь и моторика. При деменции происходит утрата уже приобретенных навыков и знаний. Постепенно деменция приводит к полной деградации человека. Рассматривая данное заболевание ЦНС, симптомы выделяют следующие: нарушение памяти, речи, ориентации в пространстве, человек не может учиться новому и теряет старые навыки и знания.
Инфекционные заболевания ЦНС
Инфекционные заболевания ЦНС являются одними из наиболее распространенных неврологических патологий. Заболевания ЦНС, вызванные инфекцией, очень опасны. Они имеют тяжелое течение, оставляют серьезные последствия и значительный неврологический дефицит. Инфекционные заболевания ЦНС могут вызывать бактерии, вирусы, грибковые заболевания. Чаще всего заболевания развиваются при проникновении в организм менингококка, стафилококка, пневмококка, энтеровирусов ECHO и Коксаки, эпидемического паротита, кандиды. Входными воротами для инфекции являются ЛОР-органы, также она передаётся контактным, гематогенным, лимфогенным, периневральным путем.
Инфекция может поражать нервную систему как первичное заболевание или возникнуть вторично, в результате развития инфекционного процесса вне ЦНС. К инфекционным заболеваниям ЦНС относят:
Сосудистые заболевания ЦНС
Нарушение кровообращения в головном мозге провоцирует развитие сосудистых заболеваний ЦНС. Эти патологии чрезвычайно опасны, поскольку приводят в большинстве случаев к инвалидизации человека. Также сосудистые заболевания ЦНС имеют большой процент смертности. Поражение головного мозга происходит в результате ишемических и геморрагических инсультов, транзиторных ишемических атак, спонтанных субарахноидальных кровоизлияний. Причинами подобных патологий являются:
Пусковым механизмом развития инсультов могут быть сильные стрессы, судорожные припадки, алкогольная интоксикация, резкие перепады температуры тела. Сосудистое заболевание ЦНС чаще всего возникает спонтанно и требует незамедлительного обращения за медицинской помощью.
Лечение и диагностика дегенеративных заболеваний ЦНС
Опасность дегенеративных заболеваний ЦНС состоит в том, что их сложно предвидеть. При наличии провоцирующих факторов в жизни человека рекомендуется вести здоровый образ жизни и регулярно посещать невролога для профилактических осмотров. Заподозрив признаки заболевания ЦНС, следует немедленно обратиться к врачу. Чем раньше будет выявлено заболевание, тем больше шансов замедлить прогрессирование дегенеративных процессов в головном мозге.
Диагностика и лечение дегенеративных заболеваний будет зависеть от вида патологии. Определив клиническую картину болезни, врач назначит исследования для уточнения состояния пациента. Они могут включать лабораторные анализы, УЗИ, МРТ, КТ, и психологические тесты для определения состояния когнитивных навыков.
В Юсуповской больнице города Москвы работает клиника неврологии, в которой оказывают помощь высококвалифицированные неврологи, доктора наук. Врачи Юсуповской больницы имеют большой опыт лечения дегенеративных заболеваний ЦНС и используют в своей работе новейшие методики терапии и реабилитации, что позволяет браться за самые сложные случаи.
Обратиться за помощью, записаться на прием и получить консультацию специалистов можно по телефону.
Нейродегенеративные заболевания
Лептин и инсулин являются ключевыми анорексигенными гормонами, продуцируемыми адипоцитами при накоплении жировых запасов и эндокринной поджелудочной железы соответственно. Грелин вырабатывается желудочно-кишечным трактом и стимулирует процесс потребления пищи. Множество и других периферических гормонов участвует в регуляции метаболизма, и большинство из них сигнализирует о своей активности гипоталамусу. Более того, гипоталамические нейроны также фиксируют изменения в питательных веществах, таких как глюкоза или жирные кислоты, и способны модифицировать метаболический гомеостаз.
Причины потери веса и аномального питания в течение клинической фазы AD остаются неизвестными ( метаболические изменения могут быть связаны с вышеупомянутыми поражениями гипоталамуса). Некоторые исследования подтверждают участие передачи сигналов лептина в изменениях энергетического гомеостаза при AD. Было обнаружено, что пептиды Aβ способны изменять реакцию нейронов NPU дугообразного ядра на лептин. В нескольких исследованиях также показано, что пациенты с болезнью Альцгеймера могут иметь резистентность к инсулину, и, следовательно, маловероятно, что изменения массы тела у пациентов с АD обусловлены увеличением анорексигенного действия инсулина. Кроме того, поражения дугообразного ядра благоприятствуют развитию AD-подобных поражений в экспериментальных моделях.
Помимо потери веса тела, убедительные доказательства на протяжении многих лет поддерживают взаимосвязи между изменениями гомеостаза глюкозы и патогенезом AD. Как указывалось выше, ожирение, резистентность к инсулину и диабет являются значимыми факторами риска развития болезни Альцгеймера. Экспериментальные исследования подтверждают связь между такими метаболическими нарушениями и AD с нарушенной амилоидной или тау-патологией, усиливающейся после развития ожирения и резистентности к инсулину в трансгенных моделях AD амилоидогенеза или тау-патологии. В некоторых исследованиях утверждается, что периферические нарушения склонны поддерживать устойчивость мозга к инсулину и сами по себе достаточны для развития развития тау-патологии и амилоидогенеза. Патологические изменения также могут быть связаны с гипотермией. Интересно отметить, что риск развития диабета был увеличен у пациентов с AD. Было показано, что мозг пациентов с болезнью Альцгеймера проявляет резистентность к инсулину, примером чего является увеличение кортикального фосфорилирования сайтов ингибирования серина IRS-1, которое коррелирует с когнитивными нарушениями. Это наблюдение согласуется с известной способностью передачи сигналов инсулина для содействия процессов пластичности и памяти, которые могут иметь отношение к изменениям в коре головного мозга или улучшение памяти, наблюдаемое у людей после введения интраназального инсулина. Потенциальное появление устойчивости к инсулину мозга при развитии нарушений гомеостаза глюкозы у пациентов с болезнью Альцгйемера также подтверждается известной ролью передачи сигналов инсулина в процессах регуляции энергетического метаболизма. Происхождение резистентности к инсулину мозга у пациентов с АD, по-видимому, связано с патологией Aβ и tau. С одной стороны, интра церебровентрикулярная инфузия олигомеров Aβ у мышей является достаточной для того, чтобы вызвать непереносимость периферической глюкозы с помощью механизма, функционирующего на основе гипоталамуса. С другой стороны, потеря функции tau, которая, как ожидается, будет сопровождаться последующим гиперфосфорилированием и агрегацией тау, снижает чувствительность к инсулину и связана с измененным гомеостазом глюкозы. Это соответствует увеличению ингибирования IRS-1 в мозге пациентов с чистыми тауопатиями. Было показано, что олигомеры Aβ способствуют интернализации инсулиновых рецепторов, а также активации путей JNK, PKR и TNFα, которые в свою очередь ингибируя функцию IRS-1. Кроме того, было предложено стимулировать функцию IRS-1, а также продукцию PIP3, способствуя передаче сигналов инсулина. Примечательно, что недавние данные показали, что ApoE4 способствует нейронной резистентности к инсулину и может синергически действовать вместе с поражениями.
Метаболические изменения, такие как потеря веса или резистентность к инсулину, были зафиксированы в большинстве случаев нейродегенеративных заболеваний. Во многих случаях эти изменения были причинно связаны с по крайней мере частью неврологического фенотипа и показали, что они способствуют прогрессированию болезни.
Дегенеративные заболевания нервной системы: болезнь Паркинсона, болезнь Альцгеймера, эссенциальный тремор. Правила профилактики болезни Альцгеймера.
Дегенеративные состояния возникают по неустановленным причинам и характеризуются поражением определенных нейрональных систем из-за прогрессирующей гибели нейронов.
Характерные черты дегенеративных заболеваний
Дегенеративно-дистрофические заболевания имеют схожие черты. Начало у заболеваний практически незаметно, но все они неуклонно прогрессируют, что может длиться десятилетиями. Начало сложно отследить, причину невозможно выявить. Пораженные ткани и органы постепенно отказывают в выполнении своих функций, дегенерация движется по настающей. Болезни этой группы имеют устойчивость к терапии, лечение всегда комплексное, сложное и редко эффективное. Чаще всего оно не дает желаемых результатов. Можно замедлить дегенеративный рост, но остановить его практически невозможно. Заболевания чаще встречаются среди людей старшего, пожилого возраста, среди молодежи они распространены реже.
Виды дегенеративных болезней
К дегенеративным заболеваниям относится: болезнь Альцгеймера, хорея Гентингтона, болезнь Паркинсона, боковой амиотрофический склероз, болезни мотонейрона. Дегенеративные заболевания нервной системы относятся к широко распространенным – болезнь Паркинсона или Альцгеймера диагностируется у 1 человека из 1000. Причем нейродегенеративные заболевания не являются характерными только для старшей возрастной группы, например дистонические синдромы чаще всего отмечаются в продуктивном возрасте.
Многие дегенеративные заболевания проявляются ограниченной или диффузной атрофией мозга, в определенных структурах происходит микроскопическое снижение нейронов. В некоторых случаях происходит только нарушение в функциях клеток, гибель их не происходит, атрофия мозга не развивается (эссенциальный тремор, идиопатическая дистония). В подавляющем большинстве дегенеративные заболевания имеют длительные сроки скрытого развития, но неуклонно прогрессирующую форму.
Дегенеративные заболевания ЦНС классифицируются по клиническим проявлениям и отображают вовлечение определенных структур нервной системы. Выделяются:
Болезнь Альцгеймера
За последние 30-40 лет одновременно с повышением продолжительности жизни во всем мире, в обществе возрастает бремя нейродегенеративных заболеваний мозга, затрагивающих прежде всего пожилых людей. Среди этих болезней наиболее распространена и наиболее широко известна болезнь Альцгеймера, поскольку она поражает как интеллект, так и эмоциональное благополучие своих жертв, и имеет потенциально разрушительное воздействие на их жизнь и жизни их семей.
Нервно-дегенеративные заболевания с проявлениями деменции чаще возникают в пожилом возрасте. Самой распространенной является болезнь Альцгеймера. Прогрессирует у лиц старше 80 лет. В 15% случаев заболевание носит семейный характер. Развивается на протяжении 10-15 лет. Начинаются поражения нейронов в ассоциативных областях теменной коры, височной и лобной, при этом слуховые, зрительные и соматосенсорные участки остаются непораженными.
Это заболевание является наиболее распространенной формой потери памяти, или деменции. Обычно болезнь Альцгеймера диагностируют у людей старше 65-ти лет, однако она может появиться и в более раннем возрасте. К сожалению, в последнее время наблюдается все более широкое распространение и «помолодение» болезни Альцгеймера, которую диагностируют у лиц в возрасте 45–65 лет. Помимо тех, чьи родственники страдают этой болезнью, в группу риска попадают люди, жизнь которых не была связана с интеллектуальным трудом и интеллектуальной активностью, лица, страдающие сахарным диабетом и избыточной массой тела, имеющие хроническую гипоксию, атеросклероз магистральных артерий головы и некоторые другие заболевания. Наиболее часто заболевание начинается с расстройства кратковременной памяти, то есть человек легко забывает полученную недавно информацию, и в то же время легко воспроизводит факты и данные, относящиеся к далекому прошлому. Затем и долговременная память тоже расстраивается, появляется ряд других симптомов. Болезнь развивается постепенно.
Как начинается болезнь Альцгеймера?
Как протекает болезнь Альцгеймера: симптоматика заболевания на разных стадиях?
При первых признаках болезни Альцгеймера следует немедленно обратиться к врачу и кардинально пересмотреть свой образ жизни!
Отсутствие двигательной активности, интеллектуальной деятельности, общения, недостаток витаминов, пагубные привычки (алкоголь, курение) могут усугубить болезнь и дать толчок к ее стремительному развитию.
В начале заболевания человек часто сам замечает свои проблемы. В течение этого периода человек может понять свое состояние, он может самостоятельно искать помощь и справляться с большей частью своей повседневной деятельности. Этот период должен быть лучшим временем для диагностики болезни.
Может случиться так, что человек изначально будет пытаться скрыть свои проблемы от других!
По мере прогрессирования болезни способность к критической оценке и внимание еще более снижаются, а ухудшение памяти начинает выражаться все более сильнее. Люди с болезнью Альцгеймера забывает дату, день недели и года, забывает свой адрес и место, где они находятся в настоящее время. В большинстве случаев пациенты не замечают изменения вокруг и в себе, хотя иногда могут быть моменты прояснения, когда понимание более ясное.
На поздних стадиях болезни способность людей говорить и понимать речь настолько нарушена, что они не могут выразить себя или понять смысл других. Тем важнее становится невербальное общение с близкими — тон голоса, выражение лица, жесты. Все прежние навыки человека исчезают, и он больше не может встать с постели, одеваться, ходить, посещать туалет или принимать пищу
Существует ряд способов облегчить болезнь Альцгеймера, приостановить ее развитие, смягчить симптомы. Эффективность лечения зависит от своевременной диагностики — чем раньше будет обнаружена болезнь, тем результативнее действуют все принимаемые меры.
Кортикобазальная дегенерация
Кортикобазальная дегенерация — это отдельная клиническая форма избирательного дегенеративного процесса с преимущественным поражением лобно-теменной коры и подкорковых ганглиев. Клинические проявления патологии полиморфны, включают паркинсонизм, расстройство праксиса, тремор, миоклонии, фокальные дистонии, речевые нарушения. Диагностируется кортикобазальная дегенерация по результатам неврологического осмотра, нейропсихологического тестирования, ПЭТ и МРТ головного мозга. Этиопатогенетическая терапия заболевания не разработана, лечение симптоматическое.
МКБ-10
Общие сведения
Кортикобазальная дегенерация (КБД) впервые описана в 1968 году. Заболевание получило название в связи с сочетанием дегенеративных изменений в церебральной коре и базальных (подкорковых) структурах. Наряду с болезнью Альцгеймера, прогрессирующим надъядерным параличом (ПНП), болезнью Пика, мультисистемной атрофией КБД относится к таупатиям, сопровождающимся накоплением тау-протеина в церебральных клетках. Поскольку одним из ведущих клинических симптомокомплексов выступает олигобрадикинезия, в клинической неврологии кортикобазальная дегенерация считается вариантом паркинсонизма-плюс. Точная распространённость КБД неизвестна, отдельные исследования указывают, что патология составляет 0,9% всех случаев паркинсонизма. Пик заболеваемости приходится на возраст 50-60 лет.
Причины
Этиологические факторы возникновения КБД, причины избирательного поражения корково-подкорковых структур не определены. Заболевание имеет спорадический характер, по неподтверждённым данным встречаются единичные семейные случаи. Отдельные исследователи предполагают связь патологического метаболизма отдельных внутриклеточных белков с изменениями в генетическом аппарате нервных клеток. Вероятен полиэтиологический характер развития болезни, при котором совокупное воздействие нескольких этиофакторов приводит к реализации генетически детерминированного нарушения.
Патогенез
Основным патогенетическим механизмом признано нарушение белкового обмена в мозговых тканях. Результатом дисметаболизма является агрегация ряда протеинов внутри нейронов, глиальных клеток. Белковые включения изменяют нормальную жизнедеятельность клеток, возможно, запускают механизм их самоуничтожения (апоптоз). Патологический процесс имеет избирательную локализацию, поражаются преимущественно фронто-париетальные области коры, субстанция нигра, стриатум, вентролатеральное таламическое ядро, зубчатые ядра мозжечка. Макроскопическая картина представлена асимметричными атрофическими процессами указанной локализации. Микроскопически определяется уменьшение числа нервных клеток, демиелинизация волокон, внутринейрональные включения тау-белка. Патогномоничным признаком КБД является наличие в зонах поражения неокрашиваемых баллонообразных нейронов.
Симптомы кортикобазальной дегенерации
Клиническая картина отражает прогрессирующее поражение коры и базальных ганглиев. Последовательность развития и сочетание синдромов могут быть различными, что формирует полиморфизм и значительную вариабельность проявлений. Зачастую первым симптомом становится чувство онемения, неловкости в конечности (чаще в верхней), расстройство в ней сложных типов чувствительности: способности узнавать предметы на ощупь (стереогнозис), различать несколько одновременно воздействующих раздражителей (дискриминационное чувство). Указанные изменения распространяются на ипсилатеральную конечность, затем на противоположную сторону. В половине случаев возникает синдром «чужой» конечности (чаще руки) в сочетании с её непроизвольными движениями.
Симптоматика паркинсонизма присутствует у 100% больных, носит асимметричный характер с преобладанием акинетико-ригидных проявлений. Отмечаются иные экстрапирамидные расстройства: различные формы мышечной дистонии, миоклонии, постуральный тремор, реже — хорея, атетоз. У многих пациентов кортикобазальная дегенерация протекает с типичным тоническим состоянием верхней конечности со сгибанием и приведением плеча, предплечья, кисти и пальцев. В ряде случаев больные вынуждены носить мячик в руке, чтобы предупредить повреждение кисти ногтями резко согнутых пальцев. Глазодвигательные нарушения представлены некоторым ограничением амплитуды движений, явный парез взора наблюдается в 20% случаев. Возможны мозжечковая атаксия, лобные симптомы: паратония, сосательный, хватательный рефлексы.
При дебюте симптоматики в нижней конечности нарушения походки появляются на первом году заболевания, при локализации первых проявлений в руке — спустя 3 года. Определяется лобная дисбазия с частыми падениями. Пирамидная недостаточность ограничивается появлением стопных симптомов, гиперрефлексией. В большинстве случаев возникает дизартрия, имеющая смешанный корково-подкорковый характер, в 20-30% случаев — динамическая афазия. У 85% пациентов отмечается апраксия — нарушение программы последовательного выполнения действий. Интеллектуальное снижение обычно развивается после формирования выраженных двигательных нарушений. При этом известны случаи, когда кортикобазальная дегенерация манифестировала когнитивными расстройствами, и деменция являлась ведущим симптомом болезни.
Осложнения
Обусловленные дисбазией падения больного опасны серьёзным травмированием с ушибами и переломами. В последующем прогрессирующий паркинсонизм и апраксия лишают пациента возможности самообслуживания, являются причиной глубокой инвалидности. Локальные мышечно-тонические нарушения осложняются развитием контрактур. Постепенно утрачивается способность самостоятельно передвигаться. Постоянный постельный режим способствует развитию пролежней и целого ряда инфекционных осложнений: цистита, восходящего пиелонефрита, застойной пневмонии, сепсиса.
Диагностика
Кортикобазальная дегенерация диагностируется на основании следующих клинических критериев: L-ДОФА-резистентный паркинсонизм, апраксия, феномен «чужой» конечности, мышечные дистонии, миоклонии, грубый тремор. Постановка диагноза возможна при наличии трёх признаков из шести. Диагноз достоверно верифицируется по данным патоморфологического исследования церебральных тканей. В ходе диагностического поиска осуществляются следующие исследования:
В дебюте симптоматики кортикобазальная дегенерация требует дифференциации с болезнью Паркинсона, в дальнейшем – с клинически сходными опухолями головного мозга, дегенеративными заболеваниями: болезнью Галлервордена–Шпатца, Пика, Альцгеймера, ПНП, деменцией с тельцами Леви. От болезни Паркинсона КБД отличается наличием корковой симптоматики, нарушений речи, резистентностью к ДОФА-терапии. При ПНП выражена офтальмоплегия, отсутствуют миоклонии и очаговая корковая дисфункция. Болезнь Альцгеймера характеризуется преобладанием атрофических и гипометаболических изменений лобно-височной коры.
Лечение кортикобазальной дегенерации
Возможности лечения КБД ограничены, поскольку этиология заболевания остаётся неясной. Применяется преимущественно симптоматическая терапия. Терапевтическая схема, способная остановить прогрессирование дегенерации, пока отсутствует. Лечение направлено на облегчение состояния пациента, уменьшение выраженности симптоматики. Общепринятой считается комбинированная терапия с включением следующих составляющих:
Прогноз и профилактика
Кортикобазальная дегенерация характеризуется неуклонным прогрессированием неврологических проявлений. В среднем спустя 5 лет когнитивные и двигательные расстройства приковывают больного к постели. Продолжительность жизни большинства пациентов не превышает 10 лет от времени дебюта симптоматики. Причиной летального исхода обычно становится бронхопневмония. Разработка профилактических мероприятий не представляется возможной до момента установления этиологии КБД.