Что такое декомпенсация печени
Синдром печеночно-клеточной недостаточности
Сущность синдрома печеночно-клеточной недостаточности заключается в нарушении функционирования органа по причине повреждения гепатоцитов. Патология приводит к сбою белково-образующей, липидной, углеводной, пигментной, секреторной и обезвреживающей функций и, как следствие, к метаболическим расстройствам, интоксикации, нарушению деятельности центральной нервной системы, печеночной коме. Патологический процесс может развиваться по ряду причин, среди них: вирусные, бактериальные, паразитарные, аутоиммунные заболевания, нарушения обмена веществ, глистные инвазии, отравления, злоупотребление алкоголем и другие.
Классификация
Синдром принято классифицировать следующим образом.
По клинико-морфологическим признакам. При массовой гибели гепатоцитов констатируют эндогенную форму патологии, которая развивается при острых вирусных гепатитах, интоксикации печени. Экзогенная форма характеризуется нарушением циркуляции кровообращения, что приводит к движению крови из воротной вены без дезинтоксикации в печени сразу в общую систему. Причиной развития может стать шунтирование при портальной гипертензии и циррозе. Если синдром сочетает в себе патогенные механизмы эндогенной и экзогенной формы, то говорят о смешанном типе.
По характеру течения. Развитие хронической формы патологии обусловлено ухудшением состояния при хроническом заболевании печени (фиброзе, опухоли, циррозе и других). Острая печено-клеточная недостаточность проявляется не позднее двух месяцев с момента поражения печени. При молниеносном прогрессировании патологического процесса имеет место фульминантная форма.
По степени развития. Выделяют начальную, выраженную, терминальную дистрофическую стадии и печено-клеточную недостаточность.
Симптомы
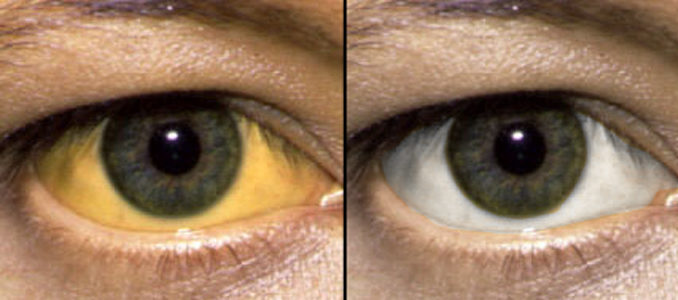
Заболевание на начальной стадии практически себя не проявляет. Больной может чувствовать небольшую слабость, сонливость, дискомфорт в правом подреберье. При прогрессировании патологии появляются следующие симптомы: желтушность кожи, слизистых, склер, зуд, снижение аппетита, нарушение сна, боль в правом подреберье, сильная тошнота с последующей рвотой, гипертермия, головные боли и другие. Дисфункция центральной нервной системы проявляется заторможенностью, нарушением координации движений, проблемами с речью, памятью, шумом в ушах, зрительными и слуховыми аномалиями (вплоть до галлюцинаций), головокружением и прочим. На последних стадиях нарушается функционирование практически всех систем организма и больной находится в бессознательном состоянии.
Лечение
Для стабилизации состояния, возобновления функционирования печени проводится терапия с применением гемодиализа, гемосорбции, плазмафереза и назначается специальная диета. Также осуществляются мероприятия с целью восстановления водно-электролитного и кислотно-щелочного баланса. Курс, методы и медикаментозные средства лечения определяются исходя из состояния больного, степени тяжести заболевания и других факторов.
Почему печёночная недостаточность так опасна и как её лечить
Что такое печеночная недостаточность?
Различают острую и хроническую печеночную недостаточность и 3 стадии ее:
III стадию — терминальную (дистрофическую).
Терминальная стадия печеночной недостаточности заканчивается печеночной комой.
Причины возникновения печеночной недостаточности.
Острая печеночная недостаточность может возникнуть при
— тяжелых формах вирусного гепатита,
— отравлениях промышленными (соединения мышьяка, фосфора и др.),
— растительными (несъедобные грибы)
— другими гепатотропными ядами,
— некоторыми лекарствами (экстракт мужского папоротника, тетрациклин и др.),
— переливании иногруппной крови и в ряде других случаев.
Хроническая печеночная недостаточность возникает при прогрессировании многих хронических заболеваний печени (цирроз, злокачественные опухоли и т. д.).
Фульминантная печеночная недостаточность может быть исходом вирусных гепатитов, аутоиммунных гепатитов, наследственных заболеваний (например, болезни Вильсона-Коновалова); являться результатом приема лекарственных препаратов (например, парацетамола), воздействия токсических веществ (например, токсинов бледной поганки). В 30% случаев причина фульминантной печеночной недостаточности не определена.
Проявления печеночной недостаточности.
Симптомы, течение зависят от характера поражения печени, остроты течения процесса.
Острая печеночная недостаточность развивается быстро, на протяжении нескольких часов или дней, и при своевременной терапии может быть обратимой. Хроническая печеночная недостаточность развивается постепенно, на протяжении нескольких недель или месяцев, но присоединение провоцирующих факторов (прием алкоголя, пищеводно-желудочное кровотечение из варикозно-расширенных вен пищевода, интеркуррентная инфекция, физическое переутомление, прием больших доз мочегонных или одномоментное удаление большого количества асцитической жидкости и т. д.) может быстро спровоцировать развитие печеночной комы.
Проявляется печеночная недостаточность снижением и извращением аппетита, отвращением к табаку у курильщиков, непереносимостью пищи и алкоголя, тошнотой, а также слабостью, снижением трудоспособности, эмоциональными расстройствами и др.
В 1 стадию симптомы могут отсутствовать. При II стадии характерны клинические проявления: немотивированная слабость, снижение трудоспособности, диспепсические расстройства (тошнота, рвота, понос желтого цвета), появление и прогрессирование желтухи, геморрагического диатеза (кровотечения), асцита, иногда отеков.
В III стадии наблюдаются глубокие нарушения обмена веществ в организме, дистрофические явления не только в печени, но и в других органах (нервной системе, почках и т. д. ); при хронических заболеваниях печени выражена кахексия (истощение). Появляются признаки приближающейся печеночной комы.
При острой и хронической печеночной недостаточности повышен распад белков в мышцах, что приводит к дополнительному высвобождению ароматических аминокислот в плазму. Назначение препарата Аминоплазмаль Гепа направлено на уменьшение катаболической утилизации аминокислот и поддержание аминокислотного гомеостаза в плазме.
Введение всех аминокислот, необходимых для синтеза белков (включая условно заменимые и заменимые аминокислоты), входящих в состав препарата Аминоплазмаль Гепа, обеспечивает высокую питательную эффективность и снижает нагрузку на организм при синтезе белка.
Таким образом, основное терапевтическое воздействие препарата Аминоплазмаль Гепа заключается в снабжении организма субстратом синтеза белков при парентеральном питании больных с печеночной недостаточностью. При этом церебральные проявления заболевания, т.е. печеночная энцефалопатия, печеночная прекома или кома, ослабевают, а переносимость белков и их биосинтез значительно улучшаются.
При инфузии препарата Аминоплазмаль Гепа достигаются следующие результаты: нормализуется уровень аминокислот с разветвленной цепью; нормализуется уровень ароматических аминокислот; нормализуется коэффициент Фишера; уменьшается выраженность симптомов печеночной энцефалопатии; снижается концентрация аммиака в крови.
Раствор аминокислот для парентерального питания пациентов с заболеваниями печени и для лечения печеночной энцефалопатии
Если у вас возникли дополнительные вопросы, то вы можете связаться с Доктором Bosti по номеру +996 551 717 713
Что такое декомпенсация печени
Цирроз печени (ЦП) — хроническое полиэтиологическое прогрессирующее необратимое повреждение печени, характеризующееся нарастающим фиброзом, перестройкой нормальной структуры паренхимы печени с формированием узлов регенерации в виде ложных долек и проявляющееся развитием портальной гипертензии (ПГ) и печеночно-клеточной недостаточности.
Распространенность
Истинная распространенность цирроза печени недостаточно изучена. Очевидно, в большинстве случаев ЦП диагностируется уже на далеко зашедших стадиях поражения печени, то есть на стадии декомпенсации.
В экономически развитых странах ЦП входит в число шести ведущих причин смерти пациентов в возрасте 35–60 лет, а частота его составляет, по различным данным, от 14 до 30 случаев на 100 000 населения.
Этиология и патогенез
ЦП является конечной стадией хронического заболевания печени, а также результатом развития морфологических изменений в ней (диффузный фиброз) при ряде патологических состояний.
Наиболее частыми причинами развития ЦП являются хроническая интоксикация алкоголем и вирусные гепатиты (прежде всего гепатит С), а также неалкогольный стеатогепатит (НАСГ) и первичный билиарный цирроз (ПБЦ). Существенно реже ЦП развивается при хронической сердечной недостаточности, гемохроматозе, окклюзионных процессах в системе воротной вены (флебопортальный цирроз). Приблизительно в 10–35 % случаев этиология ЦП остается неустановленной.
Скорость формирования ЦП зависит от характеристик повреждающего фактора (вирулентности вируса, длительности приема алкоголя и т.д.) и обычно продолжается в течение многих лет. На начальных этапах развития ЦП механизмы повреждения печеночной паренхимы различны и определяются этиологическим фактором. Однако ведущие патогенетические механизмы универсальны и включают следующие стадии: 1) некроз гепатоцитов, приводящий к коллапсу печеночных долек; 2) следующее затем диффузное образование фиброзных септ; 3) и, наконец, формирование узлов регенерации. Независимо от этиологии гистологическая картина печени развившегося ЦП однотипна (за исключением ПБЦ).
Повреждение (некроз) гепатоцитов при алкогольном ЦП обусловлено непосредственным токсическим действием ацетальдегида (метаболита метанола). При хроническом употреблении алкоголя наблюдается персистенция повышенных уровней ацетальдегида, обусловливающая накопление жирных кислот и триглицеридов (ТГ) в гепатоцитах, что ведет к развитию жировой дистрофии печени. Этот процесс сопровождается стимуляцией синтеза коллагена и разрастанием фиброзной ткани, что в конечном итоге приводит к ЦП.
При репликации вирусов HBV и HCV развиваются сходные морфологические изменения, включающие апоптоз, гепатоцеллюлярный некроз и воспаление. При этом наблюдается набухание гепатоцитов (баллонная дистрофия), их сморщивание (ацидофильные изменения) и формирование ацидофильных телец. Портальные тракты расширены за счет воспалительной инфильтрации лимфоцитами и плазматическими клетками. По мере прогрессирования воспаление распространяется на печеночные дольки, вызывая повреждение пограничной пластинки и ступенчатые некрозы. Сливающиеся участки некроза в сосудистых структурах (веточки портальной и центральной вен) обозначаются мостовидными некрозами. Фиброз (коллагенизация) на начальных этапах обратим, но после образования в дольках септ, не содержащих клеток, становится необратимым. В результате превалирования процессов образования внеклеточного матрикса над его деградацией формируется рубцовая ткань. Активное участие в фиброгенезе принимают звездчатые клетки (также называемые липоцитами, перицитами), располагающиеся в пространстве Диссе между эндотелиальными клетками и поверхностью гепатоцитов, обращенной к синусоиду. В покое в звездчатых клетках печени содержатся капельки жира, включая витамин А, а также основные запасы ретиноидов организма. При различных патологических процессах в печени происходит активация звездчатых клеток, характеризующаяся их пролиферацией, увеличением в размерах, исчезновением капелек жира, а следовательно, ретиноидов. При этом увеличивается шероховатая эндоплазматическая сеть, появляется белок гладких мышц — a-актин, увеличивается количество рецепторов к провоспалительным цитокинам, стимулирующим пролиферацию и фиброгенез.
Другим ведущим фактором образования фиброзной ткани является разрушение белков матрикса под влиянием ряда ферментов, обозначаемых металлопротеазами, синтез которых происходит преимущественно в активированных звездчатых клетках (купферовских клетках).
Важное место занимают ранние изменения матрикса в пространстве Диссе — отложение коллагена I, III и V типов, что ведет к превращению синусоидов в капилляры (капилляризация) и исчезновению фенестров эндотелия, а следовательно, к нарушению метаболических процессов в гепатоцитах.
Последующее стенозирование синусоидов фиброзной тканью ведет к повышению сосудистого сопротивления в печени и развитию портальной гипертензии.
В участках гибели печеночных клеток формируются узлы регенерации, по периферии которых в области портоцентральных септ сохраняются синусоиды. При этом нарушается кровоснабжение центральной части узла, что способствует прогрессии цирротических изменений.
В патогенезе ЦП, как исхода неалкогольного стеатогепатита (НАСГ), наблюдаемого у больных СД 2-го типа, ведущую роль отводят инсулинорезистентности, которая обусловливает развитие дислипидемии с накоплением ТГ в гепатоцитах, что приводит к развитию жировой дистрофии (стадия стеатоза). Следующие параллельно оксидативный стресс и продукция провоспалительных цитокинов приводят к некрозу гепатоцитов, индукции процессов фиброзирования (стадия фиброза) и, в конечном итоге, формированию цирроза.
В патогенезе ЦП при хронической сердечной недостаточности ведущее место отводится некрозу гепатоцитов, обусловленному персистирующей гипоксемией и венозным застоем.
Этиология, патогенез и лечение первичного билиарного цирроза печени приводятся в отдельном разделе данного семинара.
Патоморфология цирроза печени
Макроскопически при ЦП поверхность печени бугристая, плотная, увеличена в размерах. У части больных в терминальной стадии ЦП имеет место уменьшение печени в размерах и ее сморщивание.
Выделяют три патоморфологические стадии ЦП:
— Начальная стадия (стадия формирования) ЦП.
— Стадия сформировавшегося цирроза.
— Дистрофическая стадия (атрофический ЦП).
При микроскопическом исследовании биоптатов печени выявляются нарушения долькового строения печени, фрагментация ее стенки, наличие узлов-регенератов или ложных долек, фиброзных прослоек или септ, окружающих ложные дольки, утолщение печеночных трабекул, изменение гепатоцитов (крупные клетки регенеративного типа, диспластические гепатоциты с полиморфными ядрами).
Классификация циррозов печени
(Акапулько, 1974; ВОЗ, 1978; А.С. Логинов, Ю.Е. Блок, 1987; Лос-Анджелес, 1994)
I. По этиологии:
1) вирусный — следствие вирусных гепатитов В, С, D;
4) аутоиммунный — следствие аутоиммунного гепатита;
5) вследствие метаболических нарушений:
b) болезнь Вильсона — Коновалова;
c) недостаточность a1-антитрипсина;
d) гликогеноз IV типа;
6. застойный — как следствие застоя в печени, обусловленного сердечной недостаточностью;
a) первичный билиарный;
b) вторичный билиарный;
II. По морфологической характеристике:
1) мелкоузловой (узлы размером 1–3 мм);
2) крупноузловой (узлы размером более 3 мм);
3) смешанный (мелко-крупноузловой);
4) неполный перегородочный (септальный).
III. По активности и скорости прогрессирования:
1) активный (с умеренной или высокой активностью):
a) быстро прогрессирующий;
b) медленно прогрессирующий;
IV. По тяжести течения:
1) компенсированный (печеночная энцефалопатия и асцит отсутствуют);
2) субкомпенсированный (печеночная энцефалопатия I–II степени, асцит, корригируемый диетическим режимом и медикаментозно);
3) декомпенсированный (печеночная энцефалопатия III степени, резистентный напряженный асцит).
V. Осложнения:
1) печеночная кома (или прекома);
2) кровотечение из варикозно расширенных вен пищевода и желудка, геморроидальных вен;
3) тромбоз воротной вены;
4) спонтанный бактериальный перитонит;
5) спонтанный бактериальный плеврит;
6) цирроз-рак (гепатоцеллюлярная карцинома).
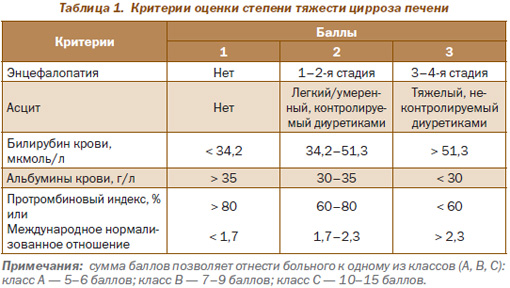
В широкой клинической практике для оценки тяжести ЦП используется балльная шкала Child-Turcotte-Pugh (табл. 1).
Класс А соответствует понятию «компенсированный ЦП».
Класс В соответствует понятию «субкомпенсированный ЦП».
Класс С соответствует понятию «декомпенсированный ЦП».
Клинические проявления цирроза печени
Портальная гипертензия
Определение, распространенность
В зависимости от анатомической локализации нарушений портального кровообращения различают препеченочную (портальная вена), внутрипеченочную (печень) и постпеченочную (сердце, нижняя полая вена, печеночные вены). В подавляющем большинстве случаев причиной внутрипеченочной портальной гипертензии (ПГ) является ЦП.
ПГ, характеризующаяся увеличением градиента давления между портальным и кавальным венозными бассейнами, является ведущим осложнением ЦП и устанавливается при печеночном венозном градиенте давления (ПВГД) выше 5 мм рт.ст. Клинически значимым ПВГД считается при его уровнях 10 мм рт.ст. и выше. Последствия ПГ включают развитие множественных портосистемных шунтов (варикозное расширение вен пищевода, желудка, геморроидальных), асцита/отеков, гепаторенального синдрома и печеночной энцефалопатии, определяющих клиническую картину, характер течения и прогноз.
Частота ПГ при ЦП приближается к 100 %. При ПВГД 10 мм рт.ст. наблюдается развитие интенсивной коллатеральной циркуляции, компенсирующей дальнейшее его нарастание, что ведет к формированию анастомозов, посредством которых кровь из портальной системы поступает в систему нижней полой вены (НПВ).
К основным факторам, обусловившим развитие ПГ при ЦП, относится повышение сопротивления току крови в печени и увеличение спланхнического кровотока (спланхническое кровообращение характеризуется перфузией между чревной, верхней и нижней мезентериальными артериями и портальной веной).
Диффузный фиброз печени, нодулярная перестройка ее паренхимы, капилляризация синусоидов, наличие микротромбов во внутрипеченочной сосудистой сети приводят к дисфункции синусоидальных эндотелиальных клеток (СЭК), продуцирующих в норме вазоактивные субстанции, регулирующие синусоидальную резистентность. К ним относятся вазодилататорные агенты — оксид азота (NO), простагландин Е2 и вазоконстрикторные — эндотелин-1, ангиотензин II, лейкотриены и норадреналин. Дисфункция СЭК ведет к повышению продукции вазоконстрикторов и чувствительности к ним, снижению продукции вазодилататоров. Конечным результатом этих процессов является нарушение синусоидальной релаксации и развитие ПГ.
В отличие от вазоконстрикции, имеющей место во внутрипеченочной сосудистой сети при ЦП, вне ее развивается прогрессирующая спланхническая сосудистая вазодилатация, обусловленная гиперпродукцией вазодилататорных субстанций (прежде всего NO), что ведет к повышению печеночного кровотока и затем к хронизации и усугублению ПГ.
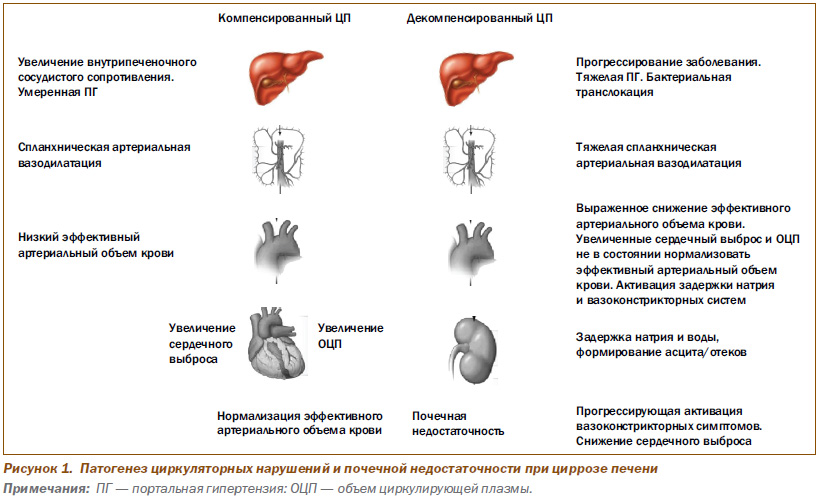
Развитие ПГ ассоциируется с формированием портокавальных шунтов за счет расширения коллатеральных вен. В соответствии с эмбриогенезом коллатерали формируются: 1) в гастроэзофагеальных и геморроидальных сплетениях; 2) облитерированных фетальных сосудах (околопупочных) и 3) порторенальном сплетении. При этом не наступает нормализация портального давления, а развивается гипердинамическое состояние внутрипеченочного кровотока, сопровождающееся увеличением сердечного выброса и снижением периферического сосудистого сопротивления, которые обусловливают снижение эффективного артериального кровотока и развитие гипотензии.
Описанные выше механизмы нейрогуморальной дисфункции обусловливают ретенцию натрия и воды, развитие гиперволемии за счет увеличения объема циркулирующей плазмы и формирование асцита/отеков.
Патофизиология портальной гипертензии
ПГ — ведущее проявление ЦП, обусловливает развитие спланхнической артериальной вазодилатации. В результате развившейся системной артериальной вазодилатации «разряжаются» рецепторы, реагирующие на растяжение в каротидном синусе и дуге аорты, в результате чего стимулируется ренин-ангиотензин-альдостероновая система (РААС), симпатическая нервная система (СНС) и аргинин, вазопрессин (АВП-АДГ). Стимуляция РААС, СНС и АВП способствует поддержанию артериального давления (АД) за счет повышения системной сосудистой резистентности в сочетании с увеличением сердечного выброса. В то время как компенсаторная нейрогуморальная активация препятствует развитию гипотензии, имеет место почечная вазоконстрикция, ассоциируемая с ретенцией натрия и воды. Все это результируется в почечную дисфункцию, носящую функциональный характер, и не обусловлено острым тубулярным некрозом (ОТН). Следовательно, возможно восстановление почечной функции, в частности, после трансплантации печени или при устранении снижения эффективного артериального объема крови, обусловленного спланхнической вазодилатацией, посредством использования комбинации аналогов АВП с альбумином. При первом типе гепаторенального синдрома (ГРС) такой лечебный подход позволяет восстановить почечную функцию в течение 7–10 дней приблизительно у 50 % больных. Наличие почечной вазоконстрикции у больных с ЦП ассоциируется с высоким риском развития ОТН в ситуациях, включающих гастроинтестинальные кровотечения, диарею, обусловленную приемом лактулозы, сепсис или прием нефротоксических антибиотиков (в частности, аминогликозидов) или нестероидных противовоспалительных препаратов (НПВП).
Патогенез циркуляторных нарушений и почечной недостаточности показан на рис. 1.
Клиника портальной гипертензии
В клинической практике выделяют следующие стадии ПГ:
0 стадия — отсутствует варикозное расширение вен и асцит;
I стадия — имеется варикозное расширение вен без асцита;
II стадия — имеется варикозное расширение вен и асцит;
III стадия — наблюдаются кровотечения из варикозно расширенных вен при наличии асцита;
0 и I стадии соответствуют компенсированному ЦП, II и III стадии — декомпенсированному.
Уже на ранних этапах ЦП возникают диспептические расстройства (снижение аппетита, тошнота, метеоризм). По мере нарастания и персистенции ЦП появляются слабость, утомляемость, дискомфорт в обоих подреберьях, желтуха, «сосудистые звездочки», «печеночные ладони» и др.
Характерно похудание, часто маскируемое одновременным накоплением жидкости в брюшной полости. В 25 % случаев отмечается уменьшение размеров печени, спленомегалия у 50 % больных. Гепатолиенальный синдром часто сопровождается гиперспленизмом, характеризующимся снижением в крови форменных элементов крови (лейкопенией, тромбоцитопенией, анемией) и увеличением клеточных элементов в костном мозге. Гинекомастия и импотенция у мужчин и нарушение менструального цикла у женщин объясняются появлением на фоне печеночно-клеточной недостаточности признаков гиперэстрогенемии. У половины больных повышена температура тела. В большинстве случаев лихорадка носит субфебрильный характер и сохраняется несколько недель.
Характерным проявлением ЦП и клинически значимой портальной гипертензии на II–III стадии являются варикозное расширенние вен в описанных выше сосудистых сетях, асцит и их осложнения (кровотечения, перитонит), печеночная энцефалопатия.
Клинические проявления и лечебная тактика при компенсированном и декомпенсированном циррозе печени
В настоящее время рекомендуется рассматривать компенсированный ЦП (КЦП) (класс А) в отношении диагностики, лечебных подходов и прогноза раздельно от декомпенсированного ЦП (ДЦП) (классы В и С). В связи с этим далее мы отдельно обсуждаем клинические проявления и лечебную тактику при компенсированном и декомпенсированном ЦП.
Компенсированный цирроз печени
Больные КЦП класса А характеризуются отсутствием желтухи, асцита, кровотечений из варикозных вен и энцефалопатии.
Лечебная тактика при КЦП преследует две ведущие цели: 1) лечение заболевания печени или патологических состояний, обусловивших развитие ЦП (гепатиты С или В, алкогольный гепатит, НАСГ) и 2) ранняя диагностика ЦП и профилактика его осложнений. Лечение заболеваний печени не является предметом данного обсуждения.
Диагностика гастроэзофагеальных варикозных вен и первичная профилактика варикозных кровотечений (ВК)
Всем больным с впервые диагностированным ЦП необходимо проведение ФГДС с целью диагностики варикозных вен (ВВ) пищевода и желудка и определения необходимости проведения терапии, предупреждающей первый эпизод ВК.
ВВ выявляется приблизительно у 50 % больных с ЦП. Их наличие коррелирует с тяжестью поражения печени: у лиц с классом А варикозно расширенные вены наблюдаются в 40 % случаев, а при классе С — в 85 %. Частота гастроэзофагеальных кровотечений составляет 12–15 % в год, а летальность достигает 15–20 %. В связи с этим важное место в ведении больных с КЦП отводится лечебным подходам, направленным на первичную профилактику ВК.
Показания для проведения первичной профилактики гастроэзофагеальных кровотечений включают: большие размеры ВВ (варицелы) и классы В и С ЦП.
Для первичной профилактики используются два подхода:
1) неселективные b-адреноблокаторы (b-АБ) (при отсутствии противопоказаний);
2) эндоскопическое лигирование варицел (ЭЛВ).
Неселективные b-АБ (пропранолол, надолол) уменьшают портальное давление за счет снижения сердечного выброса (b1-блокирующий эффект) и в большей мере за счет снижения притока крови в портальную вену вследствие вазоконстрикции спланхнической (чревной) сосудистой сети (b2-блокирующий эффект). В связи с этим не рекомендуется использовать селективные b-АБ с целью профилактики кровотечений.
Представлены убедительные доказательства способности неселективных b-АБ снижать частоту первичных ВК (на 15–25 %) и уменьшать летальность, обусловленную ими, а также замедлять рост варицел.
Применение b-АБ не показано больным ЦП без варицел.
Не рекомендуется использование нитратов (например, изосорбида мононитрат), являющихся потенциальными вазодилататорами. Их применение не только не снижает частоту кровотечений, но и ассоциируется с увеличением летальности вследствие усугубления вазодилатирующего состояния. Также не рекомендуется использование комбинации нитратов с b-АБ. Не получены доказательства способности сартанов снижать риск ВК. Комбинация b-АБ со спиронолактоном не повышает эффект b-АБ.
Эффективность ЭЛВ в снижении частоты ВК близка к таковой при применении неселективных b-АБ.
Риск развития декомпенсации при использовании различных медикаментов
Ацетаминофен (парацетамол) и НПВП, включая аспирин, потенциально могут вести к декомпенсации больных с КЦП или к нарастанию тяжести декомпенсации.