Что такое делокализованная связь
Делокализованная связь
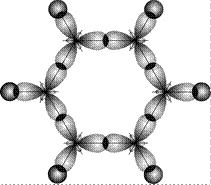
Рис. 18. Схема образования локализованных s-связей в молекулах бензола
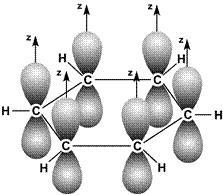
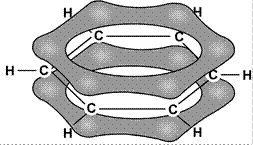
Энергия связи между атомами углерода в этой молекуле равна 487 кДж/моль, т.е. имеет промежуточное значение между энергией одиночной связи С–С в этане (385 кДж/моль) и двойной связи С = С в этилене (592 кДж/моль). Это свидетельствует о том, что p-связи делокализованы: электроны p-связей движутся свободно по всему замкнутому шестиугольнику и «обслуживают» все шесть связей. На рис. 19 молекула С6Н6 показана «сбоку»: видны негибридные p-орбитали и делокализованная p-связь между ними.
Рис. 19. Схема образования делокализованной p-связи в молекулах бензола
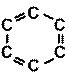
Таким образом, кратность связи между атомами углерода в молекуле С6Н6 равна 1,5 (одна s-связь и половина p-связи). Современное схематическое изображение бензольного кольца, в котором пунктиром показана делокализованная p-связь по всему кольцу, отличается от того, которое использовалось ранее (рис. 20)
1) 
Рис. 20. Схематическое изображение бензольного кольца: 1 – современное, 2 – устаревшее
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Разница между локализованными и делокализованными химическими связями
В ключевое отличие между локализованными и делокализованными химическими связями эта локализованная химическая связь представляет собой конкретную связь или неподеленную электронную пару на конкретном
Содержание:
В ключевое отличие между локализованными и делокализованными химическими связями эта локализованная химическая связь представляет собой конкретную связь или неподеленную электронную пару на конкретном атоме, тогда как делокализованная химическая связь представляет собой особую связь, которая не связана с одиночным атомом или ковалентной связью.
Что такое локализованные химические связи?
Локализованная связь образуется, когда две молекулярные орбитали двух отдельных атомов перекрываются друг с другом. Сигма-связи могут образовываться из-за перекрытия двух s-орбиталей, двух p-орбиталей или перекрытия s-p.
Что такое делокализованные химические облигации?
Например, бензольное кольцо имеет три одинарные связи и три двойные связи в чередующемся порядке. Каждый атом углерода в этом кольце имеет р-орбиталь, которая не подвергается фронтальному перекрытию. Следовательно, эти p-орбитали могут перекрываться сторонами. Такое перекрытие и есть делокализация. Мы можем обозначить это как два кружка вверху бензольного кольца и внизу кольца. Эти электроны могут свободно перемещаться по молекуле, потому что они не имеют постоянной связи с одиночным атомом или ковалентной связью.
В чем разница между локализованными и делокализованными химическими связями?
ХИМИЧЕСКАЯ СВЯЗЬ
ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ
Расстояние действия связи
Свойства химической связи проявляются в свойствах различных типов молекул, кристаллов и других объединений атомов и молекул. Ранее считалось, что и природа различных видов связи (ковалентной, ионной, металлической, водородной и др.) различна. Сегодня можно считать, что известные на сегодня виды химической связи едины по своей природе. Поэтому существует возможность единой их классификации. Химическую связь можно подразделить на различные виды.
В зависимости от расстояния, на котором проявляется химическая связь, ее делят на короткодействующую и дальнодействующую.
Короткодействующая связь проявляется на расстояниях, близких к размерам атомов. Она осуществляется между атомами в молекуле, кристалле в пределах от 74 до 400 пм. Энергия разрыва короткодействующей химической связи находится в пределах от 40 до 1000 кДж/моль. В таблице приведены длины и энергии разрыва отдельных видов таких связей.
Образование большинства известных молекул, существующих в изолированном состоянии, обусловлено наличием короткодействующих связей. Данный вид связи называют также сильной связью.
Дальнодействующая химическая связь условно может быть разделена на два типа:
Самые устойчивые объединения атомов в молекулы осуществляются за счет короткодействующей химической связи. Характерными признаками такой связи обладают четыре ее вида:
Степень перераспределения электронной плотности
Каждый из перечисленных видов химической связи может видоизменяться в зависимости от различных признаков. Если в качестве такого признака выбрать степень перераспределения электронной плотности между атомами при образовании химической связи, то можно выделить связи: неполярную, полярную и сильно полярную. Неполярная и полярная короткодействующая химическая связь является тем видом связи, который хорошо известен как ковалентная химическая связь. Сильно полярная химическая связь представлялась независимой от ковалентной связи и исторически получила название ионной.
Степень обобществления электронной плотности
В зависимости от степени обобществления электронной плотности химической связи между несколькими атомами различают локализованную и делокализованную химическую связь.
называется такая химическая связь, электронная плотность которой сконцентрирована (локализована) в пределах двух наиболее близко расположенных друг к другу ядер атомов.
Обеспечение связи
Различают также виды связи по их свойству обеспечивать связь только между ограниченным числом атомов. Такие связи называются насыщаемыми. В противном случае говорят о ненасыщаемости химической связи. Также различают связи направленные и ненаправленные.
— такие связи, энергия которых сильно зависит от расположения данной связи относительно других связей вокруг выбранного атома.
считаются те, которые мало чувствительны к взаимной ориентации связей атома.
Схема образования ионной связи



Кулоновские силы притяжения, возникающие при взаимодействии заряженных ионов, сильные и действуют одинаково во всех направлениях. В результате этого расположение ионов упорядочивается в пространстве определенным образом, образуя ионную кристаллическую решётку. Вещества с ионной КР при обычных условиях находятся в кристаллическом состоянии, они имеют высокие температуры плавления и кипения.
Металлы и их сплавы кристаллизуются в форме металлических решёток. Узлы в металлической решётке заняты положительными ионами металлов. Валентные электроны, отделившиеся от атомов металлов и оставшиеся в узлах кристаллической решётки ионы, более или менее свободно перемещаются в пространстве между катионами и обуславливают электрическую проводимость металлов. Между ионами и свободными электронами возникают электростатические взаимодействия, которые и являются причиной возникновения металлической связи.
Металлическая связь имеет сходство как с ионной (образуется за счёт взаимодействия между заряженными частицами: электронами и ионами), так и с ковалентной ( происходит обобществление электронов, но в отличии от ковалентной связи, где электроны локализованы около определенных атомов, электроны в металлах обобществляются для всего кристалла). Свободные электроны иногда называют электронным газом.
Катионы в металлических решётках не обладают поступательным движением, а совершают колебания вокруг положения узлов решётки. Амплитуда этих колебаний возрастает при повышении температуры, а при достижении температуры плавления металла решётка разрушается. Температура плавления металлов, как правило возрастает с увеличением числа валентных электронов в их атомах.
Смеси двух или более индивидуальных металлов называются сплавами. В сплавах могут присутствовать в небольших количествах и некоторые неметаллы( углерод, сера, кремний). Распространенным методом получения сплавов является совместное нагревание их составных частей до полного расплавления смеси. Однако некоторые металлы не сплавляются друг с другом в любых отношениях.
Металлические сплавы можно классифицировать так: твёрдые растворы внедрения (часть межузельных полостей решётки занята атомами другого элемента, например атомы углерода в железе-чугун и стали); твёрдые растворы замещения (часть атомов основного вещества заменена на атомы примесного элемента-оловянный припой-64 части олова и 36-свинца); смеси индивидуальных кристаллов металлов; смеси кристаллов интерметалических соединений (сплавляемые металлы образуют химические соединения-в бронзе присутствует соединение Cu3Sn )
Ван-дер-Ваальсовы силы — силы межмолекулярного (и межатомного) взаимодействия с энергией 10 — 20 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. ОткрытыЯ. Д. ван дер Ваальсом в 1869 году.
Ван-дер-Ваальсовы силы межатомного взаимодействия инертных газов обусловливают возможность существования агрегатных состояний инертных газов (газ, жидкостьи твёрдые тела).
К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия, а также водородные связи, определяют формирование пространственной структуры биологических макромолекул.
Ван-дер-ваальсовы силы также возникают между частицей (макроскопической частицей или наночастицей) и молекулой и между двумя частицами
15. Метод валентных связей. Представление о гибридизации атомных орбиталей. Геометрия многоатомных молекул: модель Гиллеспи.
Метод валентных связей (МВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. В отличие от ММО, в котором простейшая химическая связь может быть как двух-, так и многоцентровой, в МВС она всегда двухэлектронная и обязательно двухцентровая. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности. Так же, как и в ММО, в образовании химической связи принимают участие валентные электроны. Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
Отметим, что электроны, описываемые ЛО, в соответствии с принципом Паули должны иметь противоположно направленные спины, то есть в МВС все спины спарены, и все молекулы должны быть диамагнитны. Следовательно, МВС принципиально не может объяснить магнитные свойства молекул.
Тем не менее, принцип локализованных связей имеет ряд важных преимуществ, одно из которых – его чрезвычайная наглядность. МВС достаточно хорошо, например, предсказывает валентные возможности атомов и геометрию образующейся молекулы. Последнее обстоятельство связано с так называемой гибридизацией АО. Она была введена для объяснения того факта, что двухэлектронные двухцентровые химические связи, образованные за счет АО в разных энергетических состояниях, имеют одинаковую энергию. Так, Be*(2s 1 1p 1 ), B*(2s 1 2p 2 ), C*(2s 1 2p 3 ) образуют за счет s— и p-орбиталей соответственно две, три и четыре связи, а потому одна из них должна быть прочнее других. Однако опыт показывает, что в BeH2, BCl3, CH4 все связи равноценны. У BeH2 угол связи равен 180°, у BCl3 – 120°, а у CH4 – 109°28′.
Согласно представлению о гибридизации, химические связи образуются смешанными – гибридными орбиталями (ГО), которые представляют собой линейную комбинацию АО данного атома (s— и p-АО Be, B, C), обладают одинаковыми энергией и формой, определенной ориентацией в пространстве (симметрией). Так s— и p-орбитали дают двеsp-ГО, расположенные под углом 180° друг относительно друга.
Гибридные орбитали и геометрия молекул
Модель Гиллеспи основывается на предположении о том, что связь осуществляется за счет пары электронов, а геометрическое строение молекул/ионов определяется общим числом электронных пар, окружающих центральный атом. При этом выполняются следующие правила:
· Электронные пары, поделенные и неподеленные, располагаются вокруг центрального атома так, чтобы их отталкивание было минимальным, т.е. на максимально удаленном расстоянии друг от друга
· Неподеленная электронная пара занимает больший объем, чем поделенная
· Объем занимаемой связующей электронной пары тем меньше, чем ьольше электроотрицательность атома, связанного с центральным
· Две электронные пары с двойной связью занимают больший объем, чем одна пара одинарной связи
Недостатки модели Гиллеспи
· Неприменимость к большинству соединений d-, s-элементов
· Неприменимость к соединениям с существенной доли ионности связи
· Невозможность предсказать геометрию молекул/ионов с инертной неподеленной электронной парой
16. Метод молекулярных орбиталей. Основные понятия. Двухцентровые двухэлектронные молекулярные орбитали. Энергетические диаграммы двухатомных гомоядерных молекул, образованных элементами 1-го и 2-го периодов. Магнитные свойства. Корреляции между порядком связи и энергией ионизации. Энергетические диаграммы простейших гетероядерных молекул (CO, HF, LiH, H2O).
В методе МО предполагают, что в молекуле, как и в атоме, можно построить набор разрешенных дискретных энергетических уровней и соответствующих им волновых функций (молекулярных орбиталей), описывающих поведение электрона в молекуле. На каждом энергетическом уровне может располагаться не более двух электронов. Для построения волновых функций МО часто используют атомные орбитали (АО), описывая каждую МО yi как линейную комбинацию АО (МО ЛКАО).
18. Химическая связь в гомоядерных двухатомных молекулах элементов второго периода с позиции методов МО и ВС. Схемы МО для молекул начала и конца второго периода. Изменение порядка связи, энергия связи, длины связи при переходе от Li2 к Ne2. Особенности молекул B2 и O2. Прочность связи в молекуле N2
19. Гетероядерные двухатомные молекулы элементов второго периода. Схемы МО для HF, CO, CN, OF. Метод ВС и гибридизации орбиталей. Валентное состояние атома. Типы гибридизаций и пространственное строение молекул по Гиллеспи.
20. Ковалентная связь в многоатомных молекулах. Донорно-акцепторное взаимодействие. Локализованная и делокализованная связь. Трехцентровые связи. Направленность и насыщаемость химической ковалентной связи. Теория отталкивания электронных пар валентной оболочки и пространственная структура молекул
Донорно-акцепторное взаимодействие — перенос заряда между молекулами донора и акцептора без образования между ними химической связи (обменный механизм); или передача неподеленной электронной пары от донора к акцептору, приводящей к образованию связи (донорно-акцепторный механизм).
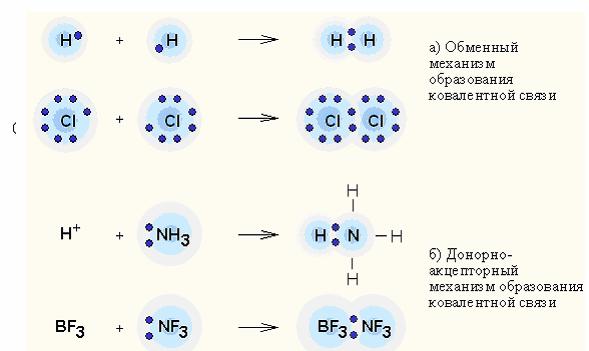 |
Ковалентная связь– наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
| Ковалентная связь может быть локализованной и делокализованной. Локализованной называют связь, электроны которой фактически поделены между двумя ядрами связываемых атомов. Если электроны связи поделены более чем между двумя ядрами, то говорят о делокализованной связи. |
Участвующие в сопряжении делокализованные р-орбитали могут принадлежать либо двум π-связям и более, либо π-связи и одному атому с р-орбиталью. В соответствии с этим различают π,π-сопряжение и ρ,π-сопряжение. Система сопряжения может быть открытой или замкнутой и содержать не только атомы углерода, но и гетероатомы.
Двухэлектронная трёхцентровая связь — одна из возможных электроно-дефицитных связей. Характерна тем, что пара валентных электронов локализована в пространстве сразу трёх атомов (отсюда и понятие «электроно-дефицитности» — «нормальным» случаем является двухэлектронная двухцентровая связь). Общее описание механизма образования электронодефицитных связей даётся в рамках теории молекулярных орбиталей (модель «несвязывающих» орбиталей).
Наибольший вклад в развитие теории трёхцентровых двухэлектронных связей был сделан при изучении бороводородов и борорганических соединений, где подобное связывание реализуется очень часто (например, в диборане).
Возможны и другие электронодефицитные связи, с другим соотношением валентных электронов и связанных атомов. Подобное связывание часто реализуется в металлорганических соединениях.
Теория отталкивания электронных пар валентных орбиталей (ОЭПВО) — один из подходов в химии, необходимый для объяснения и предсказания геометриимолекул. Согласно этой теории молекула всегда будет принимать форму, при которой отталкивание внешних электронных пар минимально (принцип минимума энергии).
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (H2, Cl2, N2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
21. Химическая связь и типы кристаллов. Типы кристаллических решеток. Основы зонной теории. Связь в металлах, полупроводниках и диэлектриках. Дефекты кристаллической решетки. Твердые растворы. Ионная связь. Взаимодействие ионов в кристаллической решетке. Энергия ионной кристаллической решетки, влияние размеров и зарядов ионов
Зонная теория – описание движения электронов в кристаллах, является основой современной теории металлов, полупроводников и диэлектриков.
Величина запрещенной зоны является ключевой величиной и определяет электрические и оптические свойства материала.
Диэлектрики – материалы, из которых зона не перекрывается. Для того, чтобы перевести электрон из валентной зоны в зону проводимости, требуется значительная энергия, поэтому диэлектрики почти не проводят ток.
Полупроводники – материалы, из которых зоны не перекрываются. Для того, чтобы перевести электрон из валентной зоны в зону проводимости, требуется энергия меньшая, чем для диэлектрика, поэтому чистые полупроводники слабо пропускают ток.
· Металлическая – в узлах расположены атомы металла, теплопроводны
Что такое делокализованная связь
В образовании химических связей принимают участие лишь в а лентные электроны, находящиеся во внешних слоях атомов. В соо т ветствии с этим углерод в органических соединениях проявляет в а лентность 4, так как при возбуждении изменяется его электроннная конф и гурация:
Первое объяснение природы химической связи было предпринято Г. Льюисом и В. Косселем в 1916 г. Ими были предложены два гла в ных т и па химической связи:
1) ионная (электровалентная) связь, образующаяся за счет пер е носа одного или более электронов от одного атома к другому с обр а зов а нием ионов;
Различают два способа образования двухэлектронной ковален т ной связи:
1) Коллигация каждый атом, участвующий в образовании св я зи, вносит один электрон на образование общей электронной пары:
2) Координация образование донорно-акцепторной связи за счет пары электронов одного атома. Ее образование может происх о дить двумя путями:
б) передача электронной пары от донора на вакантную орбиталь акцептору:
Если образование донорно-акцепторной связи сопровождается возникновением на соседних связывающихся атомах противополо ж ных зарядов, то такие связи называют семиполярными связями. Для их об о значения применяют черточки с зарядами или однонаправленные (от донора к акцептору) стрелки.
Как и образование, разрыв химической связи может осущест в ляться по двум механизмам: 1) Гомолитический разрыв происходит таким образом, что у каждого из ранее связанных атомов остается по одному электрону. При этом образуются радик а лы:
2) Гетероциклический разрыв приводит к образованию двух пр о тивоположно заряженных ионов, электронная пара сохраняется при разрыве связи при одном, как правило, более электроотрицательном атоме:
Ковалентная связь характеризуется: длиной, энергией, полярн о стью, поляризуемостью и направленностью.
В общем случае длина связи равна сумме ковалентных радиусов атомов, составляющих связь.
Длины некоторых связей представлены в табл. 7.
Длина, энергия, полярность, поляризуемость некоторых ковалентных св я зей
При увеличении кратности связей между атомами их длина всегда уменьшается.
Энергии связи могут заметно изменяться в зависимости от факт о ров, связанных со структурой молекулы. Так, энергия связи С−Н для первичного, вторичного и третичного атомов углерода не одинакова и уменьшается при переходе от С перв. Н к С трет.. Н.
2.3. Направленность химической связи определяется гибридным состоянием атомов, участвующих в ее образовании. Углы между дв у мя связями, имеющими общий атом, называются валентными углами. Эти углы в органических соединениях должны соответствовать с о стоянию гибридизации атома углерода.
2.4. Полярность связи асимметрия распределения электронной плотности между атомами вследствие различия их в электроотриц а тельности. Если атомы, образующие ковалентную связь, равноценны, то пара электронов связи в равной степени принадлежат обоим ат о мам. Большинство же ковалентных связей образовано неодинаковыми или неравноценными атомами, что приводит к смещению электро н ной плотности в сторону одного из них. Чем больше электроотриц а тельность элемента, тем сильнее притяжение между ядром и вне ш ними электронами в атоме (табл. 8).
Шкала электроотрицательности по Полингу
Разность электроотрицательностей (РЭО) связанных атомов разных элементов служит мерой полярности связи между ними:
Ковалентные связи С−С являются неполярными. Кроме них как неполярные рассматривают также связи С−Н в углеводородах, хотя п о следние следует рассматривать как малополярные (РЭО для связи С−Н 2,5 (С) 2,1 (Н) = 0,4; дипол ь ный момент 0,2 D ).
Значения дипольных моментов некоторых связей представлены в табл. 7.
2.5. Поляризуемость связи способность изменять свою поля р ность под действием внешнего поля (как правило, реагента).
Порляризуемость связи растет с увеличением размеров атомов (электронных оболочек), образующих связь (табл. 7). Легче поляр и зуются связи, максимальная электронная плотность которых распол а гается дальше от ядер связываемых атомов. π-Связи более поляризу е мы, чем σ-связи. Поляризуемость в значительной степени определяет реакционную способность молекул.
2.6. Водородные связи
Примеры межмолекулярных водородных связей:
Водородная связь играет важную роль в проявлении многих ф и зических и химических свойств молекул. Межмолекулярные водоро д ные связи обусловливают ассоциацию многих соединений, таких как спирты, карбоновые кислоты, что приводит к аномально высоким температурам их кипения. Сольватация посредством водородных св я зей с растворителем способствует повышению растворимости ряда веществ. Водородные связи вносят также вклад в стабилизацию обр а зующихся в растворах ионов. Внутримолекулярные водородные связи образуются, если взаимодействующие функциональные группы ра с положены так, что возможно замыкание шестичленного или пят и членного циклов.
Примеры внутримолекулярных водородных связей:
Водородные связи играют важнейшую роль в формировании пространственной структуры белков, нуклеиновых кислот, полисах а ридов, а также в протекании ряда биохимических процессов.
3.1.Типы сопряженных систем (π,π-, р,π-). При образовании к о валентной связи между двумя атомами связывающая МО является двухцентровой и двухэлектронной и называется локализованной МО. Если же одна или более связывающих орбиталей о х ватывают три или большее число ядер, то в этом случае речь идет о делокализованной связи. Делокализованная связ ь это ковалентная связь, МО которой охватыв а ют более двух атомов.
Делокализованные связи реализуются в соединениях, содерж а щих открытые или замкнутые системы сопряжения.
3.2.Электронные смещения в молекулах органических соед и нений. Индуктивный и мезомерный эффекты. Составляющие м о лекулу атомы испытывают взаимное влияние, передающееся с пом о щью электронных и пространственных эффе к тов. Если, например, С-атом связан с более электроотрицательным атомом азотом, кисл о родом, галогенами, то на нем возникает дефицит электронной пло т ности, обозначаемый «δ+», а на гетероатоме − избыток электронной плотности, обозначаемый «δ-»:
Полярность одной связи передается по механизму электростат и ческой индукции по цепи σ-связей, что и обуславливает, так называ е мый, индуктивный эффект (I-эффект). Передача происходит с п о степенным затуханием и через три-четыре связи уже не пр о является:
б) группы с семиполярными связями:
в) ониевые и катионные заместители:
г) ненасыщенные и ароматические заместители:
а) алкильные группы:
б) анионные заместители:
Мезомерный эффект или эффект сопряжения (М-эффект ) это электронные смещения по системе полярных делокализованных π-связей.
В результате проявления заместителем мезомерного эффекта ра с пределение электронной плотности в сопряженной открытой углеро д ной цепи или в ароматической системе отличается от того распред е ления, которое имело бы место в отсутствие этого заместителя. Мез о мерный эффект, в отличие от индуктивного, передается по сопряже н ной системе без затухания.
Группы, обладающие −М-эффектом :
Красным отмечены атомы, входящие в образование системы д е локализованных связей. К примеру:
Группы, обладающие +М-эффектом:
Чтобы установить, имеется ли М-эффект необходимо :
а) выделить в молекуле сопряженную систему связей;
б) если система симметрична М-эффекта нет;