Что такое денатурация биология
Денатурация белков
Денатурация белков (от лат. de- — приставка, означающая отделение, удаление и лат. nature — природа; не путать с лат. denaturatus — лишенный природных свойств) — термин биологической химии, означающий потерю белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.
Процесс денатурации отдельной белковой молекулы, приводящий к распаду её «жёсткой» трёхмерной структуры, иногда называют плавлением молекулы.
Содержание
Механизмы денатурации
Практически любое заметное изменение внешних условий, например, нагревание или обработка белка щелочью приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др.
Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Визуально это выглядит, например, как образование «белка» при жарке яиц.
Ренатурация
Ренатурация (высаливание) — процесс, обратный денатурации, при котором белки возвращают свою природную структуру. Нужно отметить, что не все белки способны ренатурировать; у большинства белков денатурация необратима.
См. также
Ссылки
Полезное
Смотреть что такое «Денатурация белков» в других словарях:
денатурация белков — – явление разрушения нативной (вторичной, третичной и четвертичной) структуры белка под действием химических и физико химических факторов … Краткий словарь биохимических терминов
Денатурация белков — * дэнатурацыя бялкоў * denaturation of proteins разворачивание белковой молекулы, потеря ею четвертичной, третичной и вторичной структур под действием высокой температуры или ионных детергентов, таких как содиумдодецил сульфат. Переход из… … Генетика. Энциклопедический словарь
денатурация белков — (иск. лат. denaturare лишать природных свойств) изменение естественных свойств белков при изменении физ. и хим. условий среды (температуры, давления и т. п.), проявляющееся в понижении растворимости белков, повышении вязкости их растворов,… … Словарь иностранных слов русского языка
ДЕНАТУРАЦИЯ БЕЛКОВ — потеря, изменение естественных свойств белков (растворимости, гидрофильности, вязкости и т. д.) вследствие нарушения естественной вторичной и третичной структур под влиянием высокой температуры, действия сильных кислот и щелочей, тяжелых металлов … Словарь ботанических терминов
Денатурация — Денатурация лишение естественных свойств Денатурация биополимеров изменение структуры их молекул, приводящее к потере их естественных свойств: Денатурация белков Денатурация нуклеиновых кислот Денатурация продуктов изменение… … Википедия
денатурация — и, ж. dénaturation f. 1. Изменение природной структуры молекулы белка, нуклеиновой кислоты и других биополимеров при воздействии физических и химических свойств среды (температуры, давления и т. п.). БАС 2. Белки природных продуктов называют… … Исторический словарь галлицизмов русского языка
ДЕНАТУРАЦИЯ — (от лат. De приставка, означающая удаление, утрату, и nаtura природные свойства), утрата природной (нативной) конфигурации молекулами белков, нуклеиновых к т и др. биополимеров в результате нагревания, химич. обработки и т. п. Обусловлена… … Биологический энциклопедический словарь
денатурация — и, мн. нет, ж. ( … Словарь иностранных слов русского языка
Денатурация — белков (от Де. и лат. natura природные свойства, сущность), характерное для белковых веществ изменение их строения и естественных свойств при изменении физических и химических условий среды: при повышении температуры, изменении… … Большая советская энциклопедия
денатурация — см. денатурировать; и; ж. Денатура/ция белков. Денатура/ция спирта … Словарь многих выражений
Денатурация
Смотреть что такое «Денатурация» в других словарях:
Денатурация — Денатурация лишение естественных свойств Денатурация биополимеров изменение структуры их молекул, приводящее к потере их естественных свойств: Денатурация белков Денатурация нуклеиновых кислот Денатурация продуктов изменение… … Википедия
денатурация — и, ж. dénaturation f. 1. Изменение природной структуры молекулы белка, нуклеиновой кислоты и других биополимеров при воздействии физических и химических свойств среды (температуры, давления и т. п.). БАС 2. Белки природных продуктов называют… … Исторический словарь галлицизмов русского языка
ДЕНАТУРАЦИЯ — (от де. и лат. natura природные свойства) любые изменения природной (нативной) структуры молекулы белка, нуклеиновой кислоты и других биополимеров, не сопровождающиеся разрывом прочных ковалентных химических связей. Денатурация ведет к… … Большой Энциклопедический словарь
ДЕНАТУРАЦИЯ — [дэ], денатурации, мн. нет, жен. (спец.). Действие по гл. денатурировать. Денатурация спирта. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ДЕНАТУРАЦИЯ — (от лат. De приставка, означающая удаление, утрату, и nаtura природные свойства), утрата природной (нативной) конфигурации молекулами белков, нуклеиновых к т и др. биополимеров в результате нагревания, химич. обработки и т. п. Обусловлена… … Биологический энциклопедический словарь
денатурация — изменение природной структуры молекулы белка, нуклеиновой кислоты и других биополимеров, не сопровождающееся разрывом прочных ковалентных хим. связей. Д. ведет к изменению свойств биополимера, может быть полной и частичной, обратимой и… … Словарь микробиологии
денатурация — и, мн. нет, ж. ( … Словарь иностранных слов русского языка
денатурация — сущ., кол во синонимов: 1 • денатурирование (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
денатурация — Процесс нарушения нативной конформации биологических макромолекул в результате разрыва нековалентных связей, индуцируемый химическими веществами, нагреванием, охлаждением и т.п. и сопровождающийся потерей биологической активности; Д. может быть… … Справочник технического переводчика
Денатурация — * дэнатурацыя * * denaturation изменение или даже утрата белками (и нуклеиновыми кислотами) их естественных свойств при перемене физических и химических условий среды (температуры, давления и др.): понижение растворимости, повышение вязкости их… … Генетика. Энциклопедический словарь
денатурация — ДЕНАТУРАЦИЯ, ДЕНАТУРИРОВАТЬСЯ см. Денатурировать. * * * денатурация (от де. и лат. natura природные свойства), любые изменения природной (нативной) структуры молекулы белка, нуклеиновой кислоты и других биополимеров, не сопровождающиеся… … Энциклопедический словарь
Денатура – определение, типы, функции и примеры
Определение денатурирования
Денатурирующий биологический молекула относится к потере своей трехмерной (3-D) структуры. Поскольку молекулы, такие как белки и ДНК, зависят от своей структуры для выполнения своей функции, денатурация сопровождается потерей функции. Однако денатурация не оказывает влияния на аминокислотную последовательность самого белка.
Структура белков
Структуру белка можно разделить на четыре уровня – первичный, вторичный, третичный и четвертичный. Белки изготовлены из линейных полимеров аминокислоты и это формирует их первичную структуру. Даже когда полипептид синтезируется на рибосома, он начинает складываться и формировать элементы своей вторичной структуры. Наиболее распространенными признаками вторичной структуры белка являются альфа-спирали и бета-складчатые листы, образованные посредством обширной водородной связи. Эти локальные структуры, образованные соседними аминокислотами, затем собираются вместе, образуя третичная структура где остатки, которые находятся далеко друг от друга в первичной структуре, могут объединяться в одной и той же пространственной области. Это позволяет определенным аминокислотам присутствовать в активный сайт или для взаимодействия с другими молекулами и для поддержки других частей белка, которые складываются в отличительную форму.
Примеры денатурированных белков
Хотя денатурация белка вредна для клетка выживание, это часто встречается в повседневной жизни. Например, яичный белок в основном состоит из растворимых белков и является жидким и прозрачным в свежих яйцах. При кипячении тепло денатурирует белки и теряет их растворимость. Денатурированные белки агрегируют и образуют массу, которая теперь непрозрачна и тверда. Аналогичным образом, изменение рН молока путем добавления кислот, таких как лимонная кислота, из лимонного сока, приводит к денатурации молочных белков и сгущает молоко. Твердая белая часть, которая отделяется от сыворотки, представляет собой денатурированный белок. Это также можно увидеть, когда молоко естественным образом сжимается из-за бактериальной колонизации. бактерии может производить молочную кислоту как побочный продукт обмена веществ. При правильном контроле этот процесс денатурации используется для приготовления йогурта и свежего сыра.
Денатурированные белки участвуют в ряде заболеваний, от болезни Паркинсона, болезни Альцгеймера до хореи Хантингтона. Люди, страдающие от этих болезней, имеют ненормально свернутые белки в некоторой части своего тела, с головной мозг а также нервная система быть особенно восприимчивым. Кроме того, одной из основных причин слепоты является наличие денатурированных белков в хрусталике глаза. В этом случае считается, что денатурация возникает из-за старения или из-за чрезмерного воздействия УФ-излучения.
Типы денатурации
Денатурация может быть классифицирована на основе агента, который заставляет белок терять свою вторичную, третичную или четвертичную структуру. Водородные связи, ионные взаимодействия, гидрофобный взаимодействия и силы Ван дер Ваала участвуют в удержании этих структур вместе. Такие нековалентные взаимодействия нарушаются рядом факторов, включая тепло, излучение, органические растворители, кислоты, основания и соли, поскольку они могут изменять гидрофобные взаимодействия внутри белка, влиять на водородные связи и мешать ионным взаимодействиям.
Тип I: денатурация по изменению рН
РН решение оказывает важное влияние на структуру белка, потому что он изменяет количество и характер водородных связей и ионных взаимодействий, которые имеют место между различными аминокислотами. При физиологическом pH многие аминокислотные боковые цепи заряжаются из-за потери или усиления иона водорода.
На самом деле, большинство аминокислот существуют в виде цвиттериона внутри клеток.
Когда атом водорода ковалентно связан с сильно электроотрицательным атомом, таким как кислород или азот, он получает частичный положительный заряд. Из-за небольшого размера атома водорода этот частичный заряд достаточен для создания высокой плотности заряда, которая может оказывать сильное притяжение неподеленной пары электронов на другом атоме. Это притяжение лежит в основе водородной связи. Он чувствителен к изменениям рН, потому что изменение концентрации ионов водорода может изменить природу функциональных групп. Например, аминокислоты, такие как аспарагин, цистеин или тирозин, содержат полярные группы в своих боковых цепях. Эти атомы могут взаимодействовать друг с другом посредством водородных связей на основе их пространственной близости и ориентации различных боковых цепей. Однако при изменении pH эти полярные группы могут протонироваться или депротонироваться, изменяя их способность образовывать водородные связи. Кроме того, образование альфа-спирали или бета-плиссированного листа включает образование водородных связей между карбоксилатными и аминными группами каждой аминокислоты. Если большое количество таких взаимодействий прерывается, белок разворачивается и становится денатурированным.
Наконец, pH влияет на общий заряд полипептида, и это влияет на растворимость белка. Если суммарный заряд белка становится равным нулю, он может накапливаться и выпадать в осадок.
Тип II: Химическая денатурация
Некоторые химические вещества и органические растворители могут вызывать денатурацию белка. Органические растворители разрушают структуру белка, потому что большинство белков изолируют свои гидрофобные остатки по направлению к центру молекулы, когда они складываются в свою уникальную форму. По существу, трехмерная структура полипептида оптимизирует энергию молекулы, снижая взаимодействие гидрофобных боковых цепей с водной средой. Присутствие химических веществ, таких как бензол или этанол, изменяет эти взаимодействия и может иногда приводить к «переворачиванию» белка, когда внутренние остатки присутствуют снаружи с потерей структуры и функции.
Моющие средства и другие амфипатический молекулы также могут быть особенно разрушительными. Эти молекулы имеют тот же эффект, разрушая гидрофобные взаимодействия и водородные связи. Вспенивание, наблюдаемое во время экстракции белка в лабораториях, а также пена, связанная с бытовыми моющими средствами, частично объясняется их денатурирующим действием на белки. Тяжелые металлы и высокие концентрации соли могут влиять на образование ионных связей, в то время как хаотропные агенты, такие как мочевина, могут оказывать значительное разрушительное воздействие на сеть водородных связей.
Тип III: денатурация теплом и радиацией
Когда температура биологического образца увеличивается, это приводит к общему увеличению кинетической энергии каждого атома и увеличению энтропии системы. Все атомы и молекулы начинают сталкиваться друг с другом с более высокой энергией, а также с увеличением поступательного, вращательного и вибрационного движения. Это снижает прочность водородных связей и ослабляет влияние неполярных гидрофобных взаимодействий. Это одна из причин, по которой организм использует высокую температуру для борьбы с инфекциями. Это попытка замедлить или остановить рост микроорганизмов, чтобы иммунная система могла очистить болезнетворные микроорганизмы. Тем не менее, длительная высокая температура может также нанести вред белкам внутри хозяина, поэтому температуры выше 104 градусов по Фаренгейту (40 градусов Цельсия) считаются опасными. Длительное воздействие солнечного излучения также приводит к потере структуры белка. Солнечные ожоги и катаракта в глазу – только два примера его вредных эффектов. Излучение от других источников (таких как рентгеновский аппарат или от радиоактивных материалов) также может вызвать повреждение белков и привести к ряду заболеваний.
Функции денатурации
Кроме того, денатурация также участвует в изменениях в трехмерной структуре нуклеиновых кислот. Когда две нити ДНК раскручиваются, говорят, что они подвергаются денатурации. Этот тип денатурации важен для транскрипция и репликация ДНК. Он также используется в лабораторных методах, таких как полимеразная цепная реакция, для получения большого количества копий ДНК за короткий промежуток времени.
Эффекты денатурации
Денатурация приводит к потере функции белка. В ферменте на основе белка это может быть небольшое изменение в конформации активный сайт что делает его неспособным катализировать реакцию. Для белков, подобных антителам, потеря формы лишает их способности распознавать и связывать антигены. Когда большое количество белков в клетке денатурируется, клетка подвергается серьезному стрессу при удалении этих молекул и синтезе функционального белка. Когда этот процесс переполняет клетку, она либо подвергается апоптоз или вызывает болезнь. В связи с влиянием денатурации белка на формирование заболевания было интересно проанализировать, возможно ли побудить белок переродиться в свою первоначальную форму после денатурации. До сих пор исследованиям in vitro удалось добиться такого изменения только в нескольких белках, таких как сывороточный альбумин, РНКаза и гемоглобин.
викторина
1. Какие из этих связей НЕ обычно участвуют в создании вторичной или третичной структуры белка?A. Водородные связиB. Ковалентные связиC. Ионные взаимодействияD. Ни один из вышеперечисленных
Ответ на вопрос № 1
В верно. Ковалентные связи обычно не участвуют в создании вторичной или третичной структуры белка. Хотя ковалентные связи важны для формирования линейных полимеров аминокислот, они не имеют первостепенного значения в структурах более высокого порядка. Дисульфидные мостики являются исключениями из этого правила. Тем не менее, в восстановительной среде, такой как цитозоль Дисульфидные мостики встречаются не часто.
2. Почему изменение рН приводит к денатурации белка?A. Изменяет первичную аминокислотную последовательностьB. Изменяет электроотрицательность атомаC. Изменяет образование водородной связи между различными остаткамиD. Все вышеперечисленное
Ответ на вопрос № 2
С верно. Изменения pH напрямую не влияют на ковалентные связи. Следовательно, они не изменяют первичную аминокислотную последовательность. Электроотрицательность атома не изменяется и не зависит от рН.
3. Какой из этих белков был успешно перенесен?A. ГемоглобинB. РНКазыC. Сывороточный альбуминD. Все вышеперечисленное
Ответ на вопрос № 3
D верно. Сообщалось, что все три белка проходят успешную ренатурацию in vitro с возвращением функции и трехмерной структуры.
Что такое денатурация биология
Этот вопрос регулярно поднимается на множестве популярных ресурсов, посвященных бодибилдингу. Ряд источников приписывают неденатурированному белку противораковую, иммуномодулирующую, антиоксидантную активность, улучшение показателей уровня сахара в крови и позитивное влияние на синтез белка в мышцах спортсмена [1,2,3], и конечно же, по всем этим показателям «обычный» денатурированный протеин показан в худшем свете. Неудивительно, что подобная информация активно обсуждается на форумах [4,5], а производители выпускают специальные серии протеина с соответствующей пометкой на упаковке [6].
Насколько обоснованы такие заявления? Давайте разбираться.
Белок и его структура
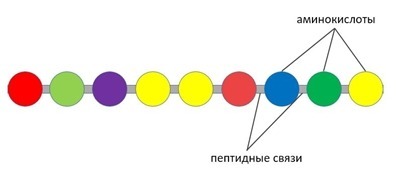
Белок, он же протеин, он же полипептид – это цепочка из аминокислот, которые соединены между собой пептидными связями [7]. Это так называемая первичная структура белка.
Рис. 1 Первичная структура белка
Аполипопротеин С1, участвующий в обмене холестерина, состоит из 57 аминокислот [8], а вот титин, один из важных белков мышц человека, имеет длину около 35 000 аминокислот [9].
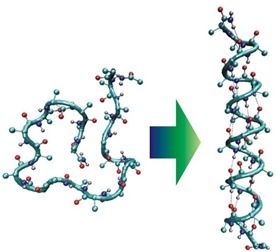
Следующем уровнем организации белковой молекулы является вторичная структура, которая стабилизирована другим типом связей – водородными [7]. В рамках вторичной структуры рассматриваются связи между близлежащими аминокислотами.
Рис. 2 Переход от первичной к вторичной структуре белка [10]
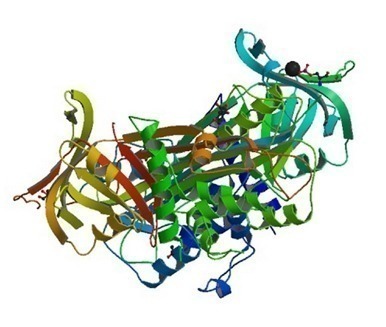
Когда же необходимо рассмотреть способ укладки всей белковой молекулы, в том числе и связи между относительно удаленными аминокислотами, то речь идет о третичной структуре. В поддержании такой структуры задействовано несколько видов химических связей – гидрофобные, водородные, электростатические и т.д. [11].
Рис. 3 Третичная структура белка. Овальбумин, один из белков куриного яйца [12]
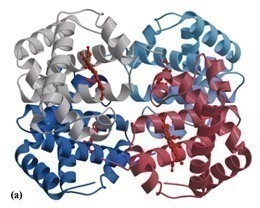
Некоторые протеины представляют собой комплекс из нескольких белковых цепей (в данном случае именуемых субъединицами), которые объединены вместе и в таком виде выполняют свои функции. Для описания таких комплексов используется понятие «четвертичная структура белка». Примером такого комплекса является гемоглобин, который переносит кислород в крови и состоит из 4 субъединиц 2 типов, по 2 субъединицы каждого типа.
Рис. 4 Четвертичная структура гемоглобина. 4 субъединицы выделены разными цветами [7]
Протеины становятся функциональными только после завершения формирования трехмерной структуры, когда все необходимые химические связи будут установлены и белок приобретет свой характерный вид.
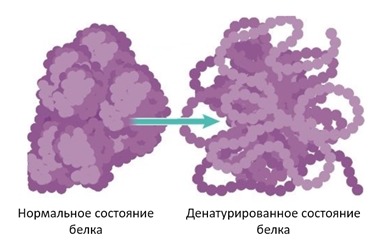
Денатурация белка
В строгом биохимическом смысле денатурацией называют потерю белком своих функциональных свойств по причине нарушения трехмерной структуры. Денатурация не обязательно означает полное развертывание до цепочки и принятие неупорядоченной структуры, существует множество промежуточных состояний. Иногда критично нарушение буквально нескольких связей.
Рис. 5 Денатурация белка [14 с изменениями]
Однако важно заметить, что при денатурации не меняется первичная структура белка, то есть пептидные связи остаются целыми и сам белок не расщепляется на фрагменты. Сохраняется длина молекулы, аминокислотный состав и т.д.
Денатурация может произойти под воздействием высоких температур, кислот, щелочей и т.д. [7]. Классическим примером денатурации является изменение внешнего вида белковой части куриного яйца после варки, и очевидно, что такая денатурация в домашних условиях необратима [13].
Однако в ряде случаев восстановление трехмерной структуры протеина все же возможно, и этот процесс называется ренатурацией. Свойство ренатурации используется в многих лабораторных методиках работы с белками.
Если же первичная структура белка все же нарушена, то произошла так называемая деструкция [15].
Таким образом, денатурация означает лишь изменение укладки белковой молекулы в пространстве.
Белки и пищеварение
Ок, спортсмен выпил протеиновый коктейль или съел кусок мяса. Теперь рассмотрим что происходит с белками из подобных продуктов в желудочно-кишечном тракте. Поступление пищи в желудок стимулирует секрецию гормона гастрина, который, в свою очередь, усиливает секрецию соляной кислоты (HCl) и пепсиногена – предшественника фермента пепсина, который и будет расщеплять белки из пищи [7]. Как видим, в желудке образовалась кислая среда (pH 1.0-2.5, такие значения соответствуют очень высокой кислотности), а именно такая среда является фактором, способствующим денатурации белковой молекулы.
Существуют ли белки, способные выстоять под таким кислотным воздействием? Да, существуют. К примеру, это некоторые белки клеток самого желудка [16]. Однако лактальбумин, казеин, овальбумин и другие распространенные белки из продуктов питания к кислотоустойчивым не относятся и их ждет денатурация. Собственно, после денатурации пептидные связи, спрятанные прежде в глубинах трехмерной структуры, становятся доступны для атаки различными ферментами, которые и будут эти связи разрушать. Среди таких ферментов уже упомянутый пепсин из желудочного сока. После такой обработки пища поступает в тонкий кишечник, где расщепление осуществляют уже другие ферменты – трипсин, химотрипсин, карбоксипептидазы, аминопептидазы. Разница между этими ферментами состоит в комбинациях аминокислот, связи между которыми данные ферменты разрушают.
Здесь же, в тонком кишечнике, идет всасывание продуктов пищеварения. Это одиночные аминокислоты или короткие пептиды (обычно длиной 2-4 аминокислоты) [17,18,7].
Как видим, всасывания целостной большой белковой молекулы, которая могла бы выполнять иммуномодулирующие и другие упомянутые в начале статьи функции, не происходит – белок расщепляется на короткие фрагменты.
Некоторые белки, к примеру, кератин (один из белков волос и ногтей) все же перевариваются не полностью [7], проходят по кишечнику далее и покидают организм. Какого-то особого их всасывания тоже нет.
Однако некоторая разница между пищеварением денатурированного и неденатурированного белка есть. Так, на лабораторных животных было показано [19], что переваривание сырого мяса, по сравнению с термически обработанным, занимало больше времени и требовало больше ресурсов организма. Объясняется это различие как раз денатурацией белка под воздействием высокой температуры, к примеру, во время варки.
Протеины из линеек спортивного питания, такие как казеин, сывороточный, яичный протеин и другие, быстрее усваиваются организмом человека после обработки путем гидролиза [20, 21, 22]. Гидролиз включает в себя и денатурацию, и деструкцию, то есть расщепление белка на более короткие фрагменты, но деструкция уже выходит за рамки данной статьи.
Таким образом, существует зависимость между степенью обработки белка и скоростью его усвоения [23]. Неденатурированный белок будет перевариваться дольше. Однако добиться постепенного всасывания аминокислот и коротких пептидов можно гораздо проще – подобрав соответствующий тип спортивного питания. Так, сывороточный протеин абсорбируется относительно быстро, а казеин – медленно [24]. При этом организму не придется тратить энергию на дополнительную обработку пищевого продукта. Эти же ресурсы можно направить на более важные цели – построение мышц спортсмена.
Какие-либо обоснованные преимущества неденатурированного протеина для бодибилдера в современной научной литературе не упоминаются.
Вместе с тем, денатурация протеинов происходит в рамках технологических процессов производства спортивного питания [25, 26] и, как видим, приносит пользу для последующего усвоения спортсменом таких белков.
Заключение сравнения денатурированного и неденатурировванного белка
Подводя итоги, денатурация протеина увеличивает скорость его расщепления и экономит энергию организма. Исходя из этого, в бодибилдинге определенно выгоднее использовать денатурированный белок, входящий в состав привычных продуктов спортивного питания. Ассортимент таких товаров очень широк, а стоимость ниже, по сравнению с специфическими продуктами с неденатурированным белком.
Для размещения информации из данного обзора на своих ресурсах обязательно указать наш сайт proteininkiev.com в качестве источника.
Все права защищены PROTEININKIEV TM 2018.