Что такое дипольность воды
Неорганические вещества клетки. Вода, соли, их роль в жизнедеятельности клетки.
Большинство химических соединений, которые входят в состав клетки, встречаются только в живой природе. Почти все молекулы за небольшим исключением, встречающиеся в клетке, относятся к соединениям углерода и рассматриваются в курсе органической химии. Однако вода встречается и в живой, и в неживой природе. В среднем почти 70% от массы живых организмов составляет вода. Но содержание воды в клетке может колебаться в зависимости, например, от ее конкретного вида или возраста. Помимо воды в клетках в значительных количествах встречаются некоторые соли, которые важны для осуществления функций живых организмов.
Вода (H2O) представляет собой вещество, которое в физическом и химическом отношении существенно отличается от других растворителей. Жизнь возникла в первичном океане, и в процессе дальнейшего развития природа использовала уникальные свойства воды.
У воды в отличии от других жидкостей необычайно высокие температуры кипения и плавления и высокая удельная теплоемкость. Также отличительными особенностями воды являются большая удельная теплота испарения, плавления и высокое поверхностное натяжение. Вода имеет все эти свойства благодаря тому, что ее молекулы более прочно связаны друг с другом в отличии от молекул других растворителей.
Эти уникальные свойства воды оказывают большое влияние на жизнедеятельность клеток. Например, высокая теплоемкость воды, т.е. способность поглощать тепло при незначительном изменении своей собственной температуры, предохраняет клетки от резких изменений температуры. Высокую теплоту испарения воды живые организмы используют для предохранения от перегрева. Вспомним, что испарение жидкости животными и растениями — это защитная реакция на повышение температуры. Благодаря высокой теплопроводности воды обеспечивается равномерное распределение теплоты по всему организму, а благодаря тому, что вода плохо сжимается, клетки обладают упругостью и могут поддерживать свою форму.
Свои уникальные физические и химические свойства вода получила благодаря особенностям структуры своей молекулы, а точнее, благодаря тому, как именно в молекуле воды располагаются электроны в атомах кислорода и водорода. Два электрона, располагающиеся на внешней электронной орбите атома кислорода в молекуле воды, объединяются с двумя электронами, принадлежащими атомам водорода (у атома водорода на внешней орбите только один электрон). Благодаря этому в молекуле воды образуются две ковалентные связи (между атомом кислорода и двумя атомами водорода). Электроотрицательность * атома кислорода выше, чем у атомов водорода, благодаря чему, электроны притягиваются к нему сильнее. В результате этого на атоме кислорода появляется частично отрицательный заряд, а на атомах водорода — частично положительный. Между более отрицательно заряженными атомами кислорода одних молекул воды и более положительно заряженными атомами водорода других молекул воды образуются так называемые водородные связи, и молекулы воды оказываются связанными между собой.
* Электроотрицательность — это способность атома в молекуле смещать к себе общие электронные пары. Относится к фунадментальным свойствам атома и выражается в количественных характеристиках.
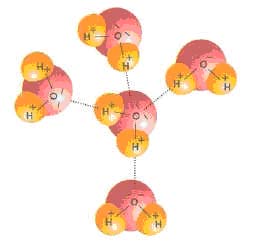
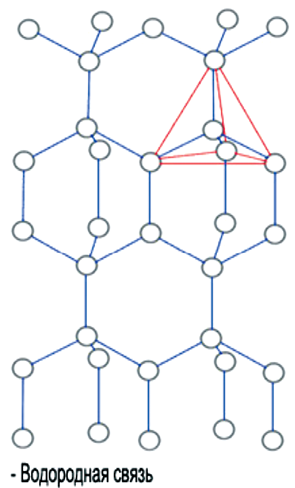
5 молекул воды с водородными связями между ними
На рисунке изображены молекулы воды. Ковалентные связи связывают атомы кислорода и водорода внутри каждой молекулы (сплошные линии), а водородные связи образуются между соседними молекулами (пунктирные линии).
Водородные связи примерно в 20 раз более слабые, чем ковалентные. Поэтому они легко образуются и разрываются. Даже при температуре кипения (100°С) взамодействие между молекулами воды остается достаточно сильным. Именно водородные связи обеспечивают структурированность воды и объясняют такие ее свойства, как высокие температуры кипения и плавления, а также высокую теплоемкость.
Другое важное свойство молекулы воды — ее дипольность. В молекуле воды, как отмечалось ранее, атомы кислорода имеют небольшой отрицательный заряд, а атомы водорода — положительный. Т.к. угол между связями H-O-H составляет 104.5°, получается, что отрицательный заряд в молекуле воды сосредотачивается на одной стороне, а положительный — на другой. Благодаря дипольности молекулы воды имеют способность к ориентации в электрическом поле. Это свойство объясняет, что вода является уникальным растворителем. Если в молекулах веществ присутствуют заряженные группы атомов, они, вступая в электростатическое взаимодействие с молекулами воды, растворяются в ней. Такие вещества с заряженными или полярными группами, растворяющиеся в воде, называются гидрофильными.
Растворение NaCl в воде.
Способность воды растворять кристалл NaCl зависит от электростатического притяжения между полярными молекулами воды и заряженными ионами натрия и хлора.
К гидрофильным соединениям, которые в большом количестве есть в клетках, относятся соли, некоторые низкомолекулярные органические соединения (органические кислоты, аминокислоты, простые сахара), а также полимеры: некоторые полисахариды, белки, нуклеиновые кислоты. Однако существует ряд веществ, почти не имеющих заряженных атомов, и, поэтому, не растворяющихся в воде. Такие вещества называются гидрофобными. К ним, например, относятся липиды (жиры). Гидрофобные вещества не взаимодействуют с водой, но могут взаимодействовать друг с другом. Поэтому они хорошо растворяются в некоторых органических растворителях, как, например, хлороформ. Липиды, относящиеся к гидрофобным соединениям, формируют двумерные структуры (биологические мембраны), практически непроницаемые для воды.
По сравнению с другими растворителями вода может растворить больше химических веществ, благодаря своей полярности. Жизнедеятельность клетки невозможна без многочисленных химических реакций, которые осуществляются в ее водной среде, где растворены различные химические вещества. Также вода растворяет и продукты реакций. Затем в растворенном виде они выводятся из клеток и многоклеточных организмов. За счет перемещения воды в организмах животных и растений осуществляется обмен различными веществами между тканями. Еще одним важным свойством воды является то, что, как химическое соединение, вода вступает во многие химические реакции, которые протекают в клетке. Такие реакции называют реакциями гидролиза. В свою очередь, молекулы воды сами образуются в результате многих реакций в клетках живых организмов.
Т.к. масса атома водорода мала, а атом кислорода в молекуле воды удерживает его единственный электрон, протон (ядро атома водорода, лишенное электрона) способен отрываться от молекулы воды. В результате этого из молекулы воды образуются гидроксильный ион (ОН — ) и протон (Н + ).
H2O H + + OH —
Данный процесс называют диссоциацией воды. Гидроксильные ионы и протоны, которые образуются при диссоциации воды, являются, в свою очередь, участниками многих важных реакций в живых организмах.
Необходимо отметить, что анионы слабых кислот вступают в химические реакции, происходящие в клетке. Например, для синтеза АТФ, одного из важных соединений для клетки, необходимы анионы фосфорной кислоты. О синтезе АТФ я расскажу более подробно позднее. Неорганические вещества в живых организмах содержатся не только в растворенном, но и в твердом состоянии. В качестве примера можно привести кости, где преобладает фосфат кальция и в меньшем количестве фосфат магния. В раковинах моллюсков преобладает карбонат кальция.
Что такое дипольность воды
Из-за блокировщика рекламы некоторые функции на сайте могут работать некорректно! Пожалуйста, отключите блокировщик рекламы на этом сайте.
Свойства воды и ее роль в клетке:
На первом месте среди веществ клетки стоит вода. Она составляет около 80% массы клетки. Вода важна для живых организмов вдвойне, ибо она необходима не только как компонент клеток, но для многих и как среда обитания.
2. Многие химические процессы протекают только в водном растворе.
4. Вода обладает высокой теплоемкостью и теплопроводностью.
5. Вода обладает уникальным свойством: при охлаждении ее от +4 до 0 градусов, она расширяется. Поэтому лед оказывается легче жидкой воды и остается на ее поверхности. Это очень важно для организмов, обитающих в водной среде.
6. Вода может быть хорошим смазочным материалом.
Биологическая роль воды определяется малыми размерами ее молекул, их полярностью и способностью соединяться друг с другом водородными связями.
Биологические функции воды:
транспортная. Вода обеспечивает передвижение веществ в клетке и организме, поглощение веществ и выведение продуктов метаболизма. В природе вода переносит продукты жизнедеятельности в почвы и к водоемам.
метаболическая. Вода является средой для всех биохимических реакций, донором электронов при фотосинтезе; она необходима для гидролиза макромолекул до их мономеров.
вода участвует в образовании смазывающих жидкостей и слизей, секретов и соков в организме.
За очень немногими исключениями (кость и эмаль зуба), вода является преобладающим компонентом клетки. Вода необходима для метаболизма (обмена) клетки, так как физиологические процессы происходят исключительно в водной среде. Молекулы воды участвуют во многих ферментативных реакциях клетки. Например, расщепление белков, углеводов и других веществ происходит в результате катализируемого ферментами взаимодействия их с водой. Такие реакции называются реакциями гидролиза.
Вода служит источником ионов водорода при фотосинтезе. Вода в клетке находится в двух формах: свободной и связанной. Свободная вода составляет 95% всей воды в клетке и используется главным образом как растворитель и как дисперсионная среда коллоидной системы протоплазмы. Связанная вода, на долю которой приходится всего 4% всей воды клетки, непрочно соединена с белками водородными связями.
Из-за асимметричного распределения зарядов молекула воды действует как диполь и потому может быть связана как положительно, так и отрицательно заряженными группами белка. Дипольным свойством молекулы воды объясняется способность ее ориентироваться в электрическом поле, присоединяться к различным молекулам и участкам молекул, несущим заряд. В результате этого образуются гидраты
Благодаря своей высокой теплоемкости вода поглощает тепло и тем самым предотвращает резкие колебания температуры в клетке. Содержание воды в организме зависит от его возраста и метаболической активности. Оно наиболее высоко в эмбрионе (90% ) и с возрастом постепенно уменьшается. Содержание воды в различных тканях варьируется в зависимости от их метаболической активности. Например, в сером веществе мозга воды до 80%, а в костях до 20%. Вода — основное средство перемещения веществ в организме (ток крови, лимфы, восходящие и нисходящие токи растворов по сосудам у растений) и в клетке. Вода служит «смазочным» материалом, необходимым везде, где есть трущиеся поверхности (например, в суставах). Вода имеет максимальную плотность при 4°С. Поэтому лед, обладающий меньшей плотностью, легче воды и плавает на ее поверхности, что защищает водоем от промерзания. Это свойство воды спасает жизнь многим водным организмам.
Структура молекул воды и их ассоциатов
Вода начинается с молекулы
Итак, молекула воды ( 1 H2 16 O) состоит из двух атомов водорода ( 1 H) и одного атома кислорода ( 16 O). Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
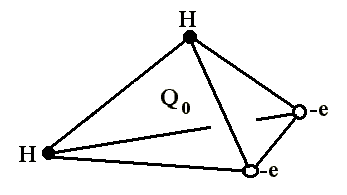
В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его – сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, – по одному ядру водорода. Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.5.
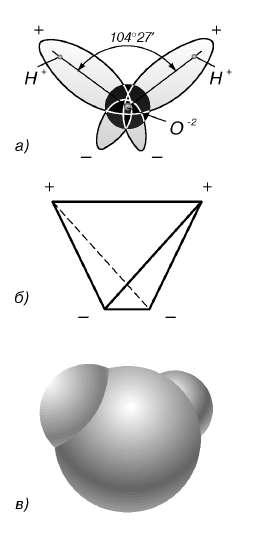
Рис. 1.5. Строение молекулы воды
а – угол между связями O-H;
б – расположение полюсов заряда;
в – внешний вид электронного облака молекулы воды.
Электронное строение молекулы воды
Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода (рис. 1.5б).
Общий вид электронного облака молекулы воды показан на рис. 1.5в.
Вода растворяет все!
Во многом благодаря диэлектрической проницаемости, вода проявляет себя как универсальный растворитель. Ее растворяющему действию в той или иной мере подвластны и твердые тела, и жидкости, и газы.
Постоянно соприкасаясь со всевозможными веществами, вода фактически всегда представляет собой раствор различного, зачастую очень сложного состава.
Даже из свежевыпавшей дождевой воды можно выделить различные минеральные и органические вещества, растворенные в ней (до нескольких десятков миллиграммов на литр).
Минеральный состав воды
В пресных природных водах – речных, озерных – содержание растворенных веществ обычно не превышает 1 г/л. От нескольких единиц до десятков граммов на литр колеблется содержание солей в морской воде: например, в Балтийском море их не более 5 г/л, в Черном – 18, а в Красном море – около 40 г/л. В среднем в 1 л океанской воды растворено 34. 35 г солей. Общее количество их настолько велико, что, выделенные из воды, они покрыли бы поверхность земного шара слоем стометровой толщины.
Солевой состав речных и морских вод различен не только количественно, но и качественно. На 89% морские соли состоят из хлоридов (преимущественно – натрия и кальция), на 10% – из сульфатов (натрия, калия и магния), на 1% – из карбонатов (натрия и кальция), а также незначительных количеств других солей. В пресных водах набор минеральных примесей выглядит иначе. Больше всего здесь карбонатов (натрия и кальция) – до 80%. Сульфатов (натрия, кальция и магния) – около 13%. Остальные 7% приходятся на хлориды (натрия и кальция) и другие соли.
Из газов в пресных и морских водах наиболее широко представлены кислород, азот, углекислый газ, сероводород. В чистых холодных истоках горных рек содержание кислорода может достигать 6 мг/л. В глубинных слоях Черного моря высока концентрация сероводорода – до 100 мг/л. Этот ядовитый газ присутствует и в нижних слоях некоторых озер.
В пресных и морских водах в небольших количествах имеются и разнообразные органические компоненты – растворимые соединения типа белков, сахаров, спиртов, углеводородов и т.п. Это продукты жизнедеятельности и распада животных и растительных организмов, населяющих водоемы и их берега, а также отходы промышленности и сельского хозяйства.
Формирование кластеров воды
Полярность молекул воды, наличие в них частично нескомпенсированных электрических зарядов порождает склонность к группировке молекул в укрупненные «сообщества» – ассоциаты. Оказывается, полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии. Это показали результаты определения молекулярной массы водяного пара. В температурном интервале от 0 до 100°С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1%. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой (H2O)x
Непосредственной причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды. Правда, эти связи в десятки раз слабее, чем «стандартные» внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их. Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
Поскольку электронные орбитали в каждой молекуле воды образуют тетраэдричес-кую структуру, водородные связи могут упорядочить расположение молекул воды в виде тетраэдрических координированных ассоциатов
Исследователи раскрывают все более тонкие и сложные механизмы «внутренней организации» водной массы. Кроме льдоподобной структуры, жидкой воды и мономерных молекул, описан и третий элемент структуры – нететраэдрической.
Определенная часть молекул воды ассоциирована не в трехмерные каркасы, а в линейные кольцевые объединения. Кольца, группируясь, образуют еще более сложные комплексы ассоциатов.
Изучение структуры жидкой воды еще не закончено; оно дает все новые факты, углубляя и усложняя наши представления об окружающем мире. Развитие этих представлений помогает нам понять многие аномальные свойства воды и особенности взаимодействия ее, как растворителя, с другими веществами.
Молекулярно-поверхностные свойства воды,



Чтобы детально разобраться с процессами физико-химического взаимодействия дисперсных систем и дисперсной среды рассмотрим более подробно структуры воды.
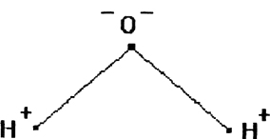
Молекула воды, как известно, представлена двумя одновалентными ионами водорода и одним двухвалентным ионом кислорода. Молекула воды не является энергетически нейтральной. Это объясняется тем, что атомы водорода примыкают к кислороду с одной и той же стороны, что и вызывает возникновение электрического момента. По другим данным ионы водорода и кислорода в молекуле воды расположены в вершинах равнобедренного треугольника, причем угол у вершины треугольника, занятый ионом кислорода равен 105°.
Дипольность молекул воды обуславливает их способность вступать друг с другом в связь, притягиваясь полюсами противоположного знака. Это приводит к тому, что структура воды имеет как бы рыхлое строение. Ее истинный объем превышает расчетные значения.
Объяснить отсутствие электронейтральности молекулы воды можно и следующим образом. Атом водорода, имеющий одну стабильную орбиту, способен образовывать лишь одну ковалентную связь. Однако, несмотря на это оказывается, что в некоторых случаях атом водорода может принять к себе и тем самым связать между собой два атома. В этом случае возникает уже ионная связь, т.е. связь, в основе которой лежит кулоновское притяжение между разноименно заряженными телами. Такая водородная связь более вероятна чем более электроотрицательные атомы, соединяемые водородом. Ион кислорода имеет высокий отрицательный заряд и поэтому он легко образует водородные связи с ионами водорода. Вследствие этого же молекулы воды могут легко ассоциироваться между собой в комплексы. При этом структура воды изменяется. Ее изменение возможно и у поверхности твердой фазы.
Наличие электрического поля у молекулы воды обуславливает и чрезвычайную ее растворяющую способность, т.к. силы взаимодействия между заряженными частицами в воде уменьшаются в 81 раз. В результате этого прочность внутри молекулярной связи становится недостаточной и частички под действием броуновского движения переходят в раствор.
В настоящее время структура твердых тел в основном довольно таки детально изучена. В ее основу положены модели типа жестких шариков, шариков с притяжением и упругих шариков. Как следствие этого существуют количественные теории жидкостей типа идеальных газов, частично жидких металлов и некоторых молекулярных жидкостей. Для ассоциированных жидкостей с водородными связями удовлетворительной теории в настоящее время нет.
В литературе структура электронного облака в основном описывается тетраэдрической моделью, с атомом кислорода в центре и атомами водорода в двух вершинах и двумя отрицательными зарядами, символизирующими уединенные электронные пары в двух других вершинах тетраэдра.
Поэтому молекула воды может участвовать в четырех водородных связях: в двух за счет протонов и в двух за счет неподеленных пар атома кислорода. Особенности поведения воды обусловлены и ориентацией ядерных спинов двух протонов. Наиболее распространены следующие структурные модели воды: кластерная, клатратная и континуальная (непрерывная).
В кластерной модели (Ж. Немети, Н. Шерега) модель воды представлена в виде кластеров, т.е. в определенной зоне молекул связаны между собой в другой связи нет. При этом имеется возможность распада кластеров, появленье новых.
Клатратная модель (Самойлов С. Я.) предусматривает образование сетки водородных связей между молекулами воды, внутри которой имеются пустоты, заполняемые мономерными молекулами (не имеющими водородных связей).
Континуальная модель (И. Попл) предусматривает отсутствие молекул воды с разорванными водородными связями, образующими кольцевые ассоциаты.
Сложная структура воды обуславливает и ее специфические свойства, а также их зависимости от температуры.
Вот некоторые из них:
Величина угла смачивания зависит от многих факторов. Особенно большое влияние на нее оказывает процессы адсорбции. Например, обработкой ПАВ можно значительно увеличить смачиваемость и наоборот уменьшить.
Научная электронная библиотека
Шишелова Т И, Корзун Н Л, Толстой М Ю,
1.1. Физические свойства воды
Физические свойства в полной мере изложены во многих работах. Вода (Н2O) – простейшее устойчивое химическое соединение водорода с кислородом, бесцветная жидкость с температурой кипения 100 °С. Химическая формула воды такая простая: Н2О; Н–О–Н [1–8]. Размер одной молекулы воды составляет около 3 Å (ангстрем) или примерно 0,28 нм (нанометра).
Рис. 1. Схема строения
молекулы воды
Рис. 2. Тетраэдрическая структура молекулы воды
Вода состоит из одного относительно большого атома кислорода и двух небольших атомов водорода, вокруг которого вращается облачко общих отрицательно заряженных электронов (рис. 1). Угол H–O–H молекулы H2O в газообразном и жидком виде колеблется от 104,5 до 109°
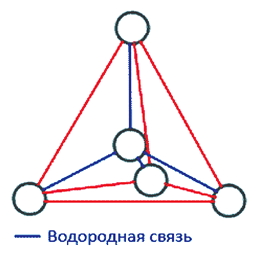
Во льду все молекулы связаны между собой водородными связями. При этом четыре связи каждой молекулы локально организованы в тетраэдрическую структуру, четыре близлежащие молекулы располагаются в вершинах трехгранной пирамиды, в центре которой находится пятая молекула
воды (рис. 2).
Положительно заряженное ядро атома кислорода, ввиду своей большой массы и заряда, сильнее притягивает к себе электронное облачко, оголяя при этом ядра водорода.
Три ядра в молекуле воды образуют равнобедренный треугольник с двумя протонами водорода в основании и кислородом в вершине. Расстояние O–H 0,9568 Å (0,1 нм); H–H – 1,54 Å (0,15 нм). Модель молекулы воды, предложенная Нильсом Бором [9], показана на рис. 3.
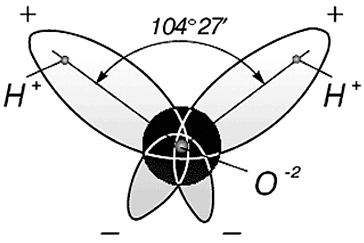
Рис. 3. Строение молекулы воды, предложенное Н. Бором [9]:
а – угол между связями H–H;
б – внешний вид электронного облака молекулы воды
Свойства воды в основном зависят от водородных связей. Из-за большой разности электроотрицательности атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а также того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому каждый атом кислорода притягивается к атомам водорода других молекул и наоборот.
Каждая молекула воды может участвовать максимум в четырех водородных связях: два атома водорода – каждый в одной, а атом кислорода – в двух; в таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвется, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность ее растет, но при температуре выше 4 °С этот эффект становится слабее. При испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная
теплота плавления и кипения и высокая теплоемкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями. Строение электронного облака молекулы воды таково, что во льду каждая молекула связана четырьмя водородными связями с ближайшими к ней молекулами, координационное число молекул в структуре льда равно четырем. О размере молекулы можно судить по величине расстояния между ближайшими молекулами во льду, составляющего 2,67 Å (0,267 нм). Соответственно молекуле воды можно приписать радиус равный 1,38 Å (0,138 нм). Дипольный момент воды равен 1,87 Дебая. Электрический дипольный момент – векторная физическая величина, характеризующая, наряду с суммарным зарядом электрические свойства системы заряженных частиц (распределения зарядов) в смысле создаваемого ею поля и действия на нее внешних полей.
Исследования показали, что в воде сохраняется ближняя упорядоченность, свойственная структуре льда. Следовательно, тенденция каждой молекулы воды к окружению четырьмя ближайшими молекулами и к образованию с ними водородных связей свойственна как жидкому, так и твердому состоянию. Расстояние между ближайшими молекулами при плавлении льда изменяется от 2,76 Å (0,276 нм) до 2,90 Å (0,29 нм). Свойственное среднее расположение ближайших молекул ведет к очень рыхлой, ажурной структуре. Именно с этим связаны аномальные свойства воды.
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула является миниатюрным диполем с высоким дипольным моментом.
Полярность молекул, наличие в них частично некомпенсированных электрических зарядов создает группировки молекул – ассоциаты. Полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии. В температурном интервале от 0 до 100 °С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1 %. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой
[Н2O]Х. Причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды.
Неравномерное распределение электрических зарядов приводит к тому, что молекула воды поляризуется, становится маленьким магнитиком.
В магнитном поле Земли молекулы воды, находящейся в жидком состоянии, собираются в некие нестабильные конструкции под действием притяжения разноименно заряженных полюсов. Нестабильность таких конструкций определяется слабостью водородных связей между молекулами воды, называемых иногда водородными мостиками.
Тетраэдрическая форма отдельной молекулы повторяется в кристаллической структуре льда. Возможно, определенную роль здесь играет то, что угол H–O–H молекулы H2O почти равен идеальному тетраэдрическому углу 109°, а молекулы воды, как мы знаем, объединяются с помощью водородных связей, которые они образуют именно в направлении O–H. Эти трехгранные пирамиды могут также объединяться в некую сверхструктуру. Во льду такая сложная трехмерная сверхструктура из тетраэдров простирается на весь объем (рис. 4).
Рис. 4. Структура Н2О льда
Льдообразная молекула воды содержит как простые молекулы воды, так и кластера льдообразных структур (рис. 5).