Что такое диспанкреатизм у детей
Что такое диспанкреатизм
Поджелудочная железа является одним из наиболее важных органов в организме человека. Она вырабатывает гормоны, которые берут активное участие в обменных процессах, а также панкреатический сок, необходимый для полноценного переваривания пищи.
Однако могут возникать такие ситуации, при которых орган начинает плохо функционировать, что приводит к диспанкреатизму. Но что это такое? Диспанкреатизм – это общее понятие синдромов, при которых наблюдается функциональное расстройство органа, при этом морфологические изменения не наблюдаются.
Также его называют вторичным реактивным панкреатитом, потому что он появляется в ответ на воспаление в соседних органах. Вызвать нарушение может целый ряд всевозможных факторов, среди которых можно отметить инфекционные процессы, интоксикация, пищеварительные расстройства, а также гормональные и сосудистые сбои.
Радует тот факт, что специалисты называют патологические изменения временным явлением. Но почему возникает диспанкреатизм? Как он проявляется? Как от него избавиться? На эти и многие другие вопросы дадим ответы в этой статье.
Причины появления
Наиболее значимыми причинами развития вторичного реактивного панкреатита являются следующие факторы:
Стоит понимать, что наличие одного или даже одновременно нескольких этиологических факторов необязательно приведет к развитию диспанкреатизма. Все продолжительное воздействие этих факторов значительно повышает риск возникновения недуга. При отсутствии должного лечения диспанкреатизм может с легкостью трансформироваться в панкреатит, поэтому оставлять его без внимания не стоит.
Симптомы
Для процесса характерно острое воспаление и стремительное развитие. Избавиться от недуга возможно только лишь при условии лечения того органа, дисфункция которого и привела к возникновению диспанкреатизма. Орган не может полностью выполнять свои функции, что приводит недостаточному выделению панкреатических ферментов и нарушению обменных процессов. В итоге белки, жиры и углеводы не всасываются в достаточной степени.
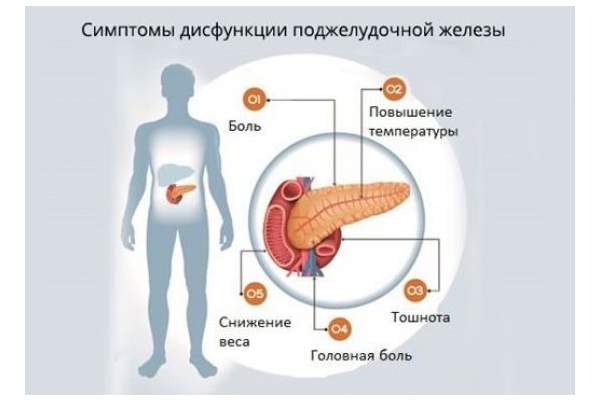
Клинические симптомы при диспанкреатизме связаны непосредственно с воспалением поджелудочной железы, а также с признаками заболевания, которое провоцирует появление недуга. Характерным признаком заболевания является болевой синдром. Неприятные ощущения локализуются в области левого подреберья и верхней части живота.
Со временем возникает тупая боль в левой половине туловища. У детей приступы настолько сильные, что напоминают клинику острого аппендицита. Также наблюдается изменение стула. Каловые массы становятся кашицеобразными или даже жидкими. Клиническая симптоматика на этом не ограничивается. У больных появляется тошнота, отрыжка, рвота, изменение вкуса во рту.
Даже при одном лишь виде продуктов усиливается приступ мучительной тошноты. Симптомы общей интоксикации проявляются в виде слабости, вялости, сонливости, апатии, снижении работоспособности. Диспанкреатизм у детей проявляется в виде отсутствия аппетита, резкого похудения, тошноты, сильных болей. В кале присутствуют куски непереваренной пищи.
По мере прогрессирования патологического процесса клиническая картина значительно усугубляется:
Диагностика
Подтвердить диагноз бывает достаточно сложно. Больного сначала направляют на консультацию к терапевту, а затем гастроэнтерологу. Важным критерием, указывающим на наличие функционального нарушения данного типа, является отсутствие морфологических изменений поджелудочной железы.
При подозрении на диспанкреатизм врач может назначать такие исследования:
Лечение
Главной составляющей лечебной терапии при диспанкреатизме является диетическое питание. Коррекция рациона поможет значительно улучшить состояние.
Диета
В период лечения важно исключить потребление полуфабрикатов, консервантов, жирного, жареного, копченостей, маринадов, соусов. В первые несколько дней разрешено пить только воду. Затем в рацион вводится чай с сухариками, протертые каши. На четвертый день вводятся кисломолочные продукты. Далее разрешается обогатить рацион овощные супы.
Старайтесь употреблять пищу шесть раз в день по возможности в одно и то же время. Все блюда должны быть теплыми. В рационе должны обязательно быть каши, нежирное мясо и птица, рыба, молочные продукты. Важно ограничить потребление жиров, предпочтение лучше отдать белковой пище. Из кисломолочных продуктов разрешается нежирный творог и кефир.
Сметана используется в качестве заправки блюд. Цельное молоко обязательно разводится с водой. Овощи лучше употреблять в запеченном виде.
Это может быть морковь, тыква, кабачки, тыква, картофель, свекла, цветная капуста и брокколи. В период лечения исключаются сладости. В ограниченных количествах разрешается съесть варенье, мед и сахар.
Приветствуются вегетарианские супы. Лучше готовить их на овощных бульонах, а не мясных. Для детей можно приготовить кальцинированный творог. Для этого в аптеке следует приобрести кальций. Далее чайную ложку порошка заливают литром горячего молока. Молоко должно свернуться, после чего его откидывают на сито.
Медикаментозная помощь
Медикаментозная терапия включает в себя прием таких средств:
Во время острого приступа важно своевременно оказать первую помощь:
Последствия
Главной опасностью диспанкреатизма является то, что патологический процесс может протекать бессимптомно и проявляется в виде периодических приступов. Реактивный панкреатит может привести к таким осложнениям:
Итак, диспанкреатизм – это нарушение функций поджелудочной железы. Это не острая стадия панкреатита, но и не здоровое состояние органа. Прогноз благоприятный, при правильном подходе и устранении причины можно успешно избежать рецидивов. Улучшение состояние наступает после устранения основной причины. Основу лечения составляет диетическое питание, которое сочетают с медикаментозной терапией.
Современные аспекты диагностики и лечения панкреатической недостаточности у детей
П.Л.Щербаков, доктор медицинских наук, профессор НЦЗД РАМН, РГМУ, Москва
Последняя четверть ХХ века ознаменовалась прогрессом в детской гастроэнтерологии, что привело к значительным достижениям в диагностике, лечении и профилактике заболеваний органов пищеварения у детей.
Однако, несмотря на значительные успехи в этой области, хронические заболевания органов пищеварения являются наиболее частой патологией, встречающейся как у взрослых, так и у детей. Распространенность болезней пищеварительного тракта за последние 10 лет возросла с 90 до 160 на 1000. В структуре болезней детского населения преобладают хронические воспалительные заболевания верхних отделов органов пищеварения (эзофагиты, гастриты, дуодениты, язвенная болезнь двенадцатиперстной кишки). Результаты эпидемиологических исследований, проведенных в нашей стране, показали широкую распространенность этих заболеваний во всех регионах России, особенно в районах с высоким уровнем антропогенной загрязненности. В детском возрасте встречаются практически все заболевания, с которыми в дальнейшем сталкиваются гастроэнтерологи. Значимость этой патологии обусловлена не только ее широкой распространенностью, но и социально-экономическими аспектами: длительной потерей трудоспособности взрослых больных, высоким риском малигнизации при воспалительных заболеваниях желудочно-кишечного тракта. Именно поэтому выяснение причин увеличения частоты этих заболеваний, расшифровка патогенеза, совершенствование методов диагностики и разработка принципов рационального лечения являются одними из приоритетных научных задач гастроэнтерологии.
Одно из ведущих мест среди болезней органов пищеварения занимают поражения поджелудочной железы, отличающиеся многообразием и полиэтиологичностью. Но, несмотря на большое разнообразие причинных факторов, клиническая картина различных состояний, связанных с нарушением функционирования этого органа, во многом сходна.
Значительную часть больных с поражением поджелудочной железы составляют пожилые и престарелые лица, однако в последнее время поражения поджелудочной железы все чаще встречаются и у детей различного возраста.
Нарушение деятельности поджелудочной железы, не сопровождающееся, как правило, воспалительной реакцией, однако имеющее определенную клиническую симптоматику, получило название панкреатической недостаточности.
Различают первичную и вторичную панкреатическую недостаточность. Первичная панкреатическая недостаточность развивается вследствие воздействия так называемых немодифицируемых факторов, на которые человек (пациент или врач) воздействовать и влиять не может. К ним относятся такие заболевания, как кистозный фиброз поджелудочной железы, врожденное нарушение проходимости панкреатического протока, синдром Shwachman, изолированный дефицит липазы, изолированная недостаточность трипсина, наследственный рецидивирующий панкреатит.
В педиатрической практике чаще встречается вторичная, или относительная, недостаточность поджелудочной железы (ранее называемая панкреатопатией, диспанкреатизмом), провоцируют ее, как правило, прием необычной пищи, ее избыточное количество, или временные расстройства функционирования поджелудочной железы. Вторичная панкреатическая недостаточность может сопровождать различные воспалительные заболевания ВОПТ.
Клиническими проявлениями панкреатической недостаточности являются признаки нарушения деятельности поджелудочной железы – боль в животе, изменение аппетита (уменьшение или полное исчезновение), тошнота, урчание в животе, метеоризм и флатуленция, стеаторея. Интенсивность и выраженность этих признаков зависят от степени поражения поджелудочной железы.
Диагностировать нарушение деятельности поджелудочной железы и панкреатическую неодостаточность в частности невозможно только клиническими методами обследования. В арсенале гастроэнтеролога имеется целый ряд инструментальных методов, позволяющих оценить состояние поджелудочной железы.
В норме после введения стимуляторов секреция поджелудочной железы и активность ферментов увеличиваются в 2-3 раза, а при недостаточности функции поджелудочной железы остаются стабильным.
Ультразвуковое исследование. При УЗИ выявляются диффузное или локальное увеличение размеров железы, изменение эхоплотности паренхимы в виде гиперэхогенности, возможны чередование участков гипер- и гипоэхогенности, неровность контуров. Могут выявляться кистозные образования.
«Золотым стандартом» для инструментальной диагностики заболеваний поджелудочной железы является эндоскопическая ретроградная панкреатохолангиография. Однако эта методика имеет ряд противопоказаний, нередко она провоцирует обострение панкреатита и проводить ее следует только в условиях специализированных клиник.
Верификацию диагноза и достоверную оценку состояния поджелудочной железы можно проводить только по результатам специфических тестов и анализов, определяющих функциональные особенности деятельности поджелудочной железы и ее нарушения. Существует большое количество различных тестов определения состояния поджелудочной железы, наибольший клинический интерес из них представляют следующие.
Провокационные тесты
Данные тесты до сих пор не потеряли своей актуальности и вполне могут быть использованы в клинической практике при оценке состояния поджелудочной железы. Тесты проводятся с применением лекарственных препаратов, стимулирующих деятельность поджелудочной железы, секретина, панкреозимина, прозерина, глюкозы.
Тест с глюкозой (двойная нагрузка с глюкозой) заключается в регистрации уровня амилазы при введении глюкозы, стимулирующей вырабатывание панкреатического сока. Перед исследованием из рациона ребенка в течение 3—5 дней исключается пища, богатая жирами. В день исследования ребенок принимает натощак 10%-ный раствор глюкозы из расчета 1 г/кг массы тела, но не более 50 г на прием. Повторный прием такой же дозы раствора глюкозы назначают через час. Уровень амилазы проверяют натощак и через каждые 30 мин после нагрузки глюкозой в течение 2-3 ч.
При наличии воспалительных изменений в поджелудочной железе после первой или второй нагрузки глюкозой отмечается гиперамилаземия, при этом уровень амилазы постепенно снижается к концу исследования. Снижение уровня амилазы после нагрузок глюкозой свидетельствует об истощении функциональных возможностей поджелудочной железы.
Исследование внешнесекреторной функции поджелудочной железы непрямыми методами
Йодлиполовый тест. Принцип метода состоит в том, что при приеме внутрь йодлипол, состоящий из жирового вещества (липола) и йода, под действием панкреатической липазы превращается в свободный йод, выделяющийся с мочой. По концентрации йода в моче судят об активности панкреатической липазы. При недостаточности панкреатической липазы йод в моче не обнаруживается или регистрируется только в разведении 1:2.
При остром поражении поджелудочной железы уровень амилазы в сыворотке крови достигает максимума ориентировочно через 12 ч.
«Золотым стандартом» оценки состояния поджелудочной железы является Секретин-Панкреозиминовый тест (SPT). При этом определяется уровень бикарбонатов и ферментов после внутривенного введения секретина и панкреозимина, (прямая стимуляция поджелудочной железы). При нормально функционирующем органе уровень определяемых показателей составляет:
Сывороточный эластазный тест (SET) обладает чувствительностью 96% и специфичностью 96%. Особенно чувствителен этот тест для определения острого панкреатита («золотой стандарт») или обострения хронического панкреатита. При проведении исследования нормальный уровень эластазы I в сыворотке крови не превышает 3,5 ng/ml. При нарушении функции органа он выше 35 ng/ml. Этот тест может использоваться для диагностики острого панкреатита (даже через несколько дней после клинической манифестации приступа) после проведенной ретроградной панкреатохолангиографии (РПХГ) (даже при отсутствии клинических признаков панкреатита).
Нормальный уровень эластазы в кале не должен снижаться менее чем на 200 мкг/г. Уровень эластазы от 200 до 100 мгк/г оценивается как умеренная недостаточность поджелудочной железы. Если уровень эластазы I в кале снижается менее 100 мкг/г, значит, у больного выраженная панкреатическая недостаточность. Этот тест может использоваться для скрининга и мониторинга недостаточности поджелудочной железы у детей.
Таким образом, для успешной и своевременной диагностики заболеваний поджелудочной железы необходимо использовать комплекс исследований, включающий в себя наряду с тщательными клиническими наблюдениями за больным ребенком ряд функциональных и инструментальных методов, позволяющих наиболее полно изучить степень поражения поджелудочной железы в целях назначения адекватной комплексной терапии.
При недостаточности поджелудочной железы применяются различные лекарственные средства, содержащие ферменты. Традиционно для этого используется панкреатин – препарат, приготовленный из поджелудочной железы животных [3]. Однако в условиях интенсивного кислотообразования в желудке наступала его частичная инактивация и препарат не оказывал ожидаемого лечебного эффекта. В дальнейшем с развитием фармацевтической промышленности, знаний о механизме процессов пищеварения появились новые формы препаратов, содержащих панкреатин в виде таблеток, драже, гранул с защитной оболочкой и микросфер, помещенных в капсулу. В настоящее время ферментные препараты, используемые в клинической практике, должны отвечать определенным требованиям. Основные требования: нетоксичность; хорошая переносимость; отсутствие существенных побочных реакций; оптимум действия в интервале рН 5-7; устойчивость к действию соляной кислоты, пепсинов и других протеаз; содержание достаточного количества активных пищеварительных ферментов; иметь длительный срок хранения.[2].
В зависимости от состава ферментные препараты можно разделить на несколько групп [4]:
Все эти лекарственные вещества содержат ферменты поджелудочной железы, но они не взаимозаменяемы. Различные группы этих препаратов имеют четкие и строгие показания к применению. При нарушении показаний и правил приема можно не только не достичь желаемого результата, но и вызвать различные побочные реакции.
Первая группа ферментов направлена в основном, на компенсацию нарушений деятельности слизистой оболочки желудка. Содержащиеся в них пепсин, катепсин, пептидазы расщепляют практически все природные белки. Эти препараты используются преимущественно при гипоацидном гастрите. Их не следует назначать при заболеваниях, связанных с повышенным кислотообразованием: язвенной болезни, гастритах ассоциированных H.pylori, так как высвобождающийся под их влиянием гистамин может вступать в антагонизм с препаратами, входящими в стандартные схемы лечения этих болезней.
Большинство препаратов, включенных в группу панкреатических энзимов и регулирующих преимущественно функцию поджелудочной железы, используются как в терапевтических целях при значительных нарушениях процесса пищеварения и образования панкреатического сока, так и для профилактического лечения.
Даже в рамках одной группы препараты отличаются по количественному составу входящих в них компонентов. Различие структуры панкреатических энзимов обосновывает разнообразие их клинического применения [3]. Так, мезим-форте®, содержащий 4200 ЕД амилазы, 3500 ЕД липазы и 250 ЕД протеаз, чаще используется для коррекции дисфункции поджелудочной железы, возникающей при погрешностях в питании, при приеме новых, чаще жирных, жареных, продуктов. Этот препарат следует назначать всем путешественникам, особенно переезжающим на значительное расстояние от своего привычного места обитания. Вторичная панкреатическая недостаточность легко может возникнуть при изменении микроэлементного и солевого составов продуктов питания или воды. И в этом случае легкие, «профилактические» энзимные препараты окажут свое действие. Однако ферменты, содержащие активное начало в небольших количествах, выпускаются в виде таблеток, применение которых ограничено у детей различного возраста. Таблетки покрыты специальной кислотоустойчивой оболочкой, при разрушении которой (во время дробления) препарат быстро инактивируется в желудке. Поэтому делить таблетки для назначения детям разного возраста совершенно бесполезно.
Выход из создавшейся ситуации существует в виде группы высокоактивных ферментных препаратов, таких, как панцитрат, креон, пангрол, концентрация липазы в которых достигает 10 000 – 40 000 ЕД. Все эти препараты представлют собой капсулы, внутри которых содержаться минитаблетки или мини-микросферы. [6,7]. Эти капсулы можно раскрыть, а их содержимое разделить соответственно массе тела каждого конкретного ребенка. Следует иметь в виду, что мини-таблетки некоторых препаратов (панкреаза, панцитрат) покрываются специальной кислотоустойчивой оболочкой, содержащей кополимеры метакриловой кислоты, которые, по некоторым данным, могут стать причиной развития фиброзной колонопатии при длительном приеме препаратов [5, 8].
Креон®, выпускаемый в трех видах, в зависимости от активности по липазе, составляющей 10 000 ЕД, 25 000 ЕД и 40 000 ЕД, сначала был синтезирован специально для лечения муковисцидоза. Следует отметить, что в отличие от других препаратов “терапевтического” ряда креон даже при длительном применении не вызывает образования стриктур толстой кишки и какого-либо нарушения функции нижележащих отделов пищеварения, так как мини-микросферы, имеющие диаметр всего 1,2 мм, покрыты фталатом гидроксипропилметилцеллюлозы, не вызывающим нарушения структуры толстой кишки. Находясь в капсулах в виде мини-микросфер, креон можно легко дозировать для детей разного возраста, предварительно высыпав содержимое капсулы на клетчатую бумагу.
Желатиновые капсулы, содержащие мини-микросферы, значительно меньше традиционных капсул, содержащих мини-таблетки или микросферы, что облечает их проглатывание у детей разного возраста. Однако при невозможности проглотить целиком капсулу препарата ее содержимое можно высыпать непосредственно в ложку в начале еды. Мини-микросферы, покрытые специальной оболочкой, имеют диаметр не более 1,2 мм, активно перемешиваются с химусом, что обеспечивает их быстрое и полное переваривание. Креон с активностью 25 000 ЕД способен практически полностью заменить экзокринную деятельность поджелудочной железы, обеспечив организм человека необходимыми ферментами. Креон с активностью 10 000 ЕД используется для коррекции ферментопатий, развившихся в результате перенесенных заболеваний других органов и систем организма.
Решить вопрос о том, какой фермент лучше давать – “корректирующий” или “лечебный”, только определив уровень эластазы в каловых массах при проведении FET (фекального эластазного теста).
Таким образом, каждая группа ферментных препаратов имеет свои, строго ограниченные показания для использования. Применение препаратов по способствует нормализации процессов пищеварения и улучшению состояния больного. Неправильное использование различных групп ферментов дискредитирует эти препараты, так как они не дают положительного эффекта или даже ухудшают состояние пациента.
Алгоритм диагностики панкреатитов у детей
Ключевые слова: панкреатит, детский возраст, алгоритм диагностики
Keywords: pancreatitis, childhood, diagnostic algorithm
Патология поджелудочной железы (ПЖ) в детском возрасте имеет тенденцию к неуклонному росту, оставаясь при этом наиболее сложной с позиции диагностики и трактовки существующих клинических симптомов, а также данных лабораторных и инструментальных методов исследования [1].
В силу своего анатомического расположения ПЖ легко вовлекается в любой патологический процесс в желудочно-кишечном тракте (ЖКТ). Степень этого вовлечения настолько разнообразна, насколько сложна для верификации диагноза. Среди спектра заболеваний ПЖ у детей одно из ведущих мест занимает панкреатит.
Обычно говорят о четырех вариантах панкреатита: острый панкреатит, хронический рецидивирующий панкреатит, хронический латентный панкреатит, реактивный панкреатит и/или вторичные панкреатиты с деструкцией ткани ПЖ. Если имеется в виду реактивное состояние ПЖ без деструкции, то используется термин «диспанкреатизм». При этом диспанкреатизм может предвосхищать развитие «истинного» панкреатита [2, 3].
В основе любого панкреатита лежит деструктивный процесс в ПЖ, сопровождающийся микроциркуляторными расстройствами (которые нередко предшествуют собственно деструкции), воспалительным процессом и фиброзом. На фоне последнего может формироваться экзокринная и эндокринная недостаточность ПЖ. Следует отметить, что панкреатическая недостаточность при панкреатитах у детей развивается относительно редко. Активный деструктивный процесс в ПЖ сопровождается феноменом «уклонения панкреатических ферментов в кровь», повышением их концентрации в крови вследствие разрушения ацинарных клеток и повышения проницаемости барьера между ацинусами и кровью. Данный феномен позволяет достоверно идентифицировать деструкцию в ПЖ и диагностировать острый панкреатит или обострение хронического рецидивирующего панкреатита.
Острый панкреатит (ОП) и обострение хронического панкреатита представляют собой активный деструктивный процесс в ткани ПЖ. Хронический панкреатит (ХП) характеризуется фиброзом ПЖ, на фоне которого в периоды обострения развиваются активные деструктивные процессы. Хронический латентный панкреатит может быть рассмотрен как фиброз ПЖ, также связанный с периодическими эпизодами деструкции, не проявивший себя документированными обострениями.
В детском возрасте острый патологический процесс в ПЖ, как правило, ограничивается отеком, который может иметь различные варианты течения, приводит к формированию очаговой или диффузной деструкции ткани ПЖ, что и характеризует ХП.
К хроническим рецидивирующим панкреатитам в настоящее время имеет смысл относить так же аутоиммунные и наследственные панкреатиты. Необходима более точная дифференциальная диагностика ХП с целью установления этиологии заболевания и подбора более адекватной терапии.
Наследственный панкреатит (НП) в течение многих десятилетий оставался редчайшей патологией поджелудочной железы, и только проведение генетических исследований в середине 1990-х годов позволило выявить характер наследования, тип мутаций и классифицировать НП. Было выявлено, что НП является достаточно широкой и негомогенной нозологической формой, поскольку помимо предполагаемой ранее и установленной первой доминантной мутации (ген катионического трипсиногена) было обнаружено много рецессивных мутаций, полиморфизмов в различных генах, предрасполагающих к развитию ХП. Проведенные в дальнейшем клинические исследования выявили особенности клинического течения и диагностические признаки различных подтипов НП, различающихся генетическими дефектами и типом наследования.
Аутоиммунный панкреатит (АП) относится к числу малоизученных заболеваний в педиатрии, был впервые предложен К.Yoshida и соавторами в 1995 [4]. Применим этот термин только к хроническому панкреатиту, при котором выявляются маркеры аутоиммунного воспаления. Ранее были неоднократно описаны случаи тяжелых атак панкреатита, сопровождающихся гипергаммаглобулинемией у детей с ранее установленными аутоиммунными заболеваниями (воспалительные заболевания кишечника, первичный склерозирующий холангит, ревматоидный артрит, первичный билиарный цирроз). Была выдвинута гипотеза о том, что в основе ХП может лежать аутоагрессивный механизм [4].
Основными клиническими и диагностическими признаками АП являются:
1) Повышенный уровень гамма-глобулина в крови или IgG4 в крови.
2) Аутоантитела в крови.
3) Увеличение ПЖ по данным УЗИ с сужением главного панкреатического протока, иногда стеноз внутрипанкреатической части общего желчного протока, по данным МРХПГ.
4) Малосимптомное или бессимптомное течение, обычно без приступов (ОП).
5) Иногда сочетание с другими аутоиммунными заболеваниями.
6) Эффект от терапии глюкокортикостероидами (ГКС).
Аутоиммунный панкреатит может быть как первичным, так и входить в структуру других аутоиммунных заболеваний (Болезнь Крона и язвенный колит) [4, 5, 6].
Ведущими признаками ХП по определению специалистов являются структурные изменения в железе и признаки недостаточности экзокринной функции поджелудочной железы (первичной и вторичной). Определить эту недостаточность можно рядом клинических и диагностических тестов.
При рецидивирующем течении панкреатита, независимо от наличия/отсутствия клинической картины, необходимо проведение полного лабораторно-инструментального обследования для выбора дальнейшей тактики ведения и лечения 8:
В настоящее время установлено несколько мутаций нескольких генов, ответственных за развитие этого заболевания. При одном из вариантов наследственного панкреатита заболевание передается по аутосомно-доминантному типу с 80% пенетрантностью. В 1996 г. на хромосоме 7 q35 был выявлен ген, ответственный за его развитие, кодирующий катионический трипсиноген. На настоящий момент описано 8 мутаций в данном гене. Мутации D22G, K23R, N29I, N29T, R122H и R122C приводят к повышению аутоактивации трипсиногена, мутации N29T, R122H и R122C стабилизируют трипсин по отношении к его ингибиторам, в то время как мутации D22G, K23R и N29I не связаны с каким-либо известным эффектом. Мутация R122H удаляет точку аутолиза Arg122, мутации D22G и K23R подавляют активацию катепсином В. Во всех случаях этих мутаций нарушается баланс между протеазами и антипротеазами с повышением внутриклеточной протеазной активности и разрушением клеток. Наследственный панкреатит проявляется с первых лет жизни, а в более зрелом возрасте наличие перечисленных мутаций ассоциируется с 50-кратным повышением риска развития рака ПЖ. Кроме изменений в гене трипсиногена, за развитие панкреатитов также могут быть ответственны мутации в гене ингибитора трипсина (Serin Protease Inhibitor Kazal type 1 = SPINK1 или PSTI) на 5-й хромосоме, а в гене муковисцидоза на 7-й хромосоме. В этих случаях предполагается аутосомно-рецессивный тип наследования.
Также в международные стандарты диагностики ХП входят [8, 9, 11]:
Сейчас наиболее перспективным тестом состояния поджелудочной железы могут считаться исследования по определению эластазы. Основным критерием недостаточности ПЖ является снижение уровня эластазы 1 в кале ниже 200 мг/л [5].