Что такое дисперсные системы химия
Понятие и определение
Дисперсные системы представляют собой гетерогенные структуры, внутри которых одно или более веществ распределяются в другом. Они никак не контактируют друг с другом, химические или иные реакции полностью отсутствуют. Нет и смешения. Фактически каждый элемент является самостоятельным, и если его извлечь, он сохраняет свое изначальное состояние.
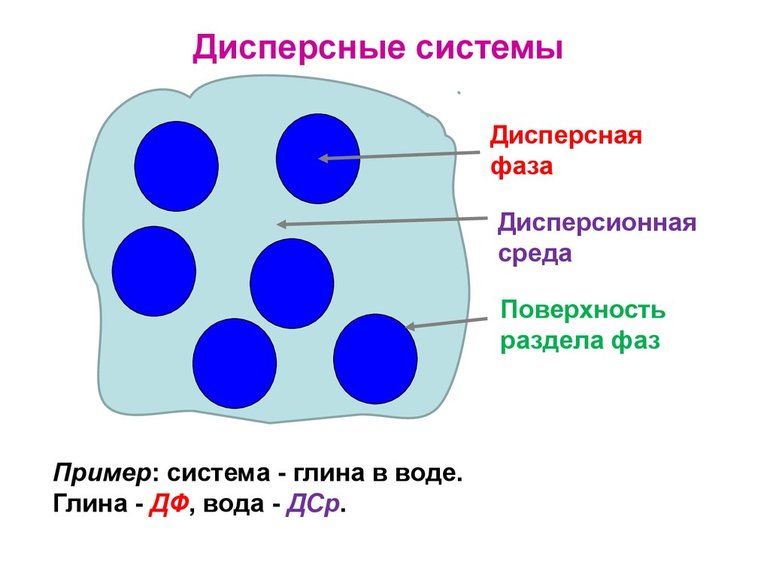
То вещество, которого больше всего в соединении, называется дисперсной средой, второстепенное — фазой. Частицы между собой не взаимодействуют, даже имеется некая прослойка, которая разделяет их. Поэтому системы являются гетерогенными или неоднородными.
Примеры дисперсных систем встречаются в природе постоянно — морская вода, почва, большинство продуктов питания и т. д. Они могут иметь любое агрегатное состояние. Иногда в среде находится сразу несколько фаз. Тогда их выделяют с помощью центрифуги или методом сепарирования.
Классификация по агрегатному состоянию
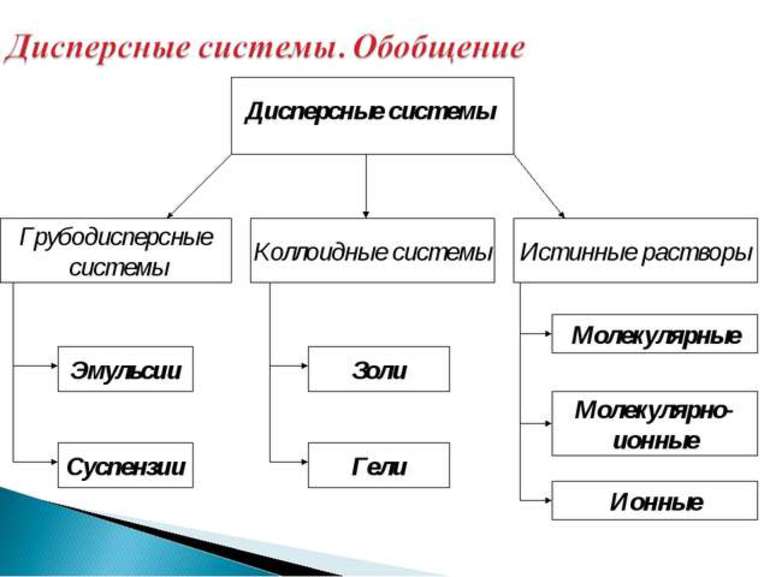
Классификация дисперсных систем осуществляется в соответствии с агрегатными состояниями вещества. Их имеется три вида: жидкое, твердое и газообразное. Поэтому разделение происходит на 9 основных категорий, примеры и описание которых можно посмотреть в таблице ниже.
| Вид | Среда | Фаза | Пример |
| Газ х 2 | Газ | Газ | Отсутствуют |
| Жидкость+газ | Газ | Жидкость | Туман, облако |
| Твердое тело (далее ТТ)+газ | Газ | ТТ | Дым, пыль |
| Газ+жидкость | Жидкость | Газ | Любая пена |
| Жидкость х 2 | Жидкость | Жидкость | Молоко |
| ТТ+жидкость | Жидкость | ТТ | Известь, ил |
| Газ+ТТ | ТТ | Газ | Пемза |
| Жидкость+твердое тело | ТТ | Жидкость | Грунт |
| ТТ+ТТ | ТТ | ТТ | Любые композиционные материалы, такие как бетон или цемент |
Каждый тип классификации, в свою очередь, имеет свое название. К примеру, газообразные соединения называются преимущественно аэрозолями, за редким исключением. Жидкие вещества — газовые эмульсии или суспензии. Взаимодействия, когда средой является твердое тело, определяются, как сплавы, капиллярные системы или пористые субстанции.
Существующие виды
Фазные частицы могут взаимодействовать между собой. При этом среда остается стабильной, химические реакции с ней отсутствуют. В зависимости от типа интерактивности, формируются виды дисперсных систем:
Некоторые субстанции могут быть одновременно двумя видами. Отдельные золи при нормальной температуре являются достаточно текучими, чтобы определить их, как свободнодисперсные. Однако, если градус уменьшается, молекулы соединяются друг с другом сильнее, приобретая характеристики твердого тела. Поэтому переходят в связнодисперсную форму.
Взвеси и их особенности
Те дисперсные системы, фазы в которых можно легко определить невооруженным глазом, называются взвесями. Их характерная черта — непрозрачность. Если необходимо отделить среду и второстепенное вещество, можно воспользоваться рядовыми фильтрами, или процедурой отстаивания. Категорию разделяют на несколько видов:
Взвеси важны в деятельности человека, равно как природных процессах. Почти все производство построено на применении растворов (удобрения, металлы, бумага и пр.). В окружающем мире естественные соединения с водой тоже встречаются постоянно, например, почвообразование или насыщение грунта полезными веществами. В жизнедеятельности всех живых существ они тоже принимают непосредственное участие.
Коллоидные системы
В отличие от взвесей, коллоидные системы невозможно разделить без использования современной техники или специальных препаратов. Без нужного инструмента и невооруженным глазом они выглядят, как однородная субстанция. Из-за этого определить дисперсность становится сложно. Подразделяются на два типа:
Если взвеси играют большую роль в природных процессах, то коллоидные системы являются неотъемлемой частью химии. Чаще всего они добываются посредством смешивания в специальном оборудовании. Без подобной структуры не удалось бы создать множество лекарственных препаратов, удобрений и других полезных материалов.
Высокомолекулярные вещества
Растворы высокомолекулярных веществ бывают двух видов: истинные и коллоидные. Все зависит от разных качеств, таких как тип фазы, среды, температуры и иных условий. У них есть ряд свойств:
Отдельные полимерные растворы образуются самопроизвольно. Когда процесс набухания образуется неорганическим способом, дисперсная система перестает существовать, поскольку фаза полностью растворяется в среде, образуется химическая реакция. Если же он органический, то появляется студень.
Ключевые свойства
Свойства дисперсных систем определяются по одному основному фактору — при их возникновении образуется четкая межфазная граница. Также появляется некоторое значение поверхностной энергии, которая не комбинируется, рассматривается в отдельном порядке по отношению к среде и фазе.
В природе и продуктах жизнедеятельности человека встречаются грубодисперсные системы. Здесь фазу и среду легко можно отличить под стандартным микроскопом, а то и вовсе невооруженным глазом. Но если рассматривать ее в целом, то она представляет собой сложную совокупность коллоидных веществ.
В свою очередь, тонкодисперсные системы являются настолько мелкими, что рассмотреть их можно только в специальный ультразвуковой микроскоп. В некоторых случаях даже при направленном в жидкость луче не появляется характерной «дорожки». Несмотря на существенные различия, свойства везде одинаковы. Они зависят от таких показателей, как:
В жизни человека рассматриваемые системы встречаются постоянно. Такое явление может быть как природным и естественным, так и выводимым в искусственном виде. Многочисленные лекарственные смеси, различные минеральные или химические удобрения, а также производственные процессы построены на дисперсности.
Дисперсная система
Диспе́рсная систе́ма — это система, образованная из двух или более фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
Обычно дисперсные системы — это коллоидные растворы, золи. К дисперсным системам относят также случай твёрдой дисперсной среды, в которой находится дисперсная фаза.
Диспе́ргаторы бывают рециркуляционного, встроенного и погружного типа.
Диспе́ргатор аэродинамический— это аппарат, позволяющий диспергировать материалы в газообразной дисперсной фазе.
Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среды и дисперсной фазы. Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем. Для краткости записи их принято обозначать дробью, числитель которой указывает на дисперсную фазу, а знаменатель на дисперсионную среду, например для системы «газ в жидкости» принято обозначение Г/Ж.
| Обозначение | Дисперсная фаза | Дисперсионная среда | Название и пример |
|---|---|---|---|
| Г/Г | Газообразная | Газообразная | Дисперсная система не образуется |
| Ж/Г | Жидкая | Газообразная | Аэрозоли: туманы, облака |
| Т/Г | Твёрдая | Газообразная | Аэрозоли (пыли, дымы), порошки |
| Г/Ж | Газообразная | Жидкая | Газовые эмульсии и пены |
| Ж/Ж | Жидкая | Жидкая | Эмульсии: нефть, крем, молоко |
| Т/Ж | Твёрдая | Жидкая | Суспензии и золи: пульпа, ил, взвесь, паста |
| Г/Т | Газообразная | Твёрдая | Пористые тела |
| Ж/Т | Жидкая | Твёрдая | Капиллярные системы: жидкость в пористых телах, грунт, почва |
| Т/Т | Твёрдая | Твёрдая | Твёрдые гетерогенные системы: сплавы, бетон, ситаллы, композиционные материалы |
По кинетическим свойствам дисперсной фазы дисперсные системы можно разделить на два класса:
В свою очередь эти системы классифицируются по степени дисперсности.
Системы с одинаковыми по размерам частицами дисперсной фазы называются монодисперсными, а с неодинаковыми по размеру частицами — полидисперсными. Как правило, окружающие нас реальные системы полидисперсны.
По размерам частиц свободнодисперсные системы подразделяют на:
| Название | Размер частиц, м |
|---|---|
| Ультрамикрогетерогенные | 10 −9 …10 −7 |
| Микрогетерогенные | 10 −7 …10 −5 |
| Грубодисперсные | более 10 −5 |
Ультрамикрогетерогенные системы также называют коллоидными или золями. В зависимости от природы дисперсионной среды, золи подразделяют на твёрдые золи, аэрозоли (золи с газообразной дисперсионной средой) и лиозоли (золи с жидкой дисперсионной средой). К микрогетерогенным системам относят суспензии, эмульсии, пены и порошки. Наиболее распространёнными грубодисперсными системами являются системы «твёрдое — газ», например, песок.
Связнодисперсные системы (пористые тела) по классификации М. М. Дубинина подразделяют на:
| Название | Размер частиц, нм |
|---|---|
| Микропористые | менее 2 |
| Мезопористые | 2-200 |
| Макропористые | более 200 |
По рекомендации ИЮПАК[1] микропористыми называют пористые материалы с размерами пор до 2 нм, мезопористыми — от 2 до 50 нм, макропористыми — свыше 50 нм.
Химия. 11 класс
Конспект урока
Урок № 6. Дисперсные системы
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению истинных растворов и дисперсных систем: способам выражения концентрации растворов, видам дисперсных систем, их свойствам, способам коагуляции золей, строению гелей.
Гель – полутвёрдая трёхмерная ячеистая структура, каркас которой образован коллоидными частицами, а в прослойках между частицами удерживается дисперсионная среда.
Дисперсионная среда – сплошная фаза, составная часть дисперсной системы, в которой равномерно распределены частицы дисперсной фазы.
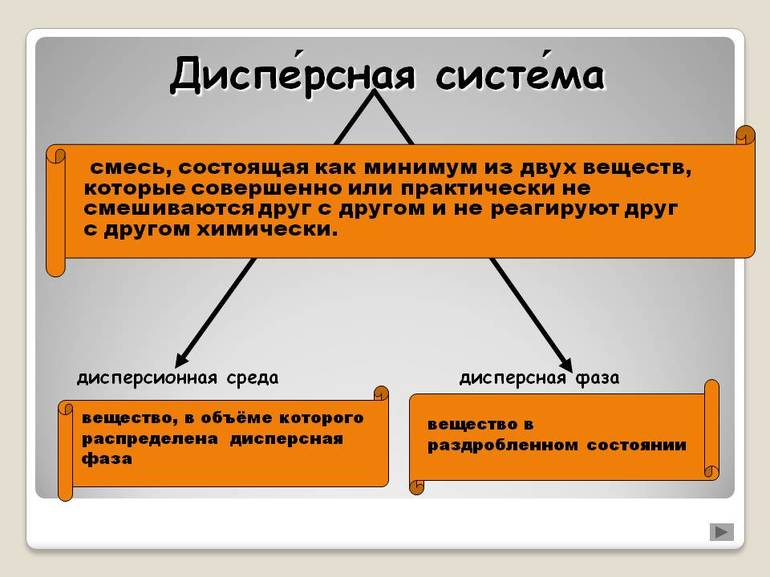
Дисперсная система – гетерогенная система, состоящая, как минимум, из двух фаз, одна из которых мелко раздроблена и равномерно распределена в другой, сплошной фазе.
Дисперсная фаза – мелко раздробленные частицы, равномерно распределённые в дисперсионной среде.
Гетерогенная система – неоднородная система, в которой компоненты находятся в разных фазах и между ними существует видимая граница раздела фаз.
Гомогенная система – однородная система, все компоненты которой находятся в одной фазе, граница раздела фаз между компонентами отсутствует.
Истинный раствор – гомогенная система, состоящая из двух или более компонентов, состав которой в определённых пределах можно изменять без нарушения однородности.
Коагуляция – процесс слипания коллоидных частиц в более крупные агрегаты.
Опалесценция – изменение окраски бесцветного коллоидного раствора с желтоватой в проходящем свете на голубую в отраженном свете.
Седиментация – процесс оседания крупных частиц дисперсной фазы.
Фаза – часть системы, однородная по составу и свойствам, отделённая от окружающей среды видимой границей раздела.
Электрофорез – движение коллоидных частиц золя в постоянном электрическом поле к одному из электродов.
Эмульсия – грубодисперсная система, в которой одна жидкая фаза в виде отдельных мелких капель равномерно распределена в другой жидкости, при этом жидкости взаимно нерастворимы.
Эффект Тиндаля – образование светлого конуса в отраженном свете при прохождении через дисперсную систему луча света.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Истинным раствором называется гомогенная система, состоящая из нескольких компонентов, состав которой в определённых пределах можно менять без нарушения однородности.
Растворимостью называется такое количество вещества, которое можно при данной температуре растворить в 100 г растворителя. Абсолютно нерастворимых веществ в природе не существует.
Молярная концентрация показывает количество растворённого вещества в 1 литре раствора. Сокращенно молярная концентрация, или молярность, обозначается буквой М, например, 1 М – один моль на литр. 
Для того, чтобы найти молярную концентрацию по величине известной массовой доли, необходимо знать плотность раствора. При этом массовая доля должна быть выражена не в процентах, а в долях, а плотность – в г/л.

С истинными растворами мы постоянно встречаемся в жизни. Пьём чай с сахаром, консервируем овощи. В сельском хозяйстве используют растворы минеральных удобрений и средств для борьбы с вредителями и болезнями растений. Растворы используют в промышленности, в медицине, в учебных и научно-исследовательских химических лабораториях.
Дисперсной называется гетерогенная система, состоящая, как минимум, из двух фаз, одна из которых мелко раздроблена и равномерно распределена во второй, сплошной фазе. В отличие от истинных растворов, дисперсная система неоднородна, а между составляющими её фазами всегда существует граница раздела. Мелкораздробленная фаза называется дисперсной фазой, а сплошная фаза – дисперсионной средой. В зависимости от размера частиц дисперсной фазы различают грубодисперсные (размер частиц больше 100 нм) и тонкодисперсные (от 1 до 100 нм), или коллоидные системы. Если размер частиц дисперсной фазы становится меньше 1 нм, система перестает быть гетерогенной, образуется истинный раствор. В истинном растворе вещество раздроблено до отдельных молекул или ионов. В зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды дисперсные системы разделяют на суспензии, эмульсии, пены и аэрозоли. В суспензии твёрдые частицы распределены в жидкости. Эмульсия состоит из мелких капель жидкости, равномерно распределённых в другой жидкости, причем эти жидкости взаимно нерастворимы. Пена – это мелкие пузырьки газа в жидкости. Аэрозоль представляет собой газообразную среду, в которой распылены мелкие твёрдые или жидкие частицы.
Получение и свойства коллоидных растворов
Тонкодисперсные коллоидные системы получили название «золь». Золи могут быть образованы как неорганическими веществами, так и органическими макромолекулами, размеры которых превышают 1 нм, например, белками. Приготовить золь можно смешиванием малорастворимого вещества с растворителем (раствор крахмала, яичного белка), так и с помощью химических реакций ионного обмена, гидролиза, окисления-восстановления, в которых один из продуктов реакции не растворяется в жидкости.
Если в U-образную стеклянную трубку налить золь гидроксида железа и погрузить в каждое колено трубки графитовые электроды, подсоединив их к источнику постоянного электрического тока, то жидкость в одном колене станет светлее, в другом интенсивность окраски увеличится. Происходит это, так как коллоидные частицы движутся в постоянном электрическом поле к одному из электродов. Это явление получило название «электрофорез».
Образование заряда на поверхности коллоидных частиц
Для золей, как и для истинных растворов, характерно броуновское движение, а тяжёлые и крупные частицы грубодисперсных систем в броуновском движении не участвуют. Одноимённые заряды коллоидных частиц препятствуют их слипанию, поэтому золи длительное время остаются устойчивыми. Размеры частиц дисперсной фазы в грубодисперсных системах слишком большие, со временем они оседают – происходит седиментация.
Коагуляция коллоидных растворов
Если к золю добавить раствор электролита, произойдет нейтрализация заряда коллоидных частиц. Золь потеряет устойчивость, частицы начнут слипаться. Слипание коллоидных частиц называется коагуляцией. Коагуляцию можно вызвать длительным нагреванием золя, а также сливанием золей с противоположно заряженными частицами. Если коллоидные частицы слабо взаимодействуют с дисперсионной средой, то в результате коагуляции образуется осадок. Если коллоидные частицы хорошо взаимодействуют с растворителем, то они захватывают часть жидкости, в результате образуется гель. Гель – трёхмерная ячеистая структура, каркас которой образован коллоидными частицами, а в ячейках удерживается жидкость.
Дисперсные системы в природе и на службе у человека
Коллоидные растворы широко распространены в природе. Плазма крови, яичный белок, сырая нефть, речная и озёрная вода, почвенный раствор являются золями. Дисперсными системами являются облака, туман, дым, морская пена, молоко, газированная вода. В промышленности и быту человек использует эмульсионные краски, клеи, лаки, косметические и лечебные гели и шампуни. В пищевой промышленности дисперсными системами являются тесто, желе, студни, соусы, бульоны, мармелад, суфле. Без преувеличения можно сказать, что коллоидная химия – это химия реальных систем.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Приготовление насыщенного раствора
Условие задачи: Для приготовления насыщенного раствора поваренной соли надо в 100 г воды растворить 36 г хлорида натрия. Какое количество (моль) поваренной соли будет растворено в 360 г насыщенного раствора? Ответ запишите с точностью до десятых долей.
Шаг первый: найдём массу насыщенного раствора соли, в котором растворено 36 г хлорида натрия. Для этого сложим массу растворителя и растворённого вещества:
Шаг второй: найдём массу хлорида натрия, которая содержится в 360 г насыщенного раствора. Для этого составим пропорцию:
В 136 г насыщенного раствора содержится 36 г хлорида натрия;
в 360 г такого же раствора содержится т г хлорида натрия.
т = (360·36) : 136 = 95,3 (г).
Шаг третий: вычислим молярную массу хлорида натрия:
М = 23 + 35 = 58 (г/моль).
Шаг четвертый: найдём, сколько моль хлорида натрия содержится в 95,3 г.
Для этого массу хлорида натрия разделим на его молярную массу:
2. Расчёт объёма раствора, который можно приготовить из раствора известной концентрации
Шаг первый: найдём массу 200 мл 12%-ного раствора.
Для этого умножим объём раствора на его плотность:
Шаг второй: найдём массу гидроксида натрия, которая содержится в 226 г 12%-ного раствора.
Для этого составим пропорцию:
В 100 г раствора содержится 12 г гидроксида натрия;
в 226 г раствора содержится т г гидроксида натрия.
т = (226·12) : 100 = 27,12 (г)
Шаг третий: найдём количество моль гидроксида натрия, которое содержится в 27,12 г.
Для этого вычислим молярную массу гидроксида натрия:
М = 23 + 16 + 1 = 40 (г/моль).
Теперь разделим массу гидроксида натрия на его молярную массу:
27,12 : 40 = 0,68 (моль).
Шаг четвёртый: Найдём объём раствора, в котором это количество гидроксида натрия составит концентрацию 0,5 М.
Для этого составим пропорцию:
в 1000 мл раствора содержится 0,5 моль гидроксида натрия;
в V мл раствора содержится 0,68 моль гидроксида натрия.
Дисперсная система

Всего получено оценок: 427.
Всего получено оценок: 427.
Чистое вещество в природе встречается довольно редко. Большинство из них не являются гомогенными, а состоят из смеси различных атомов и молекул. В статье мы поговорим о том, как вещества могут быть распределены в другом веществе и, при этом не смешиваться, дадим определение этому явлению.
Что это такое дисперсная система?
Дисперсная система – это гетерогенная структура, где мельчайшие частицы одного вещества равномерно распределены в другом веществе, при этом они не смешиваются и не контактируют химически. Компонент, который занимает больший объем, имеет название «среда». Компонент, имеющий меньший объем обозначается термином «дисперсная фаза». Частицы фазы и среда имеют между собой поверхность раздела. Именно поэтому дисперсные системы являются неоднородными, то есть гетерогенными.
Дисперсными называются частицы размером от 1 нм до 10 мкм.
Дисперсные системы (фазы и дисперсные частицы) могут иметь любое агрегатное состояние: жидкое, твердое, газообразное. Окружающий нас мир состоит из множества дисперсных систем. Примером может служить почва, морская вода, продукты и многое другое.
В дисперсной системе фаз может быть больше двух. В таком случае отделяют их друг от друга с помощью сепарирования, центрифугирования.
Классификация дисперсных систем
Как известно, дисперсные системы могут находится в трех агрегатных состояниях. Сочетания этих состояний позволяют выделить 9 видов двухфазных дисперсных систем (3 агрегатных состояния фаз и три агрегатных состояния среды). Рассмотрим таблицу «Дисперсная система»:
| Виды дисперсной системы | Дисперсная фаза | Дисперсионная среда | Название и пример |
| газ в газе | газообразная | газообразная | дисперсные системы не образуются |
| жидкость в газе | жидкая | газообразная | аэрозоли: туманы, облака |
| твердое тело в газе | твердая | газообразная | аэрозоли: пыль, дым |
| газ в жидкости | газообразная | жидкая | газовые эмульсии, пены |
| жидкость в жидкости | жидкая | жидкая | эмульсии: нефть, молоко |
| твердое тело в жидкости | твердая | жидкая | суспензии, золи: ил, взвесь |
| газ в твердом веществе | газообразная | твердая | пористые тела: пемза |
| жидкость в твердом веществе | жидкая | твердая | капилярные системы: грунт, почва |
| твердое вещество в твердом веществе | твердая | твердая | сплавы, бетон, композиционные материалы |
По наличию или отсутствию взаимодействия между частицами дисперсной фазы можно выделить два вида дисперсных систем:
Что мы узнали?
Дисперсная система – гетерогенная среда, состоящая из двух или более фаз и дисперсионной среды. Системы могут существовать во всех трех агрегатных состояниях. Благодаря этому формируются 9 видов двухфазных дисперсных систем.