Что такое дисплазия головного мозга у взрослых
Фокальная корковая дисплазия
Фокальная корковая дисплазия — аномалия структуры коры головного мозга, затрагивающая её ограниченный участок. Клинически проявляется фокальными двигательными эпиприступами с потерей сознания, но небольшой продолжительностью. Диагностируется неврологом или эпилептологом по данным ЭЭГ, специально проведённого МР-сканирования, субдуральной электрокортикографии, ПЭТ головного мозга. Как правило, эпилепсия при корковой дисплазии устойчива к проводимой противоэпилептической терапии. Альтернативным методом лечения выступает нейрохирургическая резекция участка дисплазии.
Общие сведения
Фокальная корковая дисплазия (ФКД) — возникшее в период внутриутробного развития локальное нарушение в строении мозговой коры. Является самым частым этиофактором развития эпилепсии у детей. По данным международного исследования ILAE (2005 г.) ФКД была диагностирована у 31% детей с эпилепсией. Отличительными особенностями эпилептических пароксизмов при ФКД являются: устойчивость к проводимой противоэпилептической терапии, агрессивное течение с развитием у детей задержки психического развития и эпилептической энцефалопатии, эффективность нейрохирургических способов лечения.
Локальные диспластические изменения коры располагаются преимущественно в височных и лобных долях. Они слабо заметны на макроскопическом уровне, что затрудняет диагностику ФКД даже при помощи таких современных методов нейровизуализации как МРТ. Проблемы диагностики ФКД особо актуальны в практической неврологии и педиатрии, поскольку её выявление как причины эпилептических пароксизмов имеет решающее значение для выбора эффективной лечебной тактики в отношении резистентных форм эпилепсии.
Причины фокальной корковой дисплазии
ФКД обусловлена нарушением окончательных этапов развития церебральной коры (кортикогенеза) во внутриутробном периоде. В результате нарушений миграции и дифференцировки клеток коры образуется участок с аномальными нейронами, патологической утолщенностью, уплощенностью извилин или изменённой архитектоникой (появлением клеток, типичных для одного слоя, в другом слое коры). Формирование фокальной корковой дисплазии происходит незадолго до родов — за 4-6 недель до окончания периода внутриутробного развития. Более тяжёлые формы пороков мозговой коры (например, полимикрогирия, гемимегалэнцефалия) связаны с нарушениями конца 2-го начала 3-его триместра беременности.
Нельзя исключить генетическую природу ведущего к ФКД сбоя в кортикогенезе. Так, у многих пациентов обнаружены изменения в гене TSC1, которые также наблюдаются при туберозном склерозе. В настоящее время проводятся международные исследования по поиску генетического субстрата корковых дисплазий.
Классификация фокальной корковой дисплазии
До недавнего времени выделяли 2 основных типа ФКД. В 2011 г. была разработана новая классификация, в которую включён 3-й тип, ассоциированный с другим основным поражением церебральных структур. Согласно этой классификации выделяют:
ФКД I типа — локальное нарушение архитектоники коры: радиальное (IA), тангенциальное (IB) или смешанное (IC). Выявляется у 1,7% обследованных практически здоровых людей.
ФКД II типа — очаговое нарушение цитоархитектоники с наличием аномальных нейронов (IIA) и так называемых баллонных клеток (IIB). Как правило, дисплазия затрагивает лобные доли.
ФКД III типа — вторичное нарушение корковой архитектоники, обусловленное другой патологией: мезиальным темпоральным склерозом (IIIA), глиальной опухолью (IIIB), мальформацией сосудов головного мозга (IIIC) или другими нарушениями (IIID) — энцефалитом Расмуссена, нейроинфекцией, посттравматическими или постишемическими изменениями и пр.
Симптомы фокальной корковой дисплазии
Ведущим клиническим проявлением ФКД выступает фокальная эпилепсия. Как правило, она манифестирует в детском возрасте. Эпилептические пароксизмы отличаются своей кратковременностью — длятся не более минуты. Среди них преобладают сложные (с расстройством сознания) фокальные моторные приступы, зачастую с автоматизмами в начальном периоде пароксизма. Спутанность сознания в постприступный период выражена незначительно. Характерны двигательные феномены и внезапные падения. Вторичная генерализация эпиприступов происходит заметно быстрее, чем при височной эпилепсии.
Возраст дебюта эпилепсии и сопутствующая клиническая симптоматика зависят от типа, выраженности и расположения очага корковой дисплазии. Ранняя манифестация аномалии обычно сопровождается задержкой психического развития ребёнка и когнитивными нарушениями.
ФКД I типа имеет менее тяжёлое течение и не всегда проявляется эпиприступами. У ряда пациентов она приводит к затруднению в познавательной деятельности и проблемам в обучении. ФКД II типа сопровождается тяжёлыми парциальными и вторично генерализованными эпиприступами. У многих пациентов наблюдается эпилептический статус. Клиника и течение ФКД III типа зависит от характера основной патологии.
Диагностика фокальной корковой дисплазии
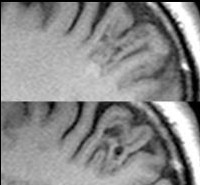
Основной метод диагностики ФКД — магнитно-резонансная томография. Она должна выполняться по специальному протоколу с толщиной срезов 1-2 мм. Только такое тщательное сканирование способно выявить минимальные структурные изменения мозговой коры. В МРТ диагностике корковой дисплазии имеет значение опыт и квалификация рентгенолога. Поэтому при необходимости результаты исследования следует показать более опытному в этом вопросе специалисту.
К МРТ признакам ФКД относятся: локальная гипоплазия или утолщение коры, «смазывание» перехода между белым и серым веществом, изменённый ход извилин, повышенный МР-сигнал на ограниченном участке коры при исследовании в режимах Т2 и FLAIR. Каждый тип ФКД имеет свои особенности МРТ-картины.
В обязательно порядке пациентам с ФКД проводится электроэнцефалография. В большинстве случаев она выявляет очаговую эпилептическую активность мозга не только в момент приступа, но и в межприступный период. Во время приступа отмечается повышенная возбудимость и активация зон коры, прилежащих в визуализируемому на МРТ очагу дисплазии. Это связано с наличием аномальных клеток и за пределами основного участка корковой дисплазии, который является лишь «верхушкой айсберга».
Выявление зоны начала эпилептического приступа возможно при помощи ПЭТ, совмещённой с МРТ-изображением. При этом радиофармпрепарат должен быть введён пациенту после первого же пароксизмального разряда. Такое исследование особенно ценно при МРТ-негативных случаях ФКД и при несовпадении очага, визуализируемого на МРТ, с данными ЭЭГ. Для более точного определения расположения эпилептогенного очага проводится инвазивная электрокортикография с установкой субдуральных электродов, требующая краниотомии.
Лечение фокальной корковой дисплазии
Терапию начинают с подбора эффективного противосудорожного препарата и его дозы. Пациента совместно курируют эпилептолог и невролог. Возможно применение карбамазепина, препаратов вальпроевой к-ты, диазепама, леветирацетама, топирамата и др. антиконвульсантов. Однако зачастую эпилепсия при ФКД оказывается резистентной к противосудорожной терапии. В таких случаях ставится вопрос о хирургическом лечении и проводится консультация нейрохирурга.
Поскольку диспластические изменения носят фокальный характер, то хирургическое удаление патологического очага является эффективным способом лечения ФКД. В начале нейрохирургического вмешательства проводится электростимуляция и индивидуальная интраоперационная кортикография с составлением карты функционально важных участков коры, что позволяет избежать их травмирования в ходе операции. Многие нейрохирурги настаивают на целесообразности как можно более радикального удаления диспластического очага для достижения наилучших результатов лечения. Сложность заключается в широком распространении зоны точечно расположенных патологически изменённых клеток вокруг основного очага и невозможности их полного удаления. Распространённые и билатеральные эпилептогенные поражения являются противопоказанием к хирургическому лечению.
В зависимости от локализации и распространённости очага применяется один из 3 видов оперативных вмешательств: селективная резекция эпилептогенной зоны, стандартизированная резекция головного мозга (лобэктомия), тэйлорированная резекция — «выкраивание» зоны дисплазии, определённой в ходе кортикографии. При ФКД III типа зачастую требуется удаление и дисплазии, и основного очага поражения (опухоли, участка склероза, сосудистой мальформации и т. п.).
Прогноз при фокальной корковой дисплазии
Прогноз зависит от типа ФКД, своевременности проведённого лечения, радикальности удаления участка корковой дисплазии. Консервативная терапия, как правило, не даёт желаемого результата. Длительное течение эпилепсии в детском возрасте чревато нарушением нервно-психического развития с исходом в олигофрению.
Хирургическое лечение наиболее эффективно при единичном хорошо локализуемом очаге. По некоторым данным полное отсутствие пароксизмов или их значительное урежение наблюдается у 60% прооперированных пациентов. Однако спустя 10 лет приступы отсутствуют только у 32%. По всей видимости, рецидив эпилепсии в таких случаях связан с неполным удалением эпилептогенных элементов.
Стойкие послеоперационные неврологические расстройства отмечаются в 2% случаев, при распространённых поражениях — в 6%. Риск их развития повышен при проведении лобэктомии и вмешательствах вблизи функционально значимых участков коры.
Алгоритм диагностики и терапии хронических форм нарушений венозного кровообращения
Изменения венозного кровообращения — один из важных патогенетических механизмов развития сосудистых заболеваний головного мозга. Выявление характерных «венозных жалоб» и своевременная комплексная терапия позволяют минимизировать патологические изменения и
Changes in venous blood circulation is one of important pathogenic mechanisms of development of cerebral vascular diseases. Reveal of typical «venous complaints» and timely complex therapy allow to minimize the pathological changes and eliminate phenomena of cerebral ischemia and hypoxia.
В РФ хронической венозной недостаточностью страдают 35–38 млн человек. К сожалению, стереотип, согласно которому патология вен считается только хирургической патологией, привел к тому, что огромное число больных не получают адекватной врачебной помощи [1]. Вместе с тем изменения венозного кровообращения являются одним из важных патогенетических механизмов развития сосудистых заболеваний головного мозга.
Регионарные изменения тонуса внутричерепных вен приводят к венозному застою и нарушению мозгового кровообращения при атеросклеротическом поражении сосудов мозга, артериальной гипертензии (АГ) и гипотензии, хронических заболеваниях легких, кардиальной патологии. Зафиксировано, что у 15% больных с АГ регистрируется компрессия яремных, брахиоцефальных и позвоночных вен, признаки нарушения венозного оттока головного мозга встречаются в 91% случаев АГ, а у больных с АГ 1–2 стадии — в 55% случаев [2, 3]. В то же время компенсаторные возможности головного мозга и его системы кровообращения так велики, что даже серьезные затруднения оттока венозной крови могут длительное время не вызывать клинических проявлений повышения внутричерепного давления и нарушения мозговых функций [4], поэтому ранняя диагностика данной патологии вызывает определенные трудности.
Для упрощения работы врача может применяться следующий алгоритм диагностики и терапии хронических форм нарушений венозного кровообращения.
Алгоритм диагностики и терапии хронических форм нарушений венозного кровообращения
Шаг 1. Выявление факторов риска
Врачу всегда следует помнить, что венозный застой в подавляющем большинстве случаев носит вторичный характер, т. е. возникает как симптом какого-либо основного заболевания, затрудняющего отток венозной крови из полости черепа. Поэтому диагностика прежде всего предусматривает выявление основной болезни (табл. 1).
Затруднение венозного оттока из полости черепа наблюдается при целом ряде заболеваний [5]:
Заболевания, вызывающие нарушение венозного оттока, приведены в табл. 1.
Кроме того, развитие венозной энцефалопатии может быть также обусловлено классическими причинами развития цереброваскулярной патологии: АГ, атеросклерозом, курением, сахарным диабетом, употреблением гормональных препаратов (эстрогенов), злоупотреблением алкоголем и наркотическими препаратами, использованием нитратов и некоторых вазодилататоров (никотиновая кислота, папаверин). Венозный отток может быть нарушен и в физиологических условиях, например, при натуживании, во время затяжного кашля, при физическом напряжении, пении, игре на духовых инструментах, родах, крике, нагибании головы (например, во время физкультурных упражнений), в положении лежа без подушки под головой, при сдавлении шеи тесным воротничком.
Шаг 2. Анализ жалоб и анамнеза
Нарушения венозного кровообращения, как правило, генетически детерминированы. В настоящее время роль исходного тонуса вен в формировании венозной дисциркуляции неоспорима. Конституциональный и наследственный факторы являются ключевыми для развития венозных дисгемий [6]. У пациентов с семейным «венозным» анамнезом обычно отмечается несколько типичных проявлений конституциональной венозной недостаточности — варикоз или флеботромбоз нижних конечностей, геморрой, варикоцеле, нарушение венозного оттока из полости черепа, варикозное расширение вен пищевода. Часто провоцирующим фактором является беременность.
Течение болезни имеет хронические, эпизодические и ремитирующие варианты.
Шаг 3. Осмотр пациента
При осмотре пациента обнаруживается «венозная триада»:
1) отечность лица в утренние часы после ночного сна, которая значительно уменьшается к вечеру при достаточной физической активности;
2) цианоз кожных покровов лица;
3) расширение подкожных вен шеи и лица.
При выраженном венозном застое больные не в состоянии опускать голову и долго находиться в горизонтальном положении. Артериальное давление (АД) у таких пациентов — обычно в пределах нормы, венозное давление колеблется от 55 до 80 мм вод. ст. Характерна низкая разница между систолическим и диастолическим давлением, в отличие от АГ. В тяжелых случаях возможны эпилептические припадки, психические расстройства [7]. Для венозной дисциркуляции характерно снижение корнеальных рефлексов. При пальпации определяется болезненность в точках выхода первой, реже второй ветвей тройничного нерва («синдром поперечного синуса») с формированием гипестезии в зоне иннервации первой ветви тройничного нерва, что, вероятно, связано с развитием невропатии, вызванной венозным застоем и нарушением микроциркуляции в системе vaza nervorum [8].
По типу превалирующего симптома выделяют следующие варианты хронической венозной недостаточности (энцефалопатии): цефалгический, гипертензионный (псевдотуморозный), беттолепсия, полиморфный (рассеянного мелкоочагового поражения мозга), синдром апноэ во сне, психопатологический/астеновегетативный [9].
Цефалгический синдром — наиболее частое клиническое проявление патологии венозной системы. Как правило, головная боль нарастает при движениях головой в стороны, перемене атмосферного давления, смене температуры окружающей среды, после волнения, приема алкоголя и др. Этот синдром имеет ряд характерных признаков (табл. 2).
Гипертензионный (псевдотуморозный синдром) характеризуется клиническими признаками повышения внутричерепного давления (ВЧД) при отсутствии очаговых неврологических симптомов, наличием застойных дисков зрительного нерва [10]. Развивается остро. Больные, как правило, жалуются на интенсивные приступообразные головные боли, эйфоричны, раздражительны, нередко гневливы. Появляется брадипсихизм с замедленностью движений. При исследовании ликвора обращает на себя внимание повышенное давление. Содержание белка незначительно увеличено или нормально, цитоз не увеличен, серологические реакции отрицательны. Псевдотуморозный синдром при хронической венозной патологии необходимо тщательно дифференцировать с опухолями мозга.
Беттолепсия (кашлевые синкопы) — развитие кратковременного обморока с судорожными подергиваниями во время приступа кашля. Случаи «кашлевых» обмороков (беттолепсии) достаточно редки и составляют не более 2% среди больных с венозной патологией. Эта форма нарушения венозного кровотока развивается при:
В патогенезе главную роль играет гипоксия мозга, возникающая при затяжном кашле, обусловленная повышением внутриплеврального давления, нарушением венозного кровотока в системе верхней полой вены, замедлением легочного кровотока при нарастании внутриплеврального давления, с уменьшением наполнения левого желудочка кровью, замедлением сердечной деятельности, уменьшением минутного объема сердца. В большинстве случаев пароксизмы при кашле не имеют отношения к эпилепсии, поскольку развиваются по патогенетическим механизмам, характерным для обморочных состояний. Приступы кашля возникают у больных в положении сидя или стоя, нередко во время еды или вскоре после нее. Провоцирующие факторы: холодный воздух, резкий запах, табачный дым, чрезмерный смех и др. Одновременно с кашлем развивается гиперемия лица, сменяющаяся цианозом с выраженным набуханием вен шеи. Обычно предвестников нет, может быть только легкое головокружение. Потеря сознания возникает в течение первой минуты от начала кашля. Длительность синкопального состояния от нескольких секунд до минуты. Появляется цианоз, больные нередко падают, часто ушибаются, кашель прекращается, окраска лица меняется с цианотичной на мраморно-бледную. Судорог обычно не наблюдается (иногда возможны тонические судороги). Нет прикуса языка и непроизвольного мочеиспускания.
Беттолепсия наблюдается преимущественно у лиц старшего возраста с хроническими заболеваниями дыхательных путей и легких (фарингит, ларингит, эмфизема легких, бронхиальная астма и др.). В более молодом возрасте появление обмороков при кашле наблюдается достаточно редко, главным образом, у лиц с повышенной чувствительностью каротидного синуса, либо при функциональной недостаточности механизмов, поддерживающих постуральный тонус.
Синдром рассеянного мелкоочагового поражения мозга клинически проявляется отдельными симптомами, такими как асимметрия носогубных складок, легкий нистагм, небольшое пошатывание при ходьбе. Реже встречаются двигательные, чувствительные, координаторные нарушения. Может развиться паркинсоноподобный синдром [11].
Психопатологический и астеновегетативные синдромы наиболее ранние признаки венозной недостаточности. Для них характерно наличие повышенной утомляемости, раздражительности, неустойчивое или плохое настроение, расстройства сна в виде постоянной сонливости или упорной бессонницы, вегетативные нарушения (неприятные ощущениями со стороны сердца, одышка, гипергидроз конечностей). Возможно развитие гиперестезии (непереносимости яркого света, громких звуков, резких запахов), интеллектуальные расстройства (расстройства внимания и памяти, способности к концентрации). Нередко наблюдаются головные боли. У больных отмечается изменение психического состояния в зависимости от атмосферного давления: при его падении повышается утомляемость, усиливается раздражительная слабость, гиперестезия (симптом Пирогова). В редких случаях развиваются психозы с бредовыми идеями и зрительными и слуховыми галлюцинациями [12]. Определяющими для астении являются постоянные жалобы на повышенную утомляемость, слабость, истощение после минимальных усилий в сочетании не менее чем с двумя из нижеперечисленных жалоб:
Наиболее характерные признаки астенических расстройств можно разделить на несколько групп в зависимости от доминирующих жалоб [13].
1. Физические расстройства:
2. Интеллектуальные расстройства:
3. Психологические расстройства:
4. Сексуальные расстройства:
Психопатологический и астеновегетативные синдромы преимущественно развиваются у пациентов молодого и среднего возраста.
Синдром апноэ во сне. У больных с ночными апноэ установлены отсутствие физиологического ночного снижения АД, нарушение церебральной венозной гемодинамики.
Шаг 4. Дополнительные методы исследования
Для более точной диагностики используются инструментальные методы исследования: офтальмоскопия, рентгенография черепа (краниография), ультразвуковые (УЗ) методы исследования венозной системы мозга, компьютерная томография или магнитно-резонансная томография, ангиография головного мозга. При проведении любого диагностического исследования необходимо учитывать, что венозная циркуляция чрезвычайно лабильна, и это связано с состоянием центральной гемодинамики, дыхательным циклом, мышечной активностью, позой. Желательно проведение обследования в дни с благоприятной геомагнитной ситуацией, при условии отсутствия у пациента повышения АД на момент осмотра, жалоб на головную боль и ощущение «тяжести» в голове в течение последней недели. В течение нескольких дней пациенты не должны принимать алкоголь. У женщин репродуктивного возраста оценку церебральной гемодинамики желательно проводить в первой половине менструального периода.
На краниограммах можно выявить усиление сосудистого рисунка, расширение диплоических вен, венозных выпускников. Офтальмологические методы позволяют уже на ранних стадиях сосудистых заболеваний головного мозга наряду с изменением артерий обнаружить расширение вен, их извитость, неравномерность калибра, при выраженном повышении внутричерепного давления — застойные явления на глазном дне. Достаточно информативны методы биомикроскопии конъюнктивы глазного яблока и венозной офтальмодинамометрии. Для уточнения причин и степени нарушения венозного оттока на уровне шеи используют ультразвуковое дуплексное сканирование (УЗДС), селективную контрастную флебографию, сцинтиграфию и компьютерную томографию. Каждый из этих методов имеет преимущества и недостатки. УЗДС позволяет достоверно оценивать скорость кровотока, взаимоотношения сосудов с окружающими тканями, но имеет ограничения, поскольку для исследования доступен сравнительно небольшой участок брахиоцефальных вен. Селективная контрастная флебография связана с определенным риском при введении контрастного вещества, часто неоправданным при данной патологии [15]. Сцинтиграфия не дает информации об окружающих вены структурах. Стандартная компьютерная томография позволяет оценивать диаметр вен и их взаимоотношения с окружающими структурами только в поперечных срезах, но не отображает характеристик потока крови, а кроме того, сопровождается лучевой нагрузкой. Магнитно-резонансная венография головного мозга характеризуется снижением интенсивности сигнала кровотока, вплоть до его выпадения, по верхнему сагиттальному синусу, большой мозговой вене и прямому синусу. Возможно также уменьшение размеров или полное отсутствие сигнала от кровотока по поперечному и сигмовидному синусам, внутренней яремной вене одной из гемисфер головного мозга, сочетающееся с расширением названных венозных структур с противоположной стороны; расширением эмиссарных и поверхностных мозговых вен [16].
Шаг 5. Выбор терапии
К сожалению, вопросы фармакотерапии расстройств венозного мозгового кровообращения до сих пор остаются спорными и недостаточно изученными, несомненно, что в первую очередь необходимо проводить терапию основного заболевания. Максимально ранняя энергокоррекция может дополнительно повлиять на выживаемость нейронов, уменьшить повреждение мозговой ткани, вызванной хронической ишемией и гипоксией, прежде всего, воздействовать на ядро астенического синдрома — гипоэргоз с повышенной истощаемостью психических функций [17]. С учетом современных представлений о патогенезе венозной энцефалопатии, основные усилия должны быть направлены на устранение следующих патологических факторов:
1) нормализацию тонуса венозного русла;
2) лейкоцитарной агрессии и воспаления;
3) коррекцию микроциркуляторных расстройств;
4) увеличение емкости венозного русла.
При лечении хронических нарушений венозного кровотока на различных стадиях чаще всего используются фармацевтические препараты, относящиеся к различным группам (антикоагулянты, средства, улучшающие микроциркуляцию, венотоники). Спектр действия большинства препаратов достаточно узок (декстраны влияют на реологию крови, антиагреганты уменьшают агрегационную активность тромбоцитов, венотоники улучшают тонус венозной стенки, вазодилататоры усиливают гипотонический эффект и т. д.), следовательно, для достижения оптимального терапевтического эффекта необходимо использовать несколько препаратов разных групп [2]. В последние годы идет поиск идеального препарата для лечения расстройств венозного мозгового кровообращения, который должен воздействовать на как можно большее количество патогенетических звеньев, иметь минимальное количество побочных эффектов и высокую биодоступность. Естественно, что наибольший интерес представляют препараты, имеющие в спектре своей фармакологической активности энергокорригирующие и микроциркуляторные механизмы действия при максимальной возможности сочетания с венотоническими лекарственными средствами.
Терапия нарушений венозного кровообращения
Клиническая симптоматика поражения мозга на начальных стадиях нарушения венозного кровообращения минимальна, но микроциркуляторное русло уже повреждено, что приводит к дальнейшей прогрессии патологического процесса, таким образом, базовой терапией является назначение препаратов, обладающих ангиопротекторным эффектом.
Ангиопротекторы
Первой группой базовой терапии являются ангиопротекторы — лекарственные средства, основные действие которых — восстановление тонуса сосудов и их проницаемости. Как правило, они к тому же обладают полимодальным механизмом действия.
Одним из таких фармакологических средств является Актовегин — препарат, активирующий обмен веществ в тканях, улучшающий трофику и стимулирующий процессы регенерации. Особое значение в его механизме действия придают активирующему влиянию на энергетический метаболизм клеток различных органов [18]. Это связано, прежде всего, со способностью повышать захват и утилизацию глюкозы и кислорода, приводя к улучшению аэробной продукции энергии в клетке и оксигенации в микроциркуляторной системе. Одновременно улучшается анаэробный энергообмен в эндотелии сосудов, сопровождающийся высвобождением эндогенных веществ с мощными вазодилататирующими свойствами — простациклина и оксида азота. В результате улучшается перфузия органов и снижается периферическое сопротивление [19]. Этот механизм обеспечивает стабилизацию функционального метаболизма тканей в условиях временно индуцированного стресса и гипоксии при периферических артериальных расстройствах. Улучшение процессов утилизации тканями кислорода и глюкозы не изолировано, а сопряжено с изменениями функционального состояния как путей притока крови к капиллярам (артериолы) и путей ее оттока (посткапиллярные венулы), так и с изменениями параметров гемодинамики на уровне капилляров [20].
М. В. Путилина, доктор медицинских наук, профессор
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва

.gif)
_575.gif)