Что такое дрожжевой дерматит
Какие мази от дерматита лучшие: гормональные или негормональные, и есть ли альтернатива
Рассматривая, какие мази применяют при дерматите, стоит сразу сказать, что они делятся на две большие группы: гормональные и негормональные. Они отличаются не только составом, но также степенью эффективности и безопасности.
Мазь считают лучшей от дерматита на коже у конкретного пациента, если она отвечает ряду требований:
Какими негормональными мазями можно лечить дерматит
Негормональные мази считают более безопасными, поскольку они имеют относительно натуральный состав. Это позволяет использовать наружное средство в течение длительного времени без какого-либо вреда для здоровья.
Именно негормональные мази считают лучшими при атопическом дерматите у ребенка. У взрослых в большинстве случаев в начале лечения врачи тоже стараются назначать именно такие мази. По принципу действия они делятся на несколько групп:
Поскольку средства с одним основным веществом могут снимать только один симптом, врачи часто назначают комбинированные мази. Они за счет нескольких активных компонентов могут оказывать не одно, а несколько эффектов. Примеры негормональных препаратов, претендующих на роль самой хорошей мази от дерматита:
Из плюсов негормональных мазей особое значение имеет минимум побочных эффектов. Еще большинство из них разрешены к применению у детей, беременных и кормящих женщин.
Главным минусом негормональных мазей часто выступает недостаточная эффективность. Из-за этого лечение может затянуться на несколько недель, месяц и даже дольше. При этом курс нельзя прерывать, иначе предыдущая терапия может оказаться неэффективной. В результате врачу все-таки приходится назначать более сильные гормональные средства.
Выбирая, какая мазь лучше от дерматита, нельзя игнорировать и другие недостатки негормональных мазей:
То есть при длительном лечении мазь вызывает аллергию, но при этом может не давать нужного эффекта.
Гормональные мази
Когда отсутствует положительная динамика от применения негормональных мазей, специалисты прибегают к гормональным препаратам. В их составе основным компонентом выступают глюкокорстикостероиды – гормоны, которые в теле человека вырабатываются надпочечниками. В основе механизма действия таких препаратов лежит влияние на обмен белков и углеводов. Гормональные мази восстанавливают уровень кортизона, при недостатке которого организм становится неспособен справляться с воспалительными процессами.
В зависимости от степени воздействия на кожу гормональные мази делятся на несколько категорий:
Последние используют только при самых тяжелых формах дерматита, поэтому первыми их никогда не назначают. Примеры гормональных мазей:
Главные недостатки гормональных мазей при лечении дерматита:
Гормональные средства могут претендовать на звание лучших мазей от дерматита, но только в плане эффективности. Да, они быстрее помогают справиться с симптомами заболевания, нежели негормональные. Но при этом они могут оказывать кратковременный эффект, требуют очень строгого соблюдения схемы лечения, имеют побочные эффекты и большой список противопоказаний, который включает:
Какую же мазь использовать
Как видно из обзора мазей от дерматита, и гормональные, и негормональные средства нельзя назвать идеальными для лечения такого заболевания. Клиника «ПсорМак» предлагает в качестве альтернативы и эффективную, и безопасную мазь. Она создана по собственной рецептуре и показывает свою эффективность уже в течение более 25 лет.
В составе мази отсутствуют гормоны. Вместо них только натуральные природные компоненты, которые делают мазь безопасной для детей, беременных и кормящих. Мазь не вызывает побочных эффектов, не приводит к аллергии и обострению симптомов.
Кроме того, мы комплексно подходим к лечению заболевания, прибегая к всесторонней работе с пациентом путем психотерапии, игло- и гирудотерапии. Еще мы разрабатываем для пациентов индивидуальную диету. Такой подход позволяет добиться стойкой ремиссии до 6 лет, что подтверждают отзывы и результаты лечения наших пациентов.
Аллергия на дрожжи рода Malassezia у больных атопическим дерматитом
Липофильные дрожжи рода Malassezia, обитающие на коже человека, обладают уникальными свойствами, особо выделяющими их из царства грибов. Уникальность состоит в том, что они представляют собой яркий пример способности микроорганизма в зависимости от услови
Липофильные дрожжи рода Malassezia, обитающие на коже человека, обладают уникальными свойствами, особо выделяющими их из царства грибов. Уникальность состоит в том, что они представляют собой яркий пример способности микроорганизма в зависимости от условий окружающей среды и иммунитета хозяина проявлять свойства комменсала или патогена. Кроме того, это единственный представитель микрофлоры человека, для жизнедеятельности которого необходимы жиры. Ни один из других видов грибов не обладает качеством облигатной липофильности.
История вопроса. Практически у каждого человека кожа, особенно верхней части тела, колонизирована грибами рода Malassezia. Казалось бы, именно поэтому исследование физиологии этого постоянного спутника человеческого организма должно быть всесторонним. Между тем эволюция изучения особенностей сожительства хозяина и грибка в течение более чем столетия сопровождалась множеством ошибок и неточностей. Впервые их описал в 1846 году микробиолог Eichstedt [1]. После этого долгое время исследование физиологических свойств этих грибов было затруднено в связи с тем, что не удавалось их культивировать. Не приживались эти дрожжи на средах, которые обычно использовались для культур других грибов. И только когда в 1939 году доктор Benham догадалась, что для жизнедеятельности этих грибов необходимы жиры, появилась возможность получить культуру Malassezia spp. [2]. Сложность идентификации видов состояла еще и в том, что для грибов рода Malassezia типичен диморфизм, то есть способность пребывания как в дрожжевой, так и в мицелиальной фазе. Поэтому многие исследователи предполагали, что эти фазы не что иное, как различные представители дрожжевой флоры: род Pityrosporum — дрожжевая форма, а Malassezia — мицелиальная. Кроме того, вариабельность формы дрожжей принималась микробиологами за разные виды: круглая форма клетки — Pityrosporum orbiculare, а овальная — Pityrosporum ovale. Таким образом, таксономия и номенклатура рода Malassezia до последнего времени была запутана и хаотична [3, 4]. В связи с тем, что так и не было доказано наличие двух фаз жизнедеятельности дрожжей, в классификации присутствовали оба рода. Эта ситуация прояснилась только в 1977 году, когда три независимые группы микологов опубликовали данные о том, что им удалось создать условия, при которых дрожжевые клетки продуцировали гифы in vitro. Используя различные вариации культуральных условий, им удалось получить гифы, отличные от штаммов, изолированных от пациентов с разноцветным лишаем. Было показано, что гифы способны образовывать как круглые, так и овальные формы дрожжевых клеток, поэтому было сделано предположение, что форма клетки — это фаза жизненного цикла микроорганизма.
Таким образом, прогресс в познании грибов рода Malassezia лишь к 1996 году позволил авторам Guillot и Gueho установить порядок в таксономии [5]. Они зарегистрировали 104 штамма Malassezia spр., идентифицированных характеристикой ДНК, определяемой методами полимеразной цепной реакции. На основании этих данных они определили и назвали 7 видов рода Malassezia: M. furfur, M. sympodialis, M. obtusa, M. globosa, M. restricta, M. slooffiae и M. pachydermatis [6].
Биология, физиология, экология Malassezia spp. В связи с проблемами культивирования биология, физиология, экология Malassezia spр. исследована плохо. Основной отличительной особенностью этих дрожжей является их неспособность к ферментации сахаров. Главный источник углерода для них — жиры. Несмотря на то, что микроорганизм можно вырастить в аэробных условиях, он выживает и в анаэробных условиях. Предполагается, что жирные кислоты не являются источником энергии и не участвуют в метаболизме, но представляют собой неотъемлемую составную часть клетки. Обнаруженные липиды внутри клеток эпидермиса имеют состав, необходимый для питания дрожжевых клеток [7]. Сложность получения культуральных экстрактов до последнего времени не позволяла проводить исследования IgE опосредованной реактивности in vivo и in vitro. И только в последние 20 лет появилась возможность определения роли грибов Malassezia spр. в патогенезе атопического дерматита (АД).
Антигенный состав Malassezia spp. Богатой антигенной структуре липофильных грибов приписывают свойство высокой иммуногенной активности, которая значительно превышает таковую у других представителей дрожжевой флоры, таких как, например, Candida albicans. Способность антигена вызывать индукцию антител в организме человека имеет чрезвычайно широкий полиморфизм. Она зависит как от состояния иммунной системы хозяина, от антигенного состава грибов, так и от особенностей окружающей человека среды (климата, состава воды, моющих средств, инсоляции, температуры, качественного состава сального секрета желез кожи). В настоящее время описано большинство известных антигенов основных видов рода Malassezia, исследована их биохимическая структура, способность к индукции IgE-антител в крови больных атопическим дерматитом, а также получено 13 основных рекомбинантных аллергенов [8, 9].
На высвобождение аллергенов на коже влияет, прежде всего, рН на поверхности кожи, которая у пациентов с АД выше, чем у здоровых. Оказалось, клетки M. sympodialis продуцируют, экспрессируют и высвобождают в большом количестве аллергены при наиболее высоких значениях pH. Это особенно характерно для главного аллергена с весом 67-kDa, обозначаемым как Mala s 12 [12].
Иммунный ответ на Malassezia spp. Существует две противоречивых точки зрения на феномен индукции IgE-антител к антигенам дрожжей, в связи с доказанным фактом о том, что уровни специфических IgE к Malassezia коррелируют с уровнем общего иммуноглобулина Е, но не зависят от тяжести течения АД. Ряд авторов считает, что индукция антител к маннану липофилов — это лишь проявление атопического статуса, так как у 85% больных АД значительно повышен уровень общего IgE, и не является доказательством роли этих микроорганизмов в патогенезе АД. Другие, наоборот, считают, что это наиболее важный триггерный фактор АД.
Предполагается, что аутореактивность к собственным белкам человека у пациентов с АД играет роль одного из наиболее значимых патогенетических факторов при АД. Один из таких белков, фермент супероксид дисмутазы марганца (СДМ) — MnSOD, индуцируется при стрессовых ситуациях, как клетками организма человека, так и клетками грибов. Доказано, что фермент обладает свойством аллергенной активности (аутоаллерген при АД). Молекулярная мимикрия, приводящая к перекрестной реактивности, такой как сенсибилизация, к MnSOD, может быть первично обусловлена колонизацией кожи больных липофильными грибами [13].
Таким образом, липофильные дрожжи рода Malassezia, постоянно обитающие на коже человека, у больных АД начинают играть роль сильнейшего антигенного стимула. Если заселение поверхности кожи грибами происходит в первые годы жизни человека, то при наличии атопической предрасположенности оно является одним из первых аллергенов, вызывающих немедленный тип аллергической реакции. Учитывая перекрестную реактивность с другими дрожжеподобными грибами, которые постоянно присутствуют на слизистых оболочках, поступают каждый день с едой, с идентичными ферментами, вырабатываемыми кератиноцитами кожи, продуценты липофилов становятся главными триггерными и патогенетическими факторами АД на протяжении всей жизни.
Диагностика. Для диагностики АД, отягощенного колонизацией кожи Malassezia spp., используют микологические, иммунохимические, аллергологические методы.
Микологическое исследование с целью выделения и идентификации липофильных дрожжей рода Malassezia проводят методом соскоба и сбора с поверхности кожи на участке 1 см2 на ватный тампон. Далее производят пересев в трехкратной повторности на элективной среде Notman-агар (LNA): (10,0 г полипептона, 5,0 г глюкозы, 0,1 г дрожжевого экстракта, 8,0 г бычьей желчи, 1,0 мг глицерола, 0,5 г глицеролстеарата, 0,5 мг Tween 60, 10 мл молока и 12,0 г агара на литр). Чашки с посевом инкубируют в термостате при температуре 32 °C в течение двух недель. Видовую идентификацию представителей рода Malassezia проводят по морфологическим (морфология колоний, размер и форма клеток), физиологическим (рост при 37 °C, 40 °C) и хемотаксономическим (каталазная реакция, утилизация Tween 20, Tween 40, Tween 60, Tween 80) признакам. Подсчет средних значений КОЕ/см2 осуществляют в соответствии с количеством колоний, выросших на плашке с пробы, взятой с участка кожи в 1 см2.
Нам удалось выделить четыре вида рода Malassezia: Malassezia sympodialis, Malassezia globosa, Malassezia furfur, Malassezia restricta. Доминирующим во всех исследованных образцах был вид Malassezia sympodialis. Его мы регулярно выделяли с кожи как больных, так и здоровых. Второе место по встречаемости занимают Malassezia globosa и Malassezia furfur.
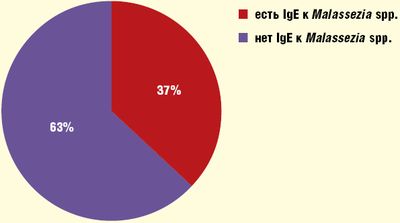
Выявление IgE-антител к Malassezia spp. в сыворотке крови пациентов рекомендуется осуществлять иммунохемилюминесцентным методом на приборе UniCAP 100 (Phadia, Швеция) с применением соответствующих реагентов. Мы выявляли IgE-антитела к Malassezia spp. почти у 40% больных и ни у одного из здоровых пациентов (Рис.).
Средние значения концентрации IgE-АТ в сыворотке крови варьировали от 0,36 kU/l (1 класс) до 68,8 kU/l (5 класс). Наиболее часто их выявляли у больных старше 7 лет, у трех больных в возрасте 5 лет они уже присутствовали в значительной концентрации (более 0,36 kU/l ). Тем не менее, концентрация IgE-антител в группе детей была достоверно ниже (от 0,36 kU/l до 32,0 kU/l, среднее значение 8,06 ± 7,9 kU/l), чем в группе взрослых (от 0,39 kU/l до 68,8 kU/l, среднее значение 19,42 ± 16,7 kU/l) (р
М. А. Мокроносова, доктор медицинских наук, профессор ГУ НИИВС им И. И. Мечникова, РАМН, Москва
Кандидоз гладкой кожи
Кандидоз — часто встречающееся заболевание, относящееся к разряду микозов, обусловленных условно-патогенными грибами. В нашей стране еще в конце XVIII века было известно об этом грибковом заболевании, однако многочисленные сообщения о кандидозе
Кандидоз — часто встречающееся заболевание, относящееся к разряду микозов, обусловленных условно-патогенными грибами. В нашей стране еще в конце XVIII века было известно об этом грибковом заболевании, однако многочисленные сообщения о кандидозе, развившемся как осложнение после проведения антибактериальной терапии, стали появляться после внедрения в практику антибиотиков широкого спектра действия.
По данным Г. А. Самсыгиной (1997), имеет место нарастание различных клинических форм кандидоза у новорожденных, в том числе у детей, инфицированных в раннем неонатальном периоде. При применении антибактериальных препаратов у детей соматических отделений поражение слизистой оболочки полости рта, обусловленное дрожжевыми грибами рода Candida, наблюдается у 6,6%, слизистой рта и кожи — у 15%, слизистой кишечника — у 2,5%, кандидоносительство в кишечнике — у 9,2% пациентов (Ж. В. Степанова, Л. Л. Смольякова, 1999).
Рост заболеваемости кандидозом связан с применением современных средств терапии (антибиотики, гормональные препараты, цитостатики, иммунодепрессанты), а также с увеличением числа заболеваний, создающих благоприятный фон для его развития: иммунодефицитные состояния, дисфункции эндокринных желез, злокачественные новообразования, болезни крови и др., кроме того, на увеличение числа случаев кандидоза влияют повышенный радиационный фон и другие факторы, ослабляющие иммунитет. Участившееся выявление этого заболевания у больных после хирургического лечения, а также с гинекологическими, урологическими, гематологическими и другими нарушениями в последние годы повышает интерес к проблеме кандидоза у врачей разных специальностей.
Кандидоз вызывается дрожжевыми грибами рода Candida, широко распространенными в природе и относящимися к условно-патогенным возбудителям. Их насчитывается более 130 видов, но патогенными для человека могут быть немногим более 10 видов, таких, как C. albicans, C. tropicalis, C. krusei и др.
Возбудители кандидоза выделяются в среднем от каждого третьего человека из кишечника, гениталий, бронхиального секрета. Первичная колонизация организма происходит в родовых путях матери, а после рождения — контактным и алиментарным путем. Инфицирование ребенка может произойти при кандидозе сосков матери, при контакте с обслуживающим персоналом, через предметы обихода и т. д.
Ведущими факторами в развитии кандидоза являются фоновое состояние или заболевания организма, при которых условно-патогенные возбудители приобретают патогенные свойства. В последние годы многие исследователи пришли к заключению, что основным предрасполагающим фактором для возникновения поверхностных форм кандидоза, в том числе при ВИЧ-инфекции и СПИДе, является нарушение клеточного иммунитета. Определенную роль в развитии кандидоза играет частое и не всегда оправданное назначение антибиотиков широкого спектра действия, в том числе и с профилактической целью, а также широкое использование препаратов, обладающих иммуносупрессивным действием — глюкокортикоидные гормоны и цитостатики.
Кандидозная паронихия и онихия на пальцах кистей, как правило, развивается у женщин, имеющих частый контакт с водой, при этом наблюдается отделение ногтевой кожицы (эпонихиона) от ногтевой пластины, создаются благоприятные условия для поражения грибковой инфекцией в области матрикса. Заболевание может возникать у лиц, страдающих сахарным диабетом. В последние годы женщины стали пользоваться накладными ногтями, в связи с чем появился еще один фактор риска для развития грибковой и бактериальной инфекции.
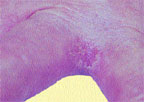 |
| Риcунок 1. Межпальцевая кандидозная эрозия |
На гладкой коже поражаются крупные (пахово-бедренные, межъягодичная, под молочными железами, подкрыльцовые впадины) и мелкие (межпальцевые) складки, но высыпания могут возникать также вне складок на гладкой коже туловища и конечностей, в том числе ладоней и подошв. Вне складок очаги кандидоза развиваются преимущественно у грудных детей либо у взрослых, страдающих сахарным диабетом или тяжелым соматическим заболеванием. В крупных складках появляются мелкие с просяное зерно пузырьки, иногда и пустулы, которые быстро вскрываются с образованием эрозий. Вследствие периферического роста эрозии быстро увеличиваются в размере, сливаются между собой, образуя обширные участки поражения. Очаги —темно-красного цвета с бордовым оттенком, блестящие, с влажной поверхностью, неправильных очертаний, с полоской отслаивающегося эпидермиса по периферии. Вокруг крупных очагов образуются свежие мелкие эрозии (очаги отсева). У детей, особенно ослабленных, из складок поражение распространяется на кожу бедер, ягодиц, живота, иногда и на весь кожный покров. В глубине складок могут быть болезненные трещины. Кандидоз гладкой кожи вне складок (грудь, живот, плечи, предплечья, голени и др.) у детей имеет клиническую картину себорейного дерматита в виде очагов эритематозно-сквамозного характера или гиперемии. У взрослых заболевание может проявляться в виде эритематозных пятен с шелушением в центре и мелкими пузырьками по периферии. В мелких складках кожи поражение, как правило, возникает между 3-м и 4-м, 4-м и 5-м пальцами кистей, реже стоп и характеризуется образованием эрозированных очагов насыщенно-красного цвета с гладкой, блестящей, как бы лакированной поверхностью, четкими границами, с отслаиванием рогового слоя эпидермиса по периферии (рис. 1). Заболевание может начинаться с появления мелких пузырьков на боковых соприкасающихся гиперемированных поверхностях кожи. Затем оно распространяется на область межпальцевой складки, появляется отечность, мацерация, шелушение.
Межпальцевая кандидозная эрозия наблюдается преимущественно у лиц, имеющих длительный контакт с водой, который способствует развитию мацерации кожи, и, как следствие, создаются благоприятные условия для развития кандидозной инфекции. Кроме складок между 3-м и 4-м, 4-м и 5-м пальцами могут поражаться и другие, не только на одной, но и на обеих кистях. Больных беспокоит зуд, чувство жжения, а при наличии трещин — болезненность. Течение заболевания хроническое, с частыми рецидивами. У кормящих женщин может развиваться кандидоз гладкой кожи сосков. Клинические проявления могут быть разными: в виде небольшой гиперемии в области околососкового кружка; в виде очага около соска с мацерацией, четкими границами; в виде трещины с мацерацией по периферии и мелкими пузырьками между соском и околососковым кружком.
Редко встречается кандидоз ладоней и подошв. На ладонях заболевание может протекать по типу сухого пластинчатого дисгидроза (поверхностное пластинчатое, кольцевидное или гирляндообразное шелушение); может иметь везикулезно-пустулезную форму (пузырьки и пустулы на фоне гиперемированной и отечной кожи); способно протекать по типу гиперкератотической экземы (на фоне диффузного гиперкератоза или отдельных участков ороговевшей кожи наблюдаются резко ограниченные широкие кожные борозды, имеющие грязно-коричневую окраску). Кандидоз кожи подошв наблюдается преимущественно у детей и характеризуется наличием мелких пузырьков и пустул, гиперемированных пятен с шелушением и отслаивающимся мацерированным эпидермисом по периферии.
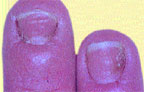 |
| Риcунок 2. Кандидозная паронихия и онихия |
При кандидозе ногтевых валиков (кандидозной паронихии) заболевание начинается с заднего валика, чаще в области перехода его в боковой валик, с появления гиперемии, припухлости и отечности кожи. Затем воспалительные явления распространяются на весь валик, который становится утолщенным и как бы нависает над ногтем, по краю валика наблюдается шелушение. Кожа валика становится тонкой, блестящей, исчезает эпонихион. При надавливании на валик может выделяться сукровица, комочек белой крошковатой массы или капелька гноя (вследствие присоединения вторичной инфекции). Позже изменяется ногтевая пластина: становится тусклой, в области луночки отделяется от ложа, разрушается по типу онихолизиса или появляются поперечные борозды и возвышения. Эти изменения связаны с нарушением кровоснабжения в области матрикса, т. е. носят трофический характер и вызваны воспалением в области валика. Поражение ногтя, обусловленное дрожжевым грибом рода Candida, начинается с латеральных краев, ногти истончаются, отделяются от ложа, приобретают желто-бурую окраску и выглядят как бы подстриженными с боков (рис. 2). У детей младшего возраста воспалительные явления в области валика бывают более выраженными, а ногтевая пластина изменяется с дистального края. Встречается кандидозное поражение ногтей без воспаления валика. В этом случае изменение пластины начинается с дистального края и развивается по типу онихолизиса: пластина истончается, не прирастает к ложу, может иметь место множественное поражение ногтей.
При особой разновидности заболевания — хроническом генерализованном (гранулематозном) кандидозе — клинические проявления на коже могут носить разнообразный характер.
Довольно часто встречается кандидозный баланопостит. Заболевание может протекать в легкой форме с незначительным пластинчатым кольцевидным шелушением или иметь более выраженный характер. В этом случае появляются гиперемия, мацерация, эрозии на коже головки полового члена и внутреннем листке препуциального мешка, а также в коронарной борозде на соприкасающихся поверхностях. Кожа выглядит влажной. Эрозии могут сливаться, и образуются очаги с четкими границами, полициклических очертаний, с блестящей, лакированной поверхностью, по периферии наблюдается бахромка отслаивающегося эпидермиса. Субъективно пациентов беспокоит зуд и ощущение жжения. Заболевание может осложниться изъязвлением и развитием фимоза.
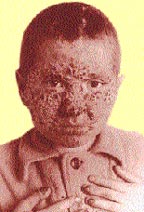 |
| Риcунок 3. Поражение кожи головы, лица и ногтей у больного хроническим генерализованным гранулематозным кандидозом |
При поверхностных формах кандидоза диагноз основывается на наличии у больного характерной клинической картины и обнаружении гриба в патологическом материале (чешуйки кожи, соскоб с ногтей) при микроскопическом исследовании. Диагноз можно считать достоверным, если обнаруживаются псевдомицелий или истинный мицелий и почкующиеся клетки. Посев на питательную среду проводится для идентификации вида дрожжевого гриба рода Candida и с целью определения чувствительности его к антимикотическим препаратам. Выделение только культуры гриба не имеет диагностического значения, так как ее можно получить при посеве соскобов с кожи и ногтей у здоровых людей.
При кандидозе гладкой кожи крупных складок и вне складок заболевание следует дифференцировать от себорейной экземы, псориаза, других микозов — паховой эпидермофитии, поверхностной трихофитии, псевдомикоза — эритразмы (осложненной формы); при межпальцевой кандидозной эрозии на кистях — от дисгидротической экземы, на стопах — от микоза, обусловленного Trichophyton interdigitale и Trichophyton rubrum; при поражении ногтей и валиков — от онихии и паронихии бактериальной этиологии, экземы и псориаза; при баланопостите — от подобного заболевания бактериальной этиологии.
Ограниченные, иногда и распространенные формы поражения гладкой кожи, особенно развившиеся в процессе лечения антибактериальными препаратами, как правило, легко поддаются лечению местными антимикотическими средствами и могут разрешаться без лечения после отмены антибиотиков. В качестве этиотропной терапии назначают антимикотики местного и системного действия. В последние годы при лечении кандидоза широко применяются препараты азолового ряда, обладающие широким спектром действия, а также полиеновые антибиотики.
При кандидозе гладкой кожи крупных складок с острыми воспалительными явлениями лечение необходимо начинать с применения водного раствора бриллиантового зеленого (1–2%) в сочетании с присыпкой и проводить в течение 2–3 дней, затем назначаются антимикотические препараты — до разрешения клинических проявлений.
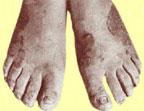 |
| Риcунок 4. Поражение кожи стоп и ногтей у больного генерализованным гранулематозным кандидозом |
При кандидозе гладкой кожи крупных, мелких складок и других участков кожи используют противогрибковые средства в виде крема, мази и раствора: кетоконазол (кетоконазол, микозорал, низорал), клотримазол (клотримазол, канизон, канестен, кандид), оксиконазол (мифунгар), бифоназол (микоспор, бифосин), сертаконазол (залаин), натамицин (пимафуцин). Крем или мазь наносят тонким слоем на очаги поражения и втирают 1–2 раза в день. Продолжительность лечения — до разрешения клинических проявлений, затем продолжают применять крем еще в течение 7–10 дней для профилактики рецидива. При распространенных процессах на коже и неэффективности местной терапии назначают антимикотики системного действия: флуконазол (дифлюкан, флюмикон, микосист, флюкостат и др.) взрослым в дозе 100–200 мг 1 раз в сутки, детям из расчета 5 мг/кг массы тела 1 раз в сутки; итраконазол (орунгал, ирунин, румикоз) взрослым по 100–200 мг 1–2 раза в сутки; кетоконазол (низорал, микозорал) взрослым по 200 мг 1 раз в сутки ежедневно, а также антибиотик полиенового ряда натамицин (пимафуцин) взрослым по 100 мг 4 раза в сутки, детям по 50 мг 2–4 раза в сутки. Продолжительность терапии составляет 2–4 нед.
При кандидозе кожи ногтевых валиков сначала проводят противовоспалительное лечение валика с помощью аппликаций с чистым ихтиолом, которые назначают 1 раз в сутки, до снятия воспалительных явлений. Затем используют антимикотические средства (кетоконазол, мифунгар, травоген, клотримазол, залаин и др.) для местного применения, втирая их под валик и вокруг него. Процедуры проводят 2 раза в сутки, вечером можно применять под окклюзионную повязку. Эффективно назначать сочетание мази (крема) с раствором, чередуя их. В случае неэффективности местной терапии и при поражении ногтевых пластин показаны антимикотики системного действия: флуконазол (дифлюкан, флюмикон, микосист, флюкостат и др.) по интермиттирующей схеме (взрослым по 150 мг 1 раз в неделю, детям из расчета 5–7 мг/кг массы тела); итраконазол (орунгал, ирунин, румикоз) взрослым по методу пульс-терапии (по 200 мг 2 раза в сутки в течение 7 дней, затем 3 нед — перерыв) в течение 2–3 мес; кетоконазол (низорал, микозорал) взрослым по 200 мг в сутки ежедневно в течение 2–4 мес.
Учитывая тот факт, что кандидоз относится к оппортунистическому микозу, в первую очередь необходимо выявить и по возможности устранить патогенетические факторы заболевания (показаны исследование иммунного и эндокринного статуса, желудочно-кишечного тракта и проведение корригирующей терапии).
Профилактика кандидоза включает следующие мероприятия.
Литература
Ж. В. Степанова, доктор медицинских наук, профессор
ЦНИКВИ, Москва