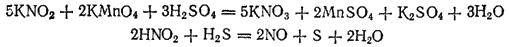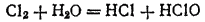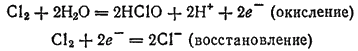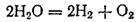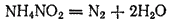Что такое двойственность в химии
97. Окислительно-восстановительная двойственность.
Внутримолекулярное окисление-восстановление. Соединения высшей степени окисленности, присущей данному элементу, могут в окислительно-восстановительных реакциях выступать только в качестве окислителей, степень окисленности элемента может в этом случае только понижаться. Соединения низшей степени окисленности могут быть, наоборот, только восстановителями; здесь степень окисленности элемента может только повышаться. Если же элемент находится в промежуточной степени окисленности, то его атомы могут, в зависимости от условий, как принимать, так и отдавать электроны. В первом случае степень окисленности элемента будет понижаться, во втором — повышаться. Поэтому соединения, содержащие элементы в промежуточных степенях окисленности, обладают окислительно-восстановительной двойственностью-способностью вступать в реакции как с окислителями, так и с восстановителями.
Так, азот образует соединения, в которых степень его окисленности изменяется от —3 (аммиак и соли аммония) до +5 (азотная кислота и ее соли). Азот, входящий в состав аммиака, может выступать только в качестве восстановителя, азот азотной кислоты— только в качестве окислителя. Азотистая же кислота HNO2 и ее соли, где степень окисленности азота равна +3, вступают в реакции как с сильными окислителями, так и с сильными восстановителями. В первом случае HNO2 окисляется до азотной кислоты, во втором — восстанавливается обычно до оксида азота NO2
В качестве примеров окислительно-восстановительной двойственности азотистой кислоты можно привести реакции:
Кроме азотистой кислоты окислительно-восстановительной двойственностью обладают сера, иод, пероксид водорода и ряд других веществ.
Вещества, содержащие элемент в промежуточной степени окисленности, обладают в ряде случаев еще одним характерным свойством. Оно состоит в том, что в определенных условиях такое вещество претерпевает процесс, в ходе которого часть элемента окисляется, а часть — восстанавливается. Этот процесс называется самоокислением-самовосстановлением. Так, при взаимодействии хлора с водой получается смесь соляной и хлорноватистой (HClO) кислот:
Здесь и окисление, и восстановление претерпевает хлор:
Самоокисление-самовосстановление называют также диспропорционированием.
Некоторые сложные вещества в определенных условиях (обычно при нагревании) претерпевают внутримолекулярное окисление-восстановление. При этом процессе одна составная часть вещества служит окислителем, а другая — восстановителем. Примерами внутримолекулярного окисления-восстановления могут служить многие процессы термической диссоциации. Так, в ходе термической диссоциации водяного пара
кислород окисляется (его степень окисленности возрастает от —2 до 0), а водород восстанавливается (его степень окисленности уменьшается от +1 до 0).
Другим примером может служить реакция разложения нитрита аммония, применяемая в лабораторной практике для получения чистого азота:
Что такое двойственность в химии
Билет №1. Химическая система. Вещество и химические превращения. Химический элемент. Простое и сложное вещество. Основные свойства химических систем. Химическая двойственность. Типы химических реакций.
Химическая система – совокупность микро и макро количеств веществ, способных воздействием внешних факторов (условий) к превращениям с образованием новых химических соединений.
Любое вещество состоит из структурных единиц – атомов, молекул, ионов.
Атом – наименьшая частица химического элемента, носитель его свойств. Является самой простой электро енйтральной химической микросистемой, подчиняющейся законам квантовой механики.
Химический элемент – совокупность атомов с одинаковым зарядом ядра (пример: 63 Сu и 65 Сu – изотопы).
Молекула – наименьшая частица химического вещества, способная к самостоятельному существованию как единая динамическая система, состоящая из положительно заряженных ядер и отрицательно заряженных электронов (пример: 2Cl — 2e->Cl 2 ).
Сложные вещества – молекулы состоят из атомов разных химических элементов (примеры: LiH, NaF).
Химические превращения – такие превращения, при которых происходят изменения только во внешних электронных слоях атомов, не затрагивая внутренние слои и ядра.
Основные признаки химических привращений:
Свойство веществ проявлять различные свойства в зависимости от условий среды называется химической двойственностью (пример: амфотерность Al(OH) 3 )
Типы химических реакций:
Билет №1. Химическая система. Вещество и химические превращения. Химический элемент. Простое и сложное вещество. Основные свойства химических систем. Химическая двойственность. Типы химических реакций
Билет №1. Химическая система. Вещество и химические превращения. Химический элемент. Простое и сложное вещество. Основные свойства химических систем. Химическая двойственность. Типы химических реакций.
Химическая система – совокупность микро и макро количеств веществ, способных воздействием внешних факторов (условий) к превращениям с образованием новых химических соединений.
Любое вещество состоит из структурных единиц – атомов, молекул, ионов.
Атом – наименьшая частица химического элемента, носитель его свойств. Является самой простой электро енйтральной химической микросистемой, подчиняющейся законам квантовой механики.
Химический элемент – совокупность атомов с одинаковым зарядом ядра (пример: 63Сu и 65Сu – изотопы).
Молекула – наименьшая частица химического вещества, способная к самостоятельному существованию как единая динамическая система, состоящая из положительно заряженных ядер и отрицательно заряженных электронов (пример: 2Cl—2e->Cl2).
Ионы – частицы реального вещества (одно или много атомные), несущие на себе электрический заряд (пример: простые – H+, Na+, Сu2+; сложные – NH4+, SO42-).
Простые вещества – молекулы состоят из атомов одного и того же элемента (пример: металлы и неметаллы атомного строения – Cu, Ag, C, Si; неметаллы молекулярного строения – J2, Br2, O2).
Сложные вещества – молекулы состоят из атомов разных химических элементов (примеры: LiH, NaF).
Химические превращения – такие превращения, при которых происходят изменения только во внешних электронных слоях атомов, не затрагивая внутренние слои и ядра.
Основные признаки химических привращений:
Выделение газа. Образование осадка. Выделение или поглащение теплоты Q. Изменение цвета как результат изменения электронного стороения или степени окисления элементов в молекулах.
Свойство веществ проявлять различные свойства в зависимости от условий среды называется химической двойственностью (пример: амфотерность Al(OH)3)
Типы химических реакций:
Разложения – реакции при которых из одного вещества происходит образование нескольких веществ (пример: 2HgO=2Hg+O2). Cоединения – оброазование из нескольких веществ одного (пример: H2+I2=2HI). Обмена – реагирующие вещества обмениваются составными частями (пример: CaO+2HCl=CaCl2+H2O). Частным случаем является реакции нейтрализации – взамодействие кислот с основаниями. Замещения – простое вещество вытесняет из простое из сложного (пример: Fe+2HCl=FeCl2+H2). К особому типу относятся окислительно-восстановительные реакции, сочетающие в себе все или отдельные вышеперечисленные типы реакций.
Билет №2. Электронное строение атома, квантовые числа, типы орбиталей. Порядок заполнения энергетических уровней и подуровней (минимум энергии, принцип Паули, правило Хунда, правило Клечковского, вырожденные орбитали). Электронные формулы элементов. Формулы в виде энергетических ячеек. Валентность элемента для основного и возбужденного состояний атома.
Атом – наименьшая частица химического элемента, носитель его свойств. Является самой простой электро енйтральной химической микросистемой, подчиняющейся законам квантовой механики.
Для электрона в атоме справедлив принцип двойственности: электрон является одновременно и материальной частицей малой массы и электромагнитной волной.
Принцип неопределнности Гейзенберга: В каждый конкретный момент времени нельзя с одинаковой точностью определить место нахождения электронов (координаты x, y,z) и его скорость (или импульс).
Движение электорона в атоме может быть представлено в виде электронного облака.
Область электронного облака, в которой электрон проводит более 95% времени нывается электронной орбиталью (Э. О.). Больший размер орбитали характеризует большую энергию электрона. Орбитали близкого размера образуют энергетические уровни, которые состоят из подуровней.
Для описания состояния электрона в атоме используются 4 квантовых числа (n, l,m, s). Первые три соответствуют трем степеням свободы электрона в трехмерном пространстве, а четвертое соответсвует вероятности вращения электрона вокруг воображаемой собственной оси. Квантовые числа:
“n” – главное квантовое число. Характеризует уровень энергии электрона в поле атома (удаленность от ядра). Математическая зависимость энергии связи с ядром: Ea=-13,6/n2 Эв, n=1,2,… Для реальных элементов n=1,…,7. n=номеру периода. “l” – орбитальное квантовое число. Характризует тип подуровня (форма электронного облака). l=0,1,2,…,(n-1). Обозначается буквами. При этом l=0 соответствует s, 1-p, 2-d, 3-f, 4-q, 5-h. “m” – магнитное квантовое число. Характеризует пространственное расположение орбитали. m=± 0, ± 1, ± 2,…, ± l. Cумма орбиталей на подуровне: å =2l+1. “s” – спиновое квантовое число. Характеризует вероятность вращения электрона вокруг своей оси в двух противоположенных направлениях. s=± 1/2. “+” – по часовой стрелке, “-“ – против часовой стрелке. Вращение сообщает электрону собственный магнитный момент, который называется спином электрона.
Принцип Паули (запрет): у атомов, имеющих больше одного электрна не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. Или так: на одной орбитали могут находится только два электрона, причем с противоположенными спинами.
Принцип минимума энергии: последовательное заполенние электронов в атоме должно отвечать как минимому энергии самого электрона, так и минимому энерги атома в целом. Или так: минимум энергии соответствует максимому устойчивости. Заполение идет в соответсвии с уравнением энергии орбитали: ns 1,5 – металл; 1,5 2 – неметаллы. По Полингу абсолютная Э. О. определяется как (Еион+Еср)/z. На практике используется
Билет №4. Химическая связь. Основные виды (ковалентная, ионная, донорно-акцепторная, водородная и металлическая) и характеристики (энергия, длина, направленность, полярность и Поляризуемость) химической связи. Взаимосвязь вида, свойств химической связи и электроотрицательности элементов. Свойства химической связи, состав и строение молекул. Степень окисления. Межмолекулярные взаимодействия. Структурные формулы молекул и ассоциатов.
Виды химической связи:
Ковалентная связь – связь атомов за счет обществления электронной пары с антипараллельными спинами. Ковалентная неполярная связь возникает между неметаллами, разность электроотрицательности между которыми невелика: 0 2 (пример: NaCl Э. О.(Na)=0,9; Э. О.(Cl)=3,1; D Э. О.=2,2). Водородная связь – связь, обусловленная положительно поляризованным водородом в молекуле и электроотрицательным атомом другой или той же молекулы. Металлическая связь – связь, обусловленная электростатическим взаимодействием между обобществленными делокализованными валентными электронами и положительно заряженными катионами в узлах кристаллической решетки.
Основные характеристики ковалентной связи:
Механизм возникновения ковалентной связи:
Обменный – механизм возникновения ковалентной связи путем обобществления неспаренных электронов других атомов. Донорно-акцепторный – механизм возникновения ковалентной связи, при котором один атом, имеющий неподеленную электронную пару (донор), предоставляет ее свободную орбиталь другого атома (акцептор).
К межмолекулярным взаимодействиям относятся: ориентационные – диполь-диполь; индукционные – диполь-не диполь и дисперсионные – за счет микродиполей.
Билет №5. Энергетика химических процессов. Тепловой эффект и энтальпия реакции. Законы термохимии. Энтальпия образования химических соединений. Энтропия. Энергия Гиббса, ее связь с направлением химических процессов. Расчет термодинамических функций химических реакций по справочным данным. Оценка реакционной способности и устойчивости веществ.
Энергетика химических процессов – часть химической термодинамики (часть общей термодинамики).
Энергетическое состояние химической реакции как системы описывается с использованием следующих характеристик: U-внутренняя энергия, H-энтальпия, S-энтропия, G-энергия Гиббса.
Теплота, которую получает система, идет на приращение внутренней энергии и совершение работы: Q=D U+A. Если система не совершает никакой работы, кроме работы расширения, то Q=D U+pD V. Величина D H=D U+pD V при p=const называется энтальпией реакции. Т. к. внутреннюю энергию тела измерить невозможно (можно измерить только изменение D U), то точно так же невозможно измерить энтальпию тела – в расчетах используется изменение энтальпии D H.
Стандартной энтальпией образования называется изобарный тепловой эффект реакции получения одного моля сложного вещества из простых веществ, взятых в их наиболее устойчивой форме при стандартных условиях (T=298К, p=1 атм., С=1 моль/л). Энтальпия образования простых веществ в их устойчивом состоянии при стандартных условиях принимается равной 0.
Лавуазье-Лапласа: тепловой эффект образования химических соединений равен, но обратен по знаку тепловому эффекту его разложения. Гесса: тепловой эффект реакции при постоянном давлении или объеме зависит только от начального и конечного состояния системы и не зависит от пути перехода.
Энтропия – количественная мера беспорядка системы. Имеет статистический смысл и является характеристикой систем, состоящих из достаточно большого, но ограниченного числа частиц. Энтропия выражается через термодинамическую вероятность системы – числа микросостояний, соответствующих данному микросостоянию. Принято, что при абсолютном нуле энтропия идеального кристалла равна 0. Так же принято, что для гидротированного протона H+ абсолютное значение энтропии в водном растворе равно 0. Энтропия зависит от: от числа частиц в системе, от природы вещества, от агрегатного состояния. Для химических реакций изменение энтропии рассчитывается по абсолютным значениям энтропии компонентов. Для реакций, протекающих в водном растворе, расчет производится по краткой ионной формуле. Для газообразных веществ знак D S определяется по изменению объема. Если объем не изменяется, то знак определить нельзя. В изолированных системах возможны процессы, которые идут с увеличением энтропии. Это означает, что знак D S можно принять за критерий возможного самопроизвольного протекании реакции (только в изолированных системах!). В общем случае в открытых системах данный критерий применять нельзя.
Суммарное влияние энергетических и энтропийных факторов при постоянном давлении и температуре отражает изменение изотермического потенциала, который называется изменением свободной энергии Гиббса: D G=D H-TD S. Свободной энергией Гиббса называется энергия, складываемая из энергий химических связей. Знак D G есть критерий термодинамической вероятности самопроизвольного протекания процесса в данных условиях (p, T=const). При данных условиях могут самопроизвольно протекать только те процессы D G для которых меньше 0. Из уравнения видно, что можно определить направление процесса при любой температуре, но данный расчет приблизителен, т. к. не учитывается температурная зависимость энтальпии и энтропии. При низких температурах протекают главным образом экзотермические реакции. При высоких температурах главную роль играет энтропийный член уравнения, что видно на примере того, что реакции разложения сложных веществ на простые в основном протекают при высокой температуре.
Стандартной энергией Гиббса вещества называется энергия получения данного вещества при стандартных условиях. Стандартных условий на практике не существует, поэтому все расчеты с применением стандартных значений – приблизительные.
Билет №6. Химическое равновесие. Химический потенциал и его свойства. Активность. Коэффициент активности неэлектролита и электролита. Закон действия масс. Термодинамическая и концентрационная константы равновесия. Химическое равновесие в гетерогенных системах. Закон Бертло-Нернста. Произведение растворимости. Гидролиз. Смещение равновесия диссоциации воды в растворах электролитов. Гидролиз по катиону и аниону: изменение характера среды. Константа и степень гидролиза. Принцип Ле Шателье.
Химическое равновесие – такое состояние системы, что при некоторой температуре энтальпийный и энтропийный факторы совпадают, т. е D H=TD S. В этом случае D G=0 – условие термодинамического равновесия. При термодинамическом равновесии скорость в прямом направлении равна скарости в обратном.
Активность “A” вещества – функция, определяющая свойства реальных растворов, имеющая размерность концентрации и связанная с ней следующими соотношениями: a=C*y=Cm*t=X*f, где
Закон действия масс – выражение конкретных условий состояния химического равновесия, т. е математическое выражение константы равновесия.
Если в системе протекает реакция n aA+n bB n cC+n dD, то Ka=(acn cadn d)/(aan aabn b)-термодинамическая константа равновесия; Kp=(pcn cpdn d)/(pan apbn b) – концентрационная константа равновесия; Kc=(ccn ccdn d)/(can acbn b). Термодинамическая константа равновесия не зависит от состава системы, а определяется лишь природой вещества и температурой. В общем случае Ka¹ Kp¹ Kc, но в предельно разбавленных растворах данное соотношение может нарушаться. Энергия Гиббса связана с константой равновесия соотношением D G=-RTlnK.
Принцип Ле Шателье: если на систему, находящуюся в равновесии оказывают воздействие извне, то равновесие смещается в сторону той реакции (прямой или обратной), которая ослабляет это воздействие.
Факторы, оказывающее влияние на реакцию:
Изменение концентрации. Увеличении концентрации исходных веществ вызывает увеличение скорости и соответственно увеличение концентрации продукта – происходит смещение равновесия вправо. Через некоторое время равновесие вновь устанавливается и отношение концентраций продуктов и исходных веществ остается неизменным. Изменение температуры. В экзотермической реакции повышение температуры смещает равновесие влево, т. е в сторону эндотермической реакции и наоборот. В эндотермической реакции повышение температуры смещает равновесие вправо. Увеличение давления. Увеличение давления смещает равновесие в сторону той реакции, которая сопровождается уменьшением числа молей газа.
Гидролиз – взаимодействие солей с водой. В результате протекания процесса гидролиза соли в растворе появляется избыток H+ и OH-, сообщающий раствору кислотные или основные свойства. Гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой (например HCl). В результате гидролиза соли, образованной слабой кислотой и сильным основанием появляется некоторое избыточное количество гидроксид-ионов, в результате чего среда становится основной. Гидролиз соли, образованной сильной кислотой и слабым основанием приводит к появлению избытка протонов, в результате чего среда становится кислой.
Билет №7. Химическая кинетика. Скорость химической реакции и закон действия масс. Порядок и молекулярность реакции. Кинетическое уравнение реакции первого порядка. Зависимость скорости реакции от температуры. Уравнение Аррениуса. Энергия активации. Катализ.
Химическая кинетика изучает скорость и механизм протекания химических процессов, а так же их зависимость от различных факторов.
Скоростью химических реакций называется изменение концентрации за единицу времени. Т. к. концентрация непрерывно меняется во времени, то и скорость непрерывно меняется во времени.
Факторы, влияющие на скорость реакции:
Природа реагирующих веществ. Необходимым, но недостаточным условием осуществления химического взаимодействия между частицами является их столкновение. Взаимодействие происходит лишь в том случае, если частицы приближаются на расстояние, на котором становится возможным перераспределение электронной плотности. Следовательно частица должна обладать некоторой энергией для преодоление энергетического барьера другой частицы, которая называется энергией активации Ea. Для атомов – это энергия отталкивания между электронными облаками, для молекул – энергия разрыва связей. Однако для большинства молекул реакция протекает через образование так называемого активированного комплекса. При обычных условиях достаточно быстро протекают реакции с Ea ПР – то комплекс может быть разрушен.
Билет №12. Электрохимические процессы. Окислительно-восстановительные реакции. Окислители и восстановители. Методы составления уравнений ОВР. Направление реакций ОВР. Двойной электрический слой, электродный потенциал, гальванический элемент, электродвижущая сила. Уравнение Нернста.
В основе электрохимических процессов лежат ОВР.
Электрохимический процесс – процесс взаимного превращения химической и электрической форм энергии.
ОВР можно осуществить двумя способами:
1. Химический способ: электроны от восстановителя прямо переходят к окислителю, при этом химическая энергия превращается в тепловую.
2. Электроны от восстановителя переходят к окислителю через внешнюю электрическую цепь направленно. Процессы окисления и восстановления пространственно разделены. Химическая энергия частично превращается в электрическую.
Гальванический элемент – химический источник тока.
В схеме электролита слева указывается анод. На аноде идет процесс окисления
Что такое двойственность в химии
Так, азот образует соединения, в которых степень его окислен-иости изменяется от —3 (аммиак и соли аммония) до 



В качестве примеров окислительно-восстановительной двойственности азотистой кислоты можно привести реакции:
Кроме азотистой кислоты окислительно-восстановительной двойственностью обладают сера, иод, пероксид водорода и ряд других веществ.
Вещества, содержащие элемент в промежуточной степени окисленности, обладают в ряде случаев еще одним характерным свойством. Оно состоит в том, что в определенных условиях такое вещество претерпевает процесс, в ходе которого часть элемента окисляется, а часть — восстанавливается. Этот процесс называется самоокислением-самовосстановлением. Так, при взаимодействии хлора с водой получается смесь соляной и хлорноватистой 
Здесь и окисление, и восстановление претерпевает хлор:
Самоокисление-самовосстановление называют также диспропорционированием.
Некоторые сложные вещества в определенных условиях (обычно при нагревании) претерпевают внутримолекулярное окисление-восстановление. При этом процессе одна составная часть вещества служит окислителем, а другая — восстановителем. Примерами внутримолекулярного окисления-восстановления могут служить многие процессы термической диссоциации. Так, в ходе термической диссоциации водяного пара
кислород окисляется (его степень окисленности возрастает от —2 до 0), а водород восстанавливается (его степень окисленности уменьшается от 
Другим примером может служить реакция разложения нитрита аммония, применяемая в лабораторной практике для получения чистого азота:
Здесь ион