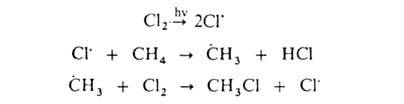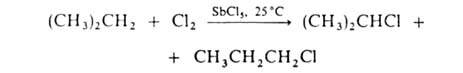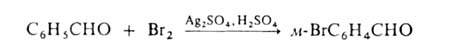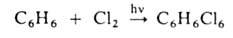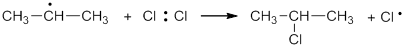Что такое галогенирование в химии
ГАЛОГЕНИРОВАНИЕ
ГАЛОГЕНИРОВАНИЕ (галоидирование), введение галогена в молекулу орг. соединения. Осуществляют путем р-ций замещения (заместительное галогенирование) или присоединения (присоединительное галогенирование).
Заместительное галогенирование. При действии галогенов на насыщ. углеводороды (металепсия) процесс протекает при инициировании светом по свободнорадикальному цепному механизму, напр.:
По свободнорадикальному механизму идет также галогенирование углеводородных цепей жирноароматич. соединений. В присут. к-т Льюиса р-ция протекает по электроф. механизму, напр.:
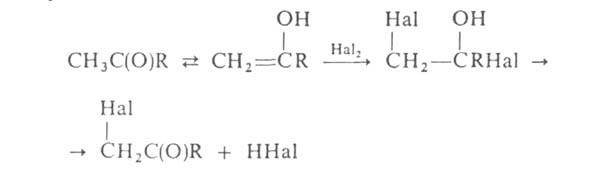
Галогенирование алифатич. карбоновых к-т в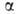
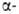
Замещение атомов Н на F с образованием полифторзамешенных соед. проводят путем электрохим. фторирования в безводном HF (р-ция Саймонса), действием CoF3 и др.
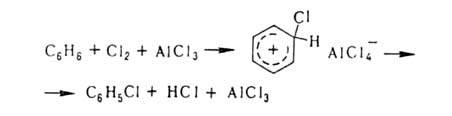
Заместительное галогенирование в ядро ароматич. и гетероароматич. соед. протекает по механизму электроф. замещения; обычно его осуществляют с использованием катализаторов (гл. обр. апротонных или протонных к-т), напр.:
Если в ядре этих соед. присутствуют пассивирующие заместители, процесс можно проводить действием катиона галогена, образующегося из молекулярного галогена и соли Ag в среде сильной протонной к-ты (р-ция Биркенбаха-Губо-Уотерса), напр.:
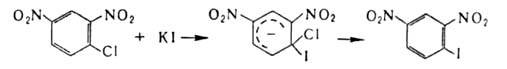
В ароматич. ряду для получения галогензамсщеиных используют замену групп NH2 на С1, Вr или I каталитич. разложением соответствующих солей диазония в присут. порошка Сu (Гаттермана-Коха реакция)или действием солей Сu (Зандмепера реакция), а на F-разложением гидрофторидов диазония (Шимана реакция). Для галогенирования ароматич. и гетероароматич. соед. используют также р-цию замещения (в т.ч. обмен галогенов), протекающую по механизму присоединения-отщепления с промежут. образованием анионных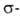
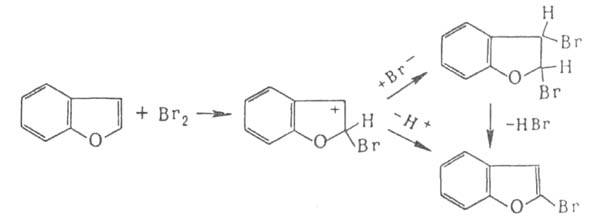
Присоединительное галогенирование. К ароматич. и гете-роароматич. соед. галоген присоединяется, как правило, по радикальному механизму под действием света или при нагр., напр.:
Если цикл активирован, р-ция может протекать по ионному механизму, к-рый включает стадию присоединения аниона галогена к промежуточно образующемуся в процессе электроф. замещения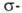
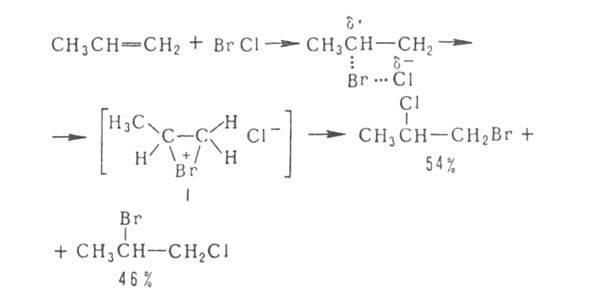
Присоединение галогенов по кратной связи происходит по электроф. или радикальному механизму. Его можно осуществлять действием галогсноводородов (см. Гидрогалогенирование), межгалогенных соед. (напр., ClBr, СП) или гипогалогенитов. В случае электроф. присоединения может нарушаться правило Марковникова, что обусловлено образованием промежут. мостикового катиона ф-лы I, напр.:
Иногда галогенирование (заместительное и присоединительное) проводят действием галогеноводородов (НС1 или НВr) и окислителя (т. наз. окислительное галогенирование). Р-цию осуществляют в жидкой или газовой фазе (окислители соотв. Н2О2 и О2) в присут. соли Си на пемзе. См. также Галоформная реакция, Фторирование органических соединений.
===
Исп. литература для статьи «ГАЛОГЕНИРОВАНИЕ» : Тереитьев А. П., Яновская Л. А., в кн.: Реакции и методы исследования органических соединений, кн. 6, М., 1957, с. 7-342; Кнунянц И. Л., Сокольский Г. А., там же, с. 343-87; Бюлер К., Пирсон Д., Органические синтезы, пер. с англ.. М., 1973, с. 374-468; Эфрос Л. С, Горелик М. В., Химия и технология промежуточных продуктов. Л., 1980; Чамберс Р. Д., Джеймс С. Р, в кн.: Общая органическая химия, пер. с англ., т. 1, М., 1981, с. 622-719. Л. И. Беленький
Страница «ГАЛОГЕНИРОВАНИЕ» подготовлена по материалам химической энциклопедии.
ГАЛОГЕНИРОВАНИЕ
Смотреть что такое «ГАЛОГЕНИРОВАНИЕ» в других словарях:
ГАЛОГЕНИРОВАНИЕ — органических соединений введение в эти соединения атомов галогенов. Широко (особенно хлорирование и фторирование) применяется для получения растворителей, хладонов, полимеров, красителей и др … Большой Энциклопедический словарь
галогенирование — сущ., кол во синонимов: 1 • галогенация (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
ГАЛОГЕНИРОВАНИЕ — (галоидирование), введение галогена в молекулу орг. соединения. Осуществляют путем р ций замещения (заместительное Г.) или присоединения (присоединительное Г.). Заместительное галогенирование. При действии галогенов на насыщ. углеводороды… … Химическая энциклопедия
галогенирование — органических соединений, введение в эти соединения атомов галогенов. Широко (особенно хлорирование и фторирование) применяется для получения растворителей, хладонов, полимеров, красителей и др. * * * ГАЛОГЕНИРОВАНИЕ ГАЛОГЕНИРОВАНИЕ… … Энциклопедический словарь
галогенирование — halogeninimas statusas T sritis chemija apibrėžtis Halogeno įjungimas į molekulę, veikimas halogenu. atitikmenys: angl. halogenation rus. галогенирование; галоидирование … Chemijos terminų aiškinamasis žodynas
ГАЛОГЕНИРОВАНИЕ — органич. соединений, введение в эти соед. атомов галогенов. Широко (особенно хлорирование и фторирование) применяется для получения растворителей, хладонов, полимеров, красителей и др … Естествознание. Энциклопедический словарь
галогенирование — галоген ирование, я … Русский орфографический словарь
галогенирование — (2 с), Пр. о галогени/ровании … Орфографический словарь русского языка
галогенирование — галоидирование … Cловарь химических синонимов I
Что такое галогенирование в химии
Химия
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола)
Механизм реакции галогенирования алканов
Механизмом реакции называют детальное описание химической реакции, которое включает элементарные стадии. Галогенирование алканов относится к реакциям цепногосвободнорадикального замещения (SR). Следует вспомнить, что свободный радикал – это атом или группа атомов, имеющих неспаренный (нечетный) электрон.
Общепринятый механизм галогенирования алканов может быть описан тремя основными стадиями:
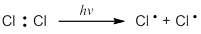
Инициирование (зарождение цепи). Под действием УФ-облучения (ультрафиолетовое облучение) или при нагревании происходит гомолитический разрыв связи в молекуле хлора и она распадается на атомы:
Развитие цепи (цепь последовательных взаимодействий свободных радикалов и неактивных молекул, в результате которых образуются новые молекулы и новые радикалы).
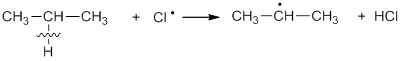
Образовавшиеся на первой стадии радикалы (атомы хлора) атакуют молекулы алканов, отрывая у них атом водорода:
Образовавшиеся алкильные радикалы (в нашем случае это радикал изопропил) сталкиваются с молекулами галогена и гомолитически разрушают их. При этом получаются новые радикалы галогена и образуется алкилгалогенид:
Обрыв цепи (соединении радикалов друг с другом с образованием неактивных молекул).
Столкновение двух короткоживущих частиц маловероятно, но все же оно иногда происходит и приводит к обрыву какой-либо стадии реакции:
В результате последней реакции образуется 2,3-диметилбутан. Это побочный продукт реакции.
Галогенирование алканов – пример цепной реакции. Цепная реакция включает ряд стадий, на каждой из которых образуется реакционноспособная частица, вызывающая следующую стадию.
ГАЛОГЕНИРОВАНИЕ
(галоидирование), введение галогена в молекулу орг. соединения. Осуществляют путем р-ций замещения (заместительное Г.) или присоединения (присоединительное Г.).
Заместительное галогенирование. При действии галогенов на насыщ. углеводороды (металепсия) процесс протекает при инициировании светом по свободнорадикальному цепному механизму, напр.:
По свободнорадикальному механизму идет также Г. углеводородных цепей жирноароматич. соединений. В присут. к-т Льюиса р-ция протекает по электроф. механизму, напр.:
Замещение атомов Н на F с образованием полифторзамешенных соед. проводят путем электрохим. фторирования в безводном HF (р-ция Саймонса), действием CoF3 и др.
Заместительное Г. в ядро ароматич. и гетероароматич. соед. протекает по механизму электроф. замещения; обычно его осуществляют с использованием катализаторов (гл. обр. апротонных или протонных к-т), напр.:
Если в ядре этих соед.присутствуют пассивирующие заместители, процесс можно проводить действием катиона галогена, образующегося из молекулярного галогена и соли Ag в среде сильной протонной к-ты (р-ция Биркенбаха-Губо-Уотерса), напр.:
В ароматич. ряду для получения галогензамсщеиных используют замену групп NH2 на С1, Вr или I каталитич. разложением соответствующих солей диазония в присут. порошка Сu (Гаттермана-Коха реакция )или действием солей Сu ( Зандмепера реакция), а на F-разложением гидрофторидов диазония ( Шимана реакция). Для Г. ароматич. и гетероароматич. соед. используют также р-цию замещения (в т. ч. обмен галогенов), протекающую по механизму присоединения-отщепления с промежут. образованием анионных комплексов, напр.:
Присоединительное галогенирование. К ароматич. и гете-роароматич. соед. галоген присоединяется, как правило, по радикальному механизму под действием света или при нагр., напр.:
Если цикл активирован, р-ция может протекать по ионному механизму, к-рый включает стадию присоединения аниона галогена к промежуточно образующемуся в процессе электроф. замещения комплексу, напр.:
Присоединение галогенов по кратной связи происходит по электроф. или радикальному механизму. Его можно осуществлять действием галогсноводородов (см. Гидрогалогенирование), межгалогенных соед. (напр., ClBr, СП) или гипогалогенитов. В случае электроф. присоединения может нарушаться правило Марковникова, что обусловлено образованием промежут. мостикового катиона ф-лы I, напр.:
Иногда Г. (заместительное и присоединительное) проводят действием галогеноводородов (НС1 или НВr) и окислителя (т. наз. окислительное Г.). Р-цию осуществляют в жидкой или газовой фазе (окислители соотв. Н 2 О 2 и О 2) в присут. соли Си на пемзе. См. также Галоформная реакция, Фторирование органических соединений.
Лит.: Тереитьев А. П., Яновская Л. А., в кн.: Реакции и методы исследования органических соединений, кн. 6, М., 1957, с. 7-342; Кнунянц И. Л., Сокольский Г. А., там же, с. 343-87; Бюлер К., Пирсон Д., Органические синтезы, пер. с англ.. М., 1973, с. 374-468; Эфрос Л. С, Горелик М. В., Химия и технология промежуточных продуктов. Л., 1980; Чамберс Р. Д., Джеймс С. Р, в кн.: Общая органическая химия, пер. с англ., т. 1, М., 1981, с. 622-719. Л. И. Беленький
Галогенирование это химическая реакция который включает добавление одного или нескольких галогены к соединению или материалу. Путь и стехиометрия Степень галогенирования зависит от структурных особенностей и функциональных групп органического субстрата, а также от конкретного галогена. Неорганические соединения, такие как металлы, также подвергаются галогенированию.
Содержание
Органическая химия
Галогенирование по типу реакции
Существует несколько путей галогенирования органических соединений, в том числе: свободнорадикальное галогенирование, галогенирование кетонов, электрофильное галогенирование и реакция присоединения галогена. Кроме того, известны реакции ферментативного галогенирования органических молекул, которые следуют нуклеофильным, электрофильным или свободнорадикальным механизмам. [1] Структура субстрата является одним из факторов, определяющих путь.
Свободнорадикальное галогенирование
Насыщенные углеводороды обычно не добавляют галогены, но подвергаются свободнорадикальному галогенированию, включая замещение атомов водорода галогеном. Региохимия галогенирования алканов обычно определяется относительной слабостью имеющихся связей C – H. Предпочтение реакции в третичных и вторичных положениях обусловлено большей стабильностью соответствующих свободных радикалов и переходного состояния, ведущего к ним. Свободнорадикальное галогенирование используется для промышленного производства хлорированных метанов: [2]
Такие свободнорадикальные реакции часто сопровождаются перегруппировкой.
Добавление галогенов к алкенам и алкинам
Ненасыщенные соединения, особенно алкены и алкины, добавьте галогены:
RCH = CHR ′ + X2 → RCHX – CHXR ′
Присоединение галогенов к алкенам происходит через промежуточные ионы галония. В особых случаях такие промежуточные соединения были изолированы. [3]
Галогенирование ароматических соединений
Электрофильному галогенированию подвержены ароматические соединения: [4]
Потому что фтор является очень реактивным, описанный выше протокол не будет эффективным, поскольку ароматическая молекула будет реагировать деструктивно с F2. Поэтому другие методы, такие как Реакция Бальца – Шимана, необходимо использовать для приготовления фторированных ароматических соединений.
Другие методы галогенирования
в Реакция Хунсдикераиз карбоновых кислот превращаются в галогенид с укороченной цепью. Карбоновая кислота сначала превращается в соль серебра, которая затем окисляется галогеном:
В Реакция Сандмейера используется для получения арилгалогенидов из соли диазония, которые получаются из анилины.
в Галогенирование Ада – Фольгарда – Зелинского, карбоновые кислоты являются альфа-галогенированными.
В оксихлорированиекомбинация хлористого водорода и кислорода служит эквивалентом хлора, как показано на следующем пути к дихлорэтану:
Галогенирование по типу галогена
На возможность галогенирования влияет галоген. Фтор и хлор более электрофильный и являются более агрессивными галогенирующими агентами. Бром является более слабым галогенирующим агентом, чем фтор и хлор, в то время как йод наименее реактивен из всех. Установка дегидрогалогенирования следует обратной тенденции: йод легче всего удаляется из органических соединений, а фторорганические соединения очень стабильны.
Фторирование
Органические соединения, как насыщенные, так и ненасыщенные, легко, обычно взрывоопасно, реагируют с фтором. Фторирование элементарным фтором (F2) требует узкоспециализированных условий и аппаратуры. Многие коммерчески важные органические соединения подвергаются электрохимическому фторированию с использованием фтороводород как источник фтора. Метод называется электрохимическое фторирование. Помимо F2 и его электрохимически генерируемый эквивалент, различные фторирующие реагенты известны такие как дифторид ксенона и фторид кобальта (III).
Хлорирование
Хлорирование обычно очень экзотермический. Как насыщенные, так и ненасыщенные соединения вступают в непосредственную реакцию с хлором, причем для первого обычно требуется ультрафиолетовый свет гомолиз хлора. Хлорирование проводится в промышленных масштабах; основные процессы включают пути к 1,2-дихлорэтан (предшественник ПВХ), а также различные хлорированные этаны в качестве растворителей.
Бромирование
Бромирование более селективный чем хлорирование, потому что реакция меньше экзотермический. Чаще всего бромирование проводят добавлением Br2 к алкены. Примером бромирования является органический синтез анестетика галотан от трихлорэтилен: [6]
Броморганические соединения являются наиболее распространенными галогенидами в природе. Их образование катализируется ферментом бромпероксидаза который использует бромид в сочетании с кислородом в качестве окислителя. По оценкам, в океаны ежегодно выделяется 1-2 миллиона тонн бромоформа и 56 000 тонн бромметана. [7]
Йодирование
Йод является наименее реакционноспособным галогеном и не реагирует с большинством органических соединений. Добавление йода к алкенам лежит в основе аналитического метода, называемого йодное число, мера степени ненасыщенности для жиры. В йодоформная реакция вовлекает разложение метилкетонов.