Что такое гаптен свойства и особенности взаимодействия с иммунной системой
Как устроен иммунитет: Объясняем по пунктам
Андрей Смирнов СПИД.ЦЕНТР
«Йогурт для укрепления иммунитета», «Иммуностимулирующие витамины», «Да простудился, наверное, иммунитет упал»… Мы слышим слово «иммунитет» так часто, что уже почти не задумываемся, как он устроен и работает. На уроках биологии нам рассказывали, что иммунитет защищает от микробов, но только ли этим ограничивается его функция и как именно он понимает, от кого нужно нас защищать? СПИД.ЦЕНТР объясняет, как устроена иммунная система.
Наш организм непрерывно меняется, но при этом очень «любит» постоянство и может нормально работать только при определенных параметрах своей внутренней среды. Например, нормальная температура тела колеблется между 36 и 37 градусами по Цельсию. Вспомните последнюю простуду и то, как плохо вы себя чувствовали, стоило температуре подняться всего на полградуса. Такая же ситуация и с другими показателями: артериальным давлением, рН крови, уровнем кислорода и глюкозы в крови и другими. Постоянство значений этих параметров называется гомеостазом, а поддержкой его стабильного уровня занимаются практически все органы и системы организма: сердце и сосуды поддерживают постоянное артериальное давление, легкие — уровень кислорода в крови, печень — уровень глюкозы и так далее.
Иммунная же система отвечает за генетический гомеостаз. Она помогает поддерживать постоянство генетического состава организма. То есть ее задача — уничтожать не только все чужеродные организмы и продукты их жизнедеятельности, проникающие извне (бактерии, вирусы, грибки, токсины и прочее), но также и клетки собственного организма, если «что-то пошло не так» и, например, они превратились в злокачественную опухоль, то есть стали генетически чужеродными.
Как клетки иммунной системы уничтожают «врагов»?
Чтобы разобраться с этим, сначала нужно понять, как иммунная система устроена и какие бывают виды иммунитета.
Иммунитет бывает врожденным (он же неспецифический) и приобретенным (он же адаптивный, или специфический). Врожденный иммунитет одинаков у всех людей и идентичным образом реагирует на любых «врагов». Реакция начинается немедленно после проникновения микроба в организм и не формирует иммунологическую память. То есть, если такой же микроб проникнет в организм снова, система неспецифического иммунитета его «не узнает» и будет реагировать «как обычно». Неспецифический иммунитет очень важен — он первым сигнализирует об опасности и немедленно начинает давать отпор проникшим микробам.
по теме
Мнение
«Иммунитет пациента с ВИЧ похож на иммунитет пожилого человека»
Однако эти реакции не могут защитить организм от серьезных инфекций, поэтому после неспецифического иммунитета в дело вступает приобретенный иммунитет. Здесь уже реакция организма индивидуальна для каждого «врага», поэтому «арсенал» специфического иммунитета у разных людей различается и зависит от того, с какими инфекциями человек сталкивался в жизни и какие прививки делал.
Специфическому иммунитету нужно время, чтобы изучить проникшую в организм инфекцию, поэтому реакции при первом контакте с инфекцией развиваются медленнее, зато работают гораздо эффективнее. Но самое главное, что, один раз уничтожив микроба, иммунная система «запоминает» его и в следующий раз при столкновении с таким же реагирует гораздо быстрее, часто уничтожая его еще до появления первых симптомов заболевания. Именно так работают прививки: когда в организм вводят ослабленных или убитых микробов, которые уже не могут вызвать заболевание, у иммунной системы есть время изучить их и запомнить, сформировать иммунологическую память. Поэтому, когда человек после вакцинации сталкивается с реальной инфекцией, иммунная система уже полностью готова дать отпор, и заболевание не начинается вообще или протекает гораздо легче.
Кто отвечает за работу различных видов иммунитета?
Таким образом, органы иммунной системы обеспечивают образование, созревание и место для жизни иммунных клеток. В нашем организме есть много их видов, вот основные из них.
Как клетки иммунной системы отличают «своих» от «чужих» и понимают, с кем нужно бороться?
В этом им помогает главный комплекс гистосовместимости первого типа (MHC-I). Это группа белков, которая располагается на поверхности каждой клетки нашего организма и уникальна для каждого человека. Это своего рода «паспорт» клетки, который позволяет иммунной системе понимать, что перед ней «свои». Если с клеткой организма происходит что-то нехорошее, например, она поражается вирусом или перерождается в опухолевую клетку, то конфигурация MHC-I меняется или же он исчезает вовсе. Натуральные киллеры и Т-киллеры умеют распознавать MHC-I рецептор, и как только они находят клетку с измененным или отсутствующим MHC-I, они ее убивают. Так работает клеточный иммунитет.
по теме
Эпидемия
Учёные выяснили, как вирусы обманывают иммунитет
Но у нас есть еще один вид иммунитета — гуморальный. Основными защитниками в этом случае являются антитела — специальные белки, синтезируемые B-лимфоцитами, которые связываются с чужеродными объектами (антигенами), будь то бактерия, вирусная частица или токсин, и нейтрализуют их. Для каждого вида антигена наш организм умеет синтезировать специальные, подходящие именно для этого антигена антитела. Молекулу каждого антитела, также их называют иммуноглобулинами, можно условно разделить на две части: Fc-участок, который одинаков у всех иммуноглобулинов, и Fab-участок, который уникален для каждого вида антител. Именно с помощью Fab-участка антитело «прилипает» к антигену, поэтому строение этого участка молекулы зависит от строения антигена.
Как наша иммунная система понимает устройство антигена и подбирает подходящее для него антитело?
Рассмотрим этот процесс на примере развития бактериальной инфекции. Например, вы поцарапали палец. При повреждении кожи в рану чаще всего попадают бактерии. При повреждении любой ткани организма сразу же запускается воспалительная реакция. Поврежденные клетки выделяют большое количество разных веществ — цитокинов, к которым очень чувствительны нейтрофилы и макрофаги. Реагируя на цитокины, они проникают через стенки капилляров, «приплывают» к месту повреждения и начинают поглощать и переваривать попавших в рану бактерий — так запускается неспецифический иммунитет, но до синтеза антител дело пока еще не дошло.
Расправляясь с бактериями, макрофаги выводят на свою поверхность разные их кусочки, чтобы познакомить Т-хелперов и B-лимфоцитов со строением этих бактерий. Этот процесс называется презентацией антигена. Т-хелпер и B-лимфоцит изучают кусочки переваренной бактерии и подбирают соответствующую структуру антитела так, чтобы потом оно хорошо «прилипало» к таким же бактериям. Так запускается специфический гуморальный иммунитет. Это довольно длительный процесс, поэтому при первом контакте с инфекцией организму может понадобиться до двух недель, чтобы подобрать структуру и начать синтезировать нужные антитела.
После этого успешно справившийся с задачей B-лимфоцит превращается в плазматическую клетку и начинает в большом количестве синтезировать антитела. Они поступают в кровь, разносятся по всему организму и связываются со всеми проникшими бактериями, вызывая их гибель. Кроме того, бактерии с прилипшими антителами гораздо быстрее поглощаются макрофагами, что также способствует уничтожению инфекции.
Есть ли еще какие-то механизмы?
Специфический иммунитет не был бы столь эффективен, если бы каждый раз при встрече с инфекцией организм в течение двух недель синтезировал необходимое антитело. Но здесь нас выручает другой механизм: часть активированных Т-хелпером В-лимфоцитов превращается в так называемые клетки памяти. Эти клетки не синтезируют антитела, но несут в себе информацию о структуре проникшей в организм бактерии. Клетки памяти мигрируют в лимфатические узлы и могут сохраняться там десятилетиями. При повторной встрече с этим же видом бактерий благодаря клеткам памяти организм намного быстрее начинает синтезировать нужные антитела и иммунный ответ запускается раньше.
Таким образом, наша иммунная система имеет целый арсенал различных клеток, органов и механизмов, чтобы отличать клетки собственного организма от генетически чужеродных объектов, уничтожая последние и выполняя свою главную функцию — поддержание генетического гомеостаза.
Что такое гаптен свойства и особенности взаимодействия с иммунной системой
Инфекция сумма биологических реакций, которыми макроорганизм отвечает на внедрение микробного (инфекционного) агента, вызывающего нарушение постоянства внутренней среды (гомеостаза).
Аналогичные процессы, вызванные простейшими, называются инвазиями.
Сложный процесс взаимодействия между микроорганизмами и их продуктами, с одной стороны, клетками, тканями и органами человека и животных с другой, характеризуется чрезвычайно широким разнообразием своего проявления. Патогенетические и клинические проявления этого взаимодействия между микроорганизмами и макроорганизмом обозначаются термином инфекционная болезнь (заболевание).
Другими словами, понятия «инфекционная болезнь» и «инфекция» абсолютно не равнозначны, заболевание это только одно из проявлений инфекции. Хотя даже в специальной литературе в настоящее время термин «инфекция» достаточно широко употребляется для обозначения соответствующих инфекционных болезней. Например, в выражениях «кишечные инфекции», «воздушнокапельные инфекции. Инфекционные болезни попрежнему наносят огромный ущерб различным биологическим видам.
За последние годы зарегистрировано 38 новых инфекций так называемых эмерджентных болезней, в том числе ВИЧ, геморрагические лихорадки, «болезнь легионеров», вирусные гепатиты, прионные болезни; причем в 40% случаев это нозологические формы, ранее считавшиеся неинфекционными.
Особенности инфекционных болезней состоят в следующем:
1.2. КЛИНИЧЕСКИЕ СТАДИИ ИНФЕКЦИОННОГО ЗАБОЛЕВАНИЯ
В соответствии с этими особенностями любое инфекционное заболевание имеет определенные клинические стадии (периоды) своего течения, выраженные в той или иной степени:
Период разгара заболевания проявление специфических симптомов заболевания. При наличии в этом периоде развития заболевания характерного симптомокомплекса клиницисты называют такое проявление заболевания манифестной инфекцией, а в тех случаях, когда заболевание в этот период протекает без выраженных симптомов, бессимптомной инфекцией. Этот период развития инфекционного заболевания, как правило, сопровождается выделением возбудителя из организма, вследствие чего больной представляет эпидемиологическую опасность для окружающих; данные состояния характеризуются периодом исходов. В этот период возможны:
В учении об инфекции существует также понятие персистентности (инфицированности): микроорганизмы попадают в организм животного и могут существовать в нем, не проявляя себя достаточно долгое время.
Это происходит очень часто с возбудителем туберкулеза.
Отличие бактерионосительства от персистениии:
Кроме перечисленных терминов, существует еще понятие «инфекционный процесс» это ответная реакция организма на проникновение и циркуляцию в нем микробного агента.
Из определения понятия «инфекция» становятся очевидными и факторы, необходимые для ее возникновения и развития:
внешняя среда, в которой они взаимодействуют.
1.3. СВОЙСТВА АНТИГЕНОВ
Иммунный ответ это сложная многокомпонентная, кооперативная реакция иммунной системы организма, индуцированная антигеном и направленная на его элиминацию. Явление иммунного ответа лежит в основе иммунитета.
Иммунный ответ зависит от:
Антигены
Первоначально термин антиген (от англ. Antibodi generator) применяли для обозначения любой молекулы, индуцирующей образование Вклетками специфических антител. Однако теперь этот термин имеет более широкий смысл, обозначая любую молекулу, которую могут специфически распознавать элементы системы приобретенного иммунитета, т.е. Вклетки или Тклетки, либо и те и другие.
Антиген это инициатор и движущая сила всех реакций приобретенного иммунитета. Иммунная система возникла для распознавания и разрушения чужеродных агентов, а также устранения источника их образования бактерий, инфицированных вирусом клеток и т.п. Когда антиген элиминирован, иммунный ответ прекращается.
Антигены вещества различного происхождения, несущие признаки генетической чужеродности и вызывающие развитие иммунных реакций (гуморальных, клеточных, состояние иммунной толерантности, индуцирование иммунной памяти).
Свойства антигена определяются комплексом признаков: иммуногенность, антигенность, специфичность.
Иммуногенность способность антигена индуцировать в организме иммунный ответ.
Антигенность способность антигена взаимодействовать только с гомологичными антителами и лимфоцитами определенного клона.
Специфичность структурные особенности, отличающие один антиген от другого.
Способность вызывать развитие иммунного ответа и определять его специфичность обладает фрагмент молекулы антигена антигенная детерминанта (эпитоп), избирательно реагирующая с антигенраспознающими рецепторами и антителами. Молекула антигена может иметь несколько эпитопов, то есть быть поливалентной. Чем сложнее молекула антигена и чем больше у нее эпитопов, тем больше вероятность развития иммунной ответа.
Иммуногены или полные антигены это вещества, вызывающие полноценный иммунный ответ и обладающие свойствами: иммуногенностью, антигенностью и специфичностью. Иммуногенами являются биополимеры белки, их комплексы с углеводами (гликопротеиды), а также сложные полисахариды, липополисахариды с высокой молекулярной массой. Чем дальше от человека в эволюционном отношении отстоят организмы, тем большую иммуногенность проявляют их белки.
Гаптены неполные антигены, относительно простые вещества, способные участвовать в иммунологических взаимодействиях, но не способные самостоятельно индуцировать иммунный ответ. Гаптены обладают свойствами антигенностью и специфичностью, но не обладают иммуногенностью.
Гаптены после присоединения к крупным, обычно белковым молекулам (носителям), могут приобретать свойства полного антигена.
Толерогены антигены, способные подавлять иммунные реакции с развитием специфической неспособности отвечать на них.
Антигены химические вещества, свободные, либо входящие в состав клеток, способные индуцировать иммунный ответ организма.
Полноценный антиген состоит из двух частей:
Если реализованы оба указанных свойства, то такой антиген называют полноценным, если реализовано только второе свойство, то такой антиген называют неполноценным или гаптеном.
Гаптен может быть фиксирован на специальные носители адьюванты. Механизм действия адьювантов:
АНТИГЕНЫ МИКРООРГАНИЗМОВ
Большинство возбудителей инфекционных заболеваний человека, их структуры и токсины полноценные антигены, вызывающие развитие иммунных реакций.
АНТИГЕНЫ БАКТЕРИЙ
По расположению в бактериальной клетке выделяют антигены:
Капсульный антиген К Ag
Жгутиковый антиген H Ag
Соматический антиген O Ag
ОАг большинства бактерий представлены термостабильным липополисахариднополипептидным комплексом; у грамотрицательных бактерий ОАг представляет эндотоксин.
НАг представлен термолабильным белком флагеллином.
КАг большинства бактерий имеют полисахаридную природу. По чувствительности к темпратуре КАг подразделяются на А, В и Lантигены. Наиболее термостабильными являются ААг, выдерживающие кипячение более 2 часов. ВАг выдерживают нагревание при температуре 60°С в течение часа, а LАг разрушаются при нагревании до 60°С.
Для идентификации выделенных микроорганизмов в лаборатории применяют внутривидовую или внутриродовую дифференциацию микроорганизмов, основанную на различиях в антигенной структуре. При этом символически отображают антигенную структуру бактерий в виде антигенной формулы. Например, антигенную формулу одного из сероваров E. coli, вызывающую колиэнтериты у молодняка раннего возраста обозначают как О55:К5:Н21 (серовар, относящийся к серогруппе О55).
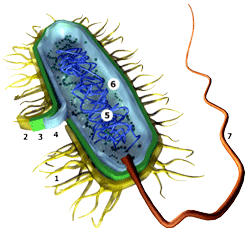
Рис. 1. Антигены бактерий: Оантиген (3 клеточная стенка); Нантиген (7 жгутик); Кантиген (2 капсула).
АНТИГЕНЫ ВИРУСОВ
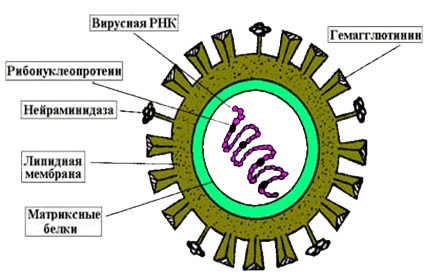
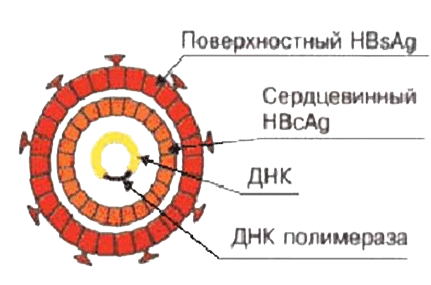
В каждом вирионе любого вируса содержатся различные антигены. Одни из них являются вирусспецифическими. В состав других антигенов входят компоненты клетки хозяина (липиды, углеводы), которые включаются в его внешнюю оболочку. Антигены простых вирионов связаны с их нуклеокапсидами. По своему химическому составу они принадлежат к рибонуклеопротеидам или дезоксирибонуклеопротеидам, которые являются растворимыми соединениями и поэтому обозначаются как Sантигены (solutio раствор). У сложноорганизованных вирионов одни антигенные компоненты связаны с нуклеокапсидами, другие с гликопротеидами внешней оболочки. Многие простые и сложные вирионы содержат особые поверхностные Vантигены гемагглютинин и фермент нейраминидазу.
Рис. 2. Антигены вирусов гриппа (поверхностные (Vантигены) и серцевинные (Sантигены)).
Рис. 3. Антигены вирусов гепатита В (поверхностные (Vантигены) и серцевинные (Sантигены)).
АНТИГЕНЫ ОРГАНИЗМА
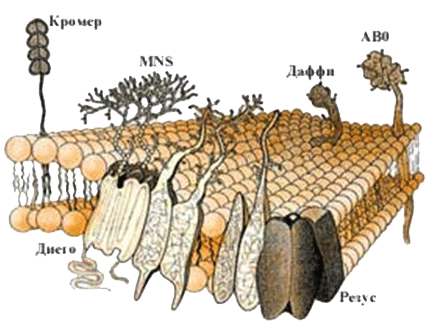
Все ткани и клетки организма обладают антигенными свойствами. Одни антигены специфичны для всех млекопитающих, другие видоспецифичны для человека, третьи для отдельных групп, их называют изоантигенами (например, антигены групп крови). К антигенам, свойственным только данному организму относятся антигены тканевой совместимости.
Изоантигены или групповые антигены это антигены, по которым отдельные индивидуумы или группы особей одного вида различаются между собой.
В эритроцитах, лейкоцитах, тромбоцитах, а также в плазме крови людей открыто несколько десятков изоантигенов.
Изоантигены, генетически связаны, объединены в группы, получившие название: система АВО, резус и др. В основе деления людей на группы по системе АВО лежит наличие или отсутствие на эритроцитах антигенов, обозначенных А и В. В соответствии с этим все люди подразделены на 4 группы. Группа I (О) антигены отсутствуют, группа II (А) в эритроцитах содержится антиген А, группа III (В) эритроциты обладают антигеном В, группа IV (АВ) эритроциты обладают обоими антигенами. Поскольку в окружающей среде имеются микроорганизмы, обладающие такими же антигенами (их называют перекреснореагирующими), у человека имеются антитела к этим антигенам, но только к тем, которые у него отсутствуют. К собственным антигенам организм толерантен. При переливании крови или эритроцитов реципиенту, в крови которых содержатся антитела к соответствующему антигену, в сосудах происходит агглютинация перелитых несовместимых эритроцитов, что может вызвать шок и гибель реципиента.
У части людей эритроциты содержат еще особый антиген, получивший название резусантигена (Rh). По наличию или отсутствию Rhантигена люди разделяются на две группы резус (Rh)положительных и резус (Rh)отрицательных. При переливании крови Rhотрицательному реципиенту, если эритроциты донора содержат Rhантиген, может развиваться гемолитическая желтуха.
Рис. 4. Рецепторы, встроенные в мембрану эритроцита, являются антигенами организма (изоантигены) в том числе антигены А и В системы АВО и резус фактор.
Антигены главного комплекса тканевой (гисто) совместимости.
Помимо антигенов, свойственных всем людям и групповых антигенов, каждый организм обладает уникальным набором антигенов, свойственных только ему самому. Эти антигены кодируются группой генов, находящихся у человека на 6 хромосоме, и называются антигенами главного комплекса тканевой совместимости и обозначаются МНСантигены (англ. Major histocompatibility complex). МНСантигены человека впервые были обнаружены на лейкоцитах и поэтому имеют другое название HLA (Human leucocyte antigens). МНСантигены относятся к гликопротеинам и содержатся на мембранах клеток организма, определяя его индивидуальные свойства и индуцируют трансплантационные реакции, за что они получили третье название трансплантационные антигены. Кроме того, МНСантигены играют обязательную роль в индукции иммунного ответа на любой антиген.
Белки I класса находятся на поверхности практически всех клеток организма. Антигены I класса обеспечивают представление антигенов цитотоксическим CD8+лимфоцитам, а распознавание этого антигена антигенпредставляющим клеткам другого организма при трансплантации приводит к развитию трансплантационного иммунитета.
МНСантигены II класса находятся преимущественно на антигенпредставляющих клетках дендритных, макрофагах, Влимфоцитах. Основная роль в иммуногенезе антигенов II класса участие в представлении чужеродных антигенов Тхелперным лимфоцитам.
© ФГБОУ ВПО «Красноярский государственный аграрный университет»
Что такое гаптен свойства и особенности взаимодействия с иммунной системой
Развитие иммунологического направления в биологических исследованиях психических заболеваний всегда было тесно связано с прогрессом в фундаментальной иммунологии. Оно отражало все этапы развития иммунологии — от первых концепций гуморального иммунитета до современных теорий клеточно-гуморальных взаимодействий при формировании иммунного ответа в организме человека. Здесь мы кратко изложим основные положения современной иммунологии.
СТРОЕНИЕ И ПРИНЦИПЫ ФУНКЦИОНИРОВАНИЯ ИММУННОЙ СИСТЕМЫ ЧЕЛОВЕКА
Иммунологическая функция осуществляется специализированной системой клеток, тканей и органов, которая называется иммунной (рис. 19). Главными особенностями иммунной системы являются ее распространенность по всему организму, постоянная рециркуляция соответствующих иммунных клеток и их способность вырабатывать специфические молекулы — антитела в отношении каждого антигена. Функционирование иммунной системы обеспечивается ее морфологическим субстратом, основными компонентами которого являются центральные и периферические лимфоидные органы, кровеносные и лимфатические сосуды. Все перечисленные компоненты функционируют как единое целое и это единство обеспечивается внутрисистемными связями, генетической обусловленностью и механизмами нейроэндокринной регуляции.
Иммунную систему в морфологическом аспекте можно рассматривать как совокупность лимфоцитов, макрофагов, ряда сходных с макрофагами клеток, включая дендритные клетки и эпителиальные клетки Лангерганса (эпидермоциты белые отростчатые). Клеточные элементы иммунной системы организованы в тканевые и органные структуры, к которым относятся селезенка, лимфатические узлы, групповые лимфатические фолликулы (пейеровы бляшки) кишечника, миндалины, вилочковая железа (тимус) и костный мозг. К иммунной системе относятся также лимфоциты и макрофаги, которые составляют рециркулирующую популяцию иммунных клеточных элементов.
Иммунная реакция может быть неспецифической (неспецифический иммунитет) и специфической (специфический иммунитет).
Неспецифический иммунитет обеспечивает первую линию зашиты от чужеродных частиц и организмов и осуществляется несколькими типами клеток. Например, фагоциты — моноциты крови и тканевые Макрофаги — поглощают и разрушают многие чужеродные частицы. Полиморфно-ядерные лейкоциты вместе с тучными клетками участвуют в защите от микроорганизмов, являясь важнейшими компонентами реакции острого воспаления. Кроме того, еще один класс клеток, названный естественными киллерами (от англ., kill — убивать), обеспечивает первую линию защиты организма, поражая инфицированные вирусами или неопластическим процессом клетки собственного организма. В формировании реакций неспецифического иммунитета важную роль играют так называемые белки острой фазы воспаления и система комплемента.
Специфический иммунитет отличается от неспецифического наличием специфичности, обучаемости и памяти. Как уже говорилось, отдельный лимфоцит имеет на своей поверхности только один тип рецептора (антигенсвязывающего центра) и поэтому отвечает только на один или несколько родственных антигенных структур выработкой антител. Если однажды индивидуум встречался со специфическим антигеном, то соответствующие лимфоциты запоминают его структуру. Повторная встреча с этим же антигеном ведет к тому, что иммунная система вспоминает его и ответ на него бывает более быстрым и сильным. Феномены обучения и памяти осуществляются по законам так называемой клональной селекции. Лимфоцит, который распознает антиген, пролиферирует в клон идентичных клеток, каждая из которых несет на себе рецепторы той же специфичности, т.е. способна продуцировать соответствующие этой специфичности антитела. В последнем случае лимфоциты дифференцируются в антителопродуцирующие плазматические клетки, другие же лимфоциты остаются длительно живущими клетками памяти. Клетки памяти сохраняют готовность активироваться при каждой последующей встрече с идентичным антигеном, оставаясь неактивными («отдыхающими») клетками. В результате последующей активации происходит значительное увеличение числа лимфоцитов, способных распознать данный антиген за счет быстрой и широкой пролиферации лимфоцитов. Таким образом, вторичная иммунная реакция по сравнению с первичной всегда более быстрая и сильная (феномен обучения на уровне клеточных популяций).
Лимфоциты различаются между собой не только по специфичности своих рецепторов, но и по их функциональным свойствам. Согласно последним, различают два основных класса лимфоцитов: В-лимфоциты и Т-лимфоциты. В соответствии с этим различают Т- и В-системы иммунитета. Формирование их происходит по путям, изображенным на рис.19: стволовая кроветворная клетка (СКК), или клетка-предшественник лимфопоэза, мигрируя из костного мозга (КМ) в тимус, или вилочковую железу (ВЖ), дифференцируется под влиянием микроокружения этого органа в Т-клетку. При миграции СКК в сумку Фабрициуса (СФ) у птиц или неизвестный аналог данного органа у млекопитающих происходит дифференцировка в клетки В-ряда. Из центральных органов иммунитета клетки расселяются в периферические органы иммунной системы — селезенку (С), лимфатические узлы (ЛУ) и др., где они приобретают функциональные особенности, свойственные зрелым Т- и В-лимфоцитам (Т,В). Т-лимфоциты представлены киллерами (Тк), Т-супрессорами (Тс) и Т-хелперами (Тх). К зрелым клеточным популяциям относятся также плазмоциты (ПЦ). Конечная клетка В-клеточного пути дифференцировки активно синтезирует и секретирует антитела.
В-лимфоциты происходят из клеток-предшественников костного мозга ( bone marrow ). Место их созревания у человека остается неизвестным. В-лимфоциты являются антителообразующими клетками. Т-лимфоциты, или тимусзависимые лимфоциты, также происходят из клеток-предшественников костного мозга, но затем созревают и дифференцируются в вилочковой железе — тимусе ( thymus ). Т-лимфоциты подразделяются на ряд подклассов. Часть из них опосредуют важные регуляторные функции: «помогают» — хелперы (от англ., help ) или «подавляют» — супрессоры (от англ., supress ) развитие иммунного ответа, в том числе и образование антител. Т-лимфоциты выполняют также эффекторные функции, например вырабатывают растворимые вещества, запускающие разнообразные воспалительные реакции, или осуществляют прямое разрушение клеток, несущих на себе антигены (киллерная функция). В соответствии с этим различают следующие подклассы Т-лимфоцитов: Т-хелперы, Т-супрессоры, Т-киллеры и Т-клетки, участвующие в реакции замедленной гиперчувствительности и связанных с нею иммунологических явлениях.
На мембранах зрелой В-клетки имеются рецепторы для антигена. При связывании антигена с этими рецепторами клетка активируется. Для такой активации обычно нужно, чтобы В-клетка одновременно со связыванием антигена вступила во взаимодействие со специфической хелперной Т-клеткой или чтобы последняя синтезировала растворимые факторы роста и дифференцировки. В противном случае, когда связывание антигена не сопровождается поступлением сигналов от растворимых факторов роста или от хелперных Т-клеток, может произойти инактивация В-лимфоцита, т.е. может развиться состояние иммунологической толерантности.
Иммунологическая толерантность представляет собой явление, обратное иммунному ответу. Она является, в частности, основой для понимания того, почему иммунная система в норме не развивает иммунный ответ против антигенов собственного организма (аутоантигенов): иммунная система находится в состоянии толерантности по отношению к антигенам клеток и тканей данного организма («своих» антигенов). Вместе с тем малые количества антител против многих аутоантигенов обнаруживаются в крови практически у всех людей. Последнее дает основание предполагать, что клетки, способные вырабатывать аутоантитела, в организме все же существуют, но их или очень мало, или их активность супрессирована.
Аутоиммунными заболеваниями называют такие состояния, при которых в организме появляются антитела или сенсибилизированные лимфоциты против нормальных антигенов собственного организма. Одна из первых гипотез аутоиммунизации была основана на том, что нормальная иммунная система реагирует на измененные антигены собственного организма. Причиной изменения тканевых антигенов могут быть химические, в том числе лекарственные, воздействия, влияние физических (например, радиационных или термических) факторов, а также микробные или вирусные агенты. В этих случаях предполагается следующее: возникновение измененного тканевого антигена приводит к реакции иммунной системы на этот аутоантиген и выработке аутоантител или появлению сенсибилизированных лимфоцитов, которые оказывают деструктивное влияние последних на те или иные ткани. Эта гипотеза, несмотря на ее логичность и простоту, не могла объяснить два момента. Во-первых, каким образом антитела против модифицированного антигена могут повреждать нормальные ткани? Антитела ведь строго специфичны и следовало бы ожидать, что они должны взаимодействовать только с модифицированным антигеном, вступать с ним в связь и играть не деструктивную, а защитную роль. Во-вторых, выполнив защитную роль и обеспечив таким образом элиминацию из организма модифицированного антигена, иммунный ответ должен привести к быстрому самоизлечению организма от аутоиммунного заболевания. В действительности эти заболевания имеют длительный само поддерживающий характер.
В соответствии с гипотезой запрещенных клонов предполагается следующее: возникновение генетически измененных лимфоидных клеток, способных реагировать на нормальные антигены организма, приводит к накоплению запрещенного клона клеток и иммунной реакции этого клона против тех или иных тканевых антигенов с появлением аутоантител или сенсибилизированных лимфоцитов, оказывающих деструктивное влияние на соответствующие ткани. Концепция запрещенных клонов произвела аутоиммунные расстройства в ранг болезней иммунной системы. Таким образом, впервые был поставлен вопрос о том, что для эффективной борьбы с аутоиммунными заболеваниями необходимо искать способы лечения не пораженных аутоантителами тканей, а иммунной системы в целом. В последние годы идея о запрещенных клонах обогатилась фактами, установившими возможность поликлональной активации В-клеток. Было показано, что ряд веществ может вызвать пролиферацию и дифференцировку всех В-клонов отдельных клеточных популяций. Предполагается, что процесс такого типа может привести к активации и аутоагрессивного клона. Эта гипотеза хорошо объясняет провоцирующую роль инфекционных и других экзогенных воздействий при наследственной предрасположенности к аутоиммунным расстройствам.
Одна из последних гипотез, объясняющих механизмы аутоиммунизации, возникла после открытия Т-супрессоров. Речь идет об иммунодефиците по Т-супрессорам, которые подавляют функцию В-лимфоцитов. При дефиците Т-супрессоров В-клетки начинают реагировать на тканевые аутоантигены, вырабатывают аутоантитела, которые и обеспечивают развитие аутоиммунного заболевания.
Активация В-лимфоцита состоит из двух фаз — пролиферации и дифференцировки. В результате пролиферации увеличивается число В-клеток, способных реагировать с введенным в организм чужеродным антигеном. Процесс пролиферации необходим, поскольку в спокойном состоянии в организме специфичных для одного антигена В-лимфоцитов мало. В результате пролиферации увеличивается число клеток, способных немедленно дифференцироваться в антителообразующие лимфоциты, а также накапливаются В-лимфоциты памяти, способные активироваться при повторной иммунизации.
Обладающие различными функциями Т-лимфоциты продуцируют много различных растворимых медиаторов, известных под названием цитокины. К ним можно отнести интерлейкины, интерфероны, факторы роста и дифференцировки Т- и В-клеток, хемотаксические и цитотоксические факторы — лимфотоксин и фактор, некротизирующий опухоль. Клетки различных подклассов обладают различными эффекторными функциями. Цитолитические Т-лимфоциты способны разрушить тканевый трансплантат, инфицированные вирусом и внутриклеточными паразитами собственные клетки организма; кроме того, они могут разрушать и опухолевые клетки. Регуляторные функции Т-клеток проявляются в активации иммунной реакции (Т-хелперы) и в ее подавлении (Т-супрессоры).
Проблема HLA человека в клиническом отношении первоначально разрабатывалась исключительно в рамках трансплантологии. Дальнейшие исследования показали, что гены, кодирующие антигены гистосовместимости, являются многофункциональными; клиническое значение их не ограничивается рамками трансплантологии, а связано также с предрасположенностью к определенным заболеваниям.
Взаимодействие иммунной, нервной и эндокринной систем. В последние годы значительное развитие получило направление исследований, связанное с изучением взаимодействия и взаимообусловленности функционирования иммунной, нервной и эндокринной систем. До недавнего времени считалось, что основная роль в реализации взаимодействия между нейроэндокринной и иммунной системами принадлежит катехоламинам, ацетилхолину и глюкокортикоидным гормонам. В дальнейшем появилось достаточное количество экспериментальных данных о модулирующем влиянии на иммунный ответ таких пептидных гормонов, как АКТГ, соматотропин, аргинин-вазопрессин, окситоцин, тиреотропин, вещество P, вазоактивный интестинальный пептид и др. Доказано, что в иммунорегуляции принимают участие эндорфины и энкефалины.
Установлено, что функция иммунной системы регулируется такими мозговыми структурами, как гипоталамус, гипофиз, миндалина, вентральное поле покрышки и др., а также нейрохимическими системами мозга — дофаминергической, серотонинергической и др. На основе соответствующих данных возникло предположение о существовании иммунных расстройств, обусловленных нарушением нервной регуляции [Крыжановский Г.Н., Магаева С.М., 1998].
Ключевым звеном аппарата регуляции является гипоталамус. Он связан со всеми звеньями аппарата и дает начало сложному эфферентному пути передачи центральных нейрорегуляторных влияний на иммунокомпетентные клетки, которые обладают соответствующими рецепторами к нейро-трансмиттерам, нейропептидам, а также к гормонам эндокринных желез [Говырин Н.В., Ложкина А.Н., 1991; Шхинек Э.К., 1993].
Выявлены конкретные медиаторы, с помощью которых реализуется взаимосвязь между иммунокомпетентными и нервными клетками. Как уже упоминалось, большое значение имело открытие в мозге эндогенных морфиноподобных соединений и рецепторов к ним. Речь идет о группе нейропептидов — опиоидных пептидов.
Принципиально важными явились также работы по изучению нейротропной активности медиаторов иммунитета. Показано, что такие медиаторы, как интерлейкин 1 (ИЛ-1), интерлейкин 2 (ИЛ-2), интерферон (ИФ), тимозин, фактор некроза опухоли (ФНО) обладают способностью регулировать функции ЦНС.
Пептидные лиганды, осуществляющие нейроиммунное взаимодействие, имеют общие для обеих систем рецепторы. Так, иммунокомпетентные клетки могут синтезировать нейропептиды и отвечать на большинство, если не на все, соединения этой группы. Клетки нейроэндокринной системы продуцируют некоторые лимфокины и монокины и отвечают на них. Структурная родственность рецепторов показана, например, для АКТГ, эндорфинов, ИЛ-1 и ИЛ-2.
Итак, можно сказать, что эти системы имеют и используют одинаковый набор сигнальных молекул в виде физиологически активных субстанций, таких как лимфокины и монокины для внутрисистемной и межсистемной связи. Кроме того, они обладают одинаковым спектром рецепторов для общих лигандов.