Что такое газообразная смесь
Виды однородных смесей и способы их разделения
Однородные смеси в химии — определение понятия
Смесью в химии называют систему, содержащую два или более разных вещества, которые не реагируют друг с другом.
Концентрация веществ в смеси может меняться в широких пределах. В качестве примера смеси можно привести воздух в атмосфере. Он представляет собой смесь газов, в состав которой входят:
Компоненты смеси являются веществами, входящими в состав смеси.
Выделяют следующие классы смесей:
Однородные (гомогенные) смеси — представляют собой смеси, в которых невооруженным глазом или через микроскоп не получится выявить компоненты, входящие в состав.
Примерами гомогенной смеси являются вода, в которой растворен сахар, а также воздух и превалирующая часть металлических сплавов. Все перечисленные вещества представляют собой однородные смеси.
Для приготовления однородной смеси можно добавить в стакан с водой какое-то количество сахара. В процессе интенсивного перемешивания такой массы сахар растворяется, а жидкость становится сладкой на вкус. В результате сахар не исчезает, а становится компонентом смеси. Однако происходят изменения, в результате которых кристаллы сахара невозможно рассмотреть даже с помощью мощного микроскопа. Полученная субстанция из сахара и воды представляет собой однородную смесь с равномерно перемешанными мельчайшими частицами данных веществ.
По-другому однородные смеси называют растворами. Это однородная смесь, состоящая из растворенного вещества и растворителя.
Однородные смеси отличаются по физическим свойствам. Определяющим фактором являются свойства составных компонентов. К примеру, вода кипит при 100 °C, а водный раствор соли может закипать при более высокой температуре. При охлаждении воды до температуры 0 °С, данное вещество трансформируется в лед. Раствор соли при аналогичных условиях сохраняет жидкое агрегатное состояние, а замерзание происходит при температуре ниже 0 °С.
Сплав из олова и свинца, который применяют для паяния, плавится при более низкой температуре по сравнению с чистыми металлами.
Однородной смесью также является раствор спирта и воды. Определение раствора применимо к смесям не только в жидком, но и в твердом или газообразном агрегатном состоянии.
Виды гомогенных смесей и способы их разделения
Классификация гомогенных смесей:
Воздух является гомогенной смесью газообразных веществ. Чистый воздух состоит из следующих компонентов:
Примерами однородных смесей газов являются природный газ и попутный нефтяной газ. Данные вещества состоят из газообразных углеводородов:
Растворами в распространенных случаях называют смеси веществ в жидком агрегатном состоянии. Однако термин распространяется и на газы, и на твердые вещества. В широком понимании, раствор представляет собой любую однородную смесь веществ.
Одним из самых ценных растворов природного происхождения является нефть. В результате переработки этой смеси получают следующие материалы:
Перечисленные вещества являются смесями из разнообразных углеводородов.
Для приготовления раствора требуется вещество в виде жидкости, газа или твердого материала смешать с растворителем. Роль растворяющих компонентов могут играть вода, спирт, ацетон и другие подобные вещества. Получение нашатырного спирта, к примеру, основано на растворении в воде газообразного аммиака. Получить тинктуру йода можно путем растворения кристаллического йода в этиловом спирте (этаноле).
Сплавы представляют собой твердые растворы. Данные материалы получают путем обработки металлов. Состав сплава может включать большое количество разнообразных веществ. В современном мире высоко ценятся сплавы железа в виде чугуна и стали. В чугуне содержится свыше 2% углерода, а в стали — концентрация углерода меньше.
Другими распространенными составными компонентами железных сплавов являются:
С целью придания сталям каких-либо специфических свойств используют процесс легирования, то есть вводят в состав металла особые примеси. К примеру, сталь с повышенной ударопрочностью содержит марганец в высокой концентрации. В процессе выплавки нержавеющей стали в состав материала вводят добавку в виде хрома.
В современной промышленности активно используют сплавы алюминия. Такие материалы обладают легкостью и хорошими прочностными характеристиками. Сплавы алюминия, как правило, содержат следующие компоненты:
Человек достаточно давно использует медные сплавы, что известно из истории. Бронза представляет собой сплав меди с оловом, а латунь — сплав меди и цинка. Современные технологии металлургического производства допускают применение в выплавке медных сплавов и других металлов, в том числе, алюминия, никеля, свинца.
Какими методами можно такие смеси разделить
Существует несколько основных методов разделения гомогенных смесей:
Метод выпаривания (кристаллизации) основан на различии в температурах, при которых можно наблюдать кипение растворителя и растворенного вещества. С помощью данной методики выделяют растворимые твердые вещества из раствора. В распространенных случаях технология выпаривания включает несколько стадий:
В процессе происходит постепенное испарение воды или другого растворителя. В результате на дне чаши остается твердое вещество.
Конденсация — является фазовым переходом вещества из состояния газа или пара в жидкое или твердое состояние.
В результате конденсации вещество, которое испарилось, к примеру, вода или другой растворитель, может быть собрано в виде конденсата на более холодной поверхности. Действие данного метода можно объяснить таким образом: при помещении холодного предметного стекла над выпаривательной чашей легко заметить на его поверхности воду в виде капель. По аналогичному принципу работает метод дистилляции (перегонки).
Смесь веществ нагревают, при этом компоненты при повышении температуры испаряются поочередно, начиная с самого легкокипящего. Пары компонента отводят и конденсируют, таким образом разделяют смесь.
В том случае, когда вещество, к примеру, сахар, в процессе нагрева разлагается, воду испаряют не полностью. После упаривания раствора до насыщенного состояния кристаллы сахара выпадают в осадок.
Возникают ситуации, когда необходимо удалить примеси из состава растворителей, например, очистить воду от соли. Тогда растворитель испаряют, а его пары собирают и конденсируют при понижении температуры. Данный метод разделения однородной смеси также носит название дистилляция, или перегонка.
В природном мире невозможно обнаружить чистую воду, не содержащую каких-либо примесей. Растворами солей в воде являются океаническая, морская, речная, колодезная, родниковая вода. Чистая вода без солей нередко используется в моторах автомобилей, на химических производствах, где получают разные вещества и растворы, при изготовлении фотографий. Такая вода является дистиллированной (полученной в результате дистилляции) и подходит для применения в лабораториях в процессе постановки разных химических экспериментов.
С помощью перегонки разделяют такие вещества, как:
Хроматография — является способом разделения и исследования смесей веществ.
Данный метод основан на неодинаковых скоростях, с которыми распределяется изучаемое вещество между двумя фазами:
Неподвижная фаза в распространенных случаях является сорбентом с развитой поверхностью, то есть мелкодисперсным порошком. В качестве примера можно привести оксид алюминия или оксид цинка. Подвижная фаза представляет собой поток газа или жидкости. Поток подвижной фазы фильтруется при прохождении сквозь слой сорбента, либо движется вдоль слоя сорбента, к примеру, по поверхности фильтровальной бумаги.
Рассмотреть метод хроматографии на практике и получить хроматограмму можно, если смешать некоторое количество чернил. После нанесения капли смеси на фильтровальную бумагу следует в ее середину приливать по каплям чистую воду. При этом каждая капля вносится после впитывания предыдущей. Вода выполняет функцию элюэнта, с помощью которого изучаемое вещество переносится по сорбенту в виде пористой бумаги.
Вещества, являющиеся составными компонентами смеси, задерживаются бумагой неодинаково. Можно заметить, что одни из них хорошо удерживаются, а другие — впитываются труднее и в течение некоторого времени растекаются, соединяясь с водой. После недолгого ожидания наблюдатель начнет распознавать на листе красочную хроматограмму с пятнами одного цвета в центре и разноцветными концентрическими кольцами по кругу.
В синтезе органических веществ активно используют тонкослойную хроматографию. Преимущество данного метода заключается в максимально простом и высокочувствительном способе детектирования в виде визуального контроля. Пятна, которые невозможно визуально различить, проявляются с помощью разных реактивов, а также ультрафиолетового излучения или авторадиографии.
§ 13. Смеси веществ, их состав и способы разделения
Классификация смесей по визуальным свойствам. В повседневной жизни мы редко сталкиваемся с чистыми веществами. В качестве немногочисленных примеров чистых веществ можно привести сахар, перманганат калия (марганцовку), поваренную соль, да и то если в них не внесены различные добавки (например, в поваренную соль добавляют иод для профилактики заболеваний щитовидной железы).
Значительно чаще нас окружают смеси веществ, которые содержат два или более индивидуальных соединения, называемых компонентами смеси.
Смеси различаются величиной входящих в их состав частиц. Иногда эти частицы настолько велики, что их можно видеть невооружённым глазом. Например, в смеси речного песка с сахарным вы без труда отличите кристаллики одного и другого. К подобным смесям можно отнести и стиральный порошок, кулинарные смеси для выпечки блинов или тортов, строительные сухие смеси, которые смешивают с водой. Смеси, в которых частички составляющих их веществ видны невооружённым глазом или с помощью оптических приборов, называются неоднородными или гетерогенными.
Есть смеси, при образовании которых вещества дробятся на мельчайшие частицы (молекулы, ионы), не различимые даже в микроскоп. Как бы вы ни всматривались в воздух, различить составляющие его газы вам не удастся. Так же бесполезно искать «неоднородность» в растворах уксусной кислоты или поваренной соли в воде. Такие смеси называются однородными или гомогенными.
Классификация смесей по агрегатному состоянию, их состав.
Гомогенные смеси, равно как и химические вещества, по агрегатному состоянию можно разделить на газообразные, жидкие и твёрдые.
Наиболее известными вам природными смесями газов являются воздух, а также природный и попутный нефтяной газы.
С жидкими смесями в повседневной жизни мы сталкиваемся постоянно. Шампуни и напитки, микстуры и препараты бытовой химии — всё это смеси веществ. Даже воду из-под крана нельзя считать чистым веществом: в ней содержатся растворённые соли, мельчайшие нерастворимые примеси и микроорганизмы, от которых избавляются хлорированием или озонированием. Однако и в этом случае воду рекомендуется кипятить. Специальные бытовые фильтры помогут сделать воду пригодной для питья и очистить её не только от твёрдых частиц, но и от некоторых растворённых примесей.
Широко распространены и твёрдые смеси. Как мы уже говорили, горные породы представляют собой смесь нескольких веществ. Почва, глина, песок — это тоже смеси. К твёрдым искусственным смесям можно отнести стекло, керамику, сплавы.
Как вам известно из биологии, состав воздуха, который мы вдыхаем, отличается от того, который мы выдыхаем. В выдыхаемом воздухе меньше кислорода, зато больше углекислого газа и водяного пара. Но «больше—меньше» — понятия относительные. Состав смесей можно выразить количественно, т. е. в цифрах.
Состав газовой смеси выражают объёмной долей каждого из её компонентов.
Объёмной долей газа в смеси называется отношение объёма данного газа к общему объёму смеси, выраженное в долях единицы или процентах:
Объёмную долю газа в смеси обозначают буквой ф (фи). Эта величина показывает, какую часть общего объёма смеси занимает конкретный газ. Например, вы знаете, что объёмная доля кислорода в воздухе составляет 21%, азота — 78%. Оставшийся 1% приходится на благородные газы, углекислый газ и другие компоненты воздуха.
Очевидно, что сумма объёмных долей всех газов в смеси равна 100%.
Состав жидких и твёрдых смесей принято выражать величиной, которая называется массовой долей компонента.
Массовой долей компонента в смеси называется отношение массы данного вещества к общей массе смеси, выраженное в долях единицы или процентах:
Разделение смесей, очистка основного вещества от примесей. Практически любая таблетка в домашней аптечке — это спрессованная смесь одного или нескольких лекарственных веществ и наполнителя, в качестве которого может выступать гипс, крахмал, глюкоза. Строительные и кулинарные смеси, парфюмерные композиции и краски, удобрения и пластмассы имеют состав, который может быть выражен в массовых долях образующих их компонентов.
Вещества с примесями — это тоже смеси. Только в таких смесях принято выделять главное (основное) вещество и посторонние компоненты, которые называют одним словом — примеси. Чем меньше примесей, тем чище вещество.
В некоторых областях техники использование недостаточно чистых веществ недопустимо. Микросхему компьютера не сделать без особо чистых кристаллов кремния. В атомной энергетике предъявляются повышенные требования к очистке ядерного топлива. Световой сигнал «погаснет» в стекловолоконном кабеле, «наткнувшись» на посторонние примеси.
Чтобы разделить компоненты смеси или очистить основное вещество от примесей, используют различные приёмы и методы.
Как правило, вещества, входящие в состав смеси, сохраняют свои физические свойства: температуру кипения, температуру плавления, растворимость. Поскольку свойства одного вещества отличаются от свойств другого, разделить смеси на отдельные компоненты можно, используя переход из одного агрегатного состояния в другое.
Перегонка, или дистилляция. Разделение смесей жидких веществ основано на различии в их температурах кипения. Такой процесс, как вы знаете на примере переработки нефти, называется ректификацией или перегонкой.
Перегонку используют не только для разделения смесей на отдельные составляющие, но и для очистки веществ.
Вода из-под крана чиста, прозрачна, не имеет запаха. Но чистое ли это вещество с точки зрения химика? Загляните в чайник: накипь и коричневатый налёт остаются после многократного кипячения в нём воды. А известковый налёт на кранах? И природная, и водопроводная вода — это смесь, раствор твёрдых и газообразных веществ. Конечно, их содержание в воде очень мало, но эти примеси могут привести не только к образованию накипи, но и к более серьёзным последствиям. Не случайно лекарства для инъекций, растворы реактивов, электролит для автомобильного аккумулятора готовят только с использованием очищенной воды, называемой дистиллированной.
Откуда взялось такое название? Всё дело в том, что перегонка по-другому называется дистилляцией. Сущность дистилляции состоит в том, что смесь нагревают до кипения, образующиеся пары чистого вещества отводят, охлаждают и вновь превращают в жидкость. Но она уже не содержит загрязняющих примесей.
В лабораторных условиях перегонку ведут на установке, изображённой на рисунке 53. Она состоит из перегонной колбы (1). В неё наливают разделяемую смесь, например воду с растворёнными в ней примесями. Жидкость нагревают до кипения. Колба соединена с нисходящим холодильником (2) — устройством для конденсации паров кипящего вещества. С этой целью в рубашку холодильника по резиновым шлангам (3) подаётся холодная вода. Сконденсированные в холодильнике капли чистого вещества попадают в колбу-приёмник (4).
Рис. 53. Лабораторная установка для перегонки жидкостей
Кристаллизация. Как поступить, если требуется выделить из раствора не жидкость, а растворённое в ней твёрдое вещество? Для этого используют метод кристаллизации.
Выделить твёрдое вещество из раствора методом кристаллизации можно, выпаривая растворитель. Для этого предназначены специальные фарфоровые чашки (рис. 54).
Рис. 54. Выпаривание раствора в фарфоровой чашке
Такой же способ широко применяется для добычи соли из концентрированных растворов соляных озёр.
В природе соляные озёра — это своеобразные гигантские чаши. За счёт испарения воды на берегах таких озёр кристаллизуется огромное количество соли, которая после очистки попадает к нам на стол (рис. 55).
Рис. 55. Добыча соли на соляных озёрах
При проведении кристаллизации не обязательно испарять растворитель. Известно, что при нагревании растворимость большинства твёрдых веществ в воде увеличивается. Значит, при охлаждении раствора некоторое количество кристаллов выпадет в осадок.
Кругом полынь и привкус хины,
и, крепким натром солона,
цветную от лучей равнину
чуть лижет ровная волна.
Лабораторный опыт
К 5 г оранжевых кристаллов соли дихромата калия добавьте несколько кристалликов перманганата калия (марганцовки) в качестве примеси. Смесь растворите в 8—10 мл кипящей воды. При охлаждении раствора растворимость дихромата калия резко понижается, вещество выпадает в осадок. Кристаллы очищенного от марганцовки дихромата отделите, промойте несколькими миллилитрами ледяной воды. Если растворить очищенное вещество в воде, то по цвету раствора можно определить, что марганцовки оно не содержит — она осталась в исходном растворе.
Отстаивание и фильтрование. Для выделения из жидкостей нерастворимых веществ используют метод отстаивания. В его основе лежит различная плотность веществ. Если частички твёрдого вещества достаточно крупные, они быстро оседают на дно, а жидкость становится прозрачной (рис. 56). Её можно осторож-Рис. 56. Отстаивание почвы в воде но слить с осадка.
Рис. 56. Отстаивание почвы в воде
Чем меньше размер твёрдых частиц в жидкости, тем дольше будет отстаиваться смесь.
Лабораторный опыт
В стеклянный стакан насыпьте немного порошка для чистки сантехники и залейте его до половины водой. Образуется мутная смесь. Жидкость станет прозрачной только на следующий день. Почему смесь отстаивается так долго? Слейте прозрачную жидкость. Какой способ разделения вы использовали?
Отстаиванием разделяют и смеси двух нерастворимых друг в друге жидкостей.
Если в систему смазки автомобиля попала вода, масло придётся слить. Однако через некоторое время смесь расслоится. Вода, имеющая большую плотность, образует нижний слой, сверху отстоится слой масляный. Аналогично отстаивается смесь воды и нефти, воды и растительного масла. Для разделения таких смесей удобно пользоваться особой лабораторной посудой, называемой делительной воронкой (рис. 57).
Рис. 57. Разделение двух несмешивающихся жидкостей с помощью делительной воронки
Лабораторный опыт
В коническую колбу налейте равные объёмы воды и растительного масла. При интенсивном взбалтывании вода и масло разбиваются на мелкие капельки, образуя мутную смесь. Перелейте её в делительную воронку. Через некоторое время смесь расслаивается на более тяжёлый водный слой и масло, всплывающее наверх. Откройте кран делительной воронки и слейте воду.
Отделить частицы твёрдого нерастворимого вещества от жидкости можно с помощью фильтрования. В лаборатории для этого используется специальная пористая бумага, называемая фильтровальной. Частицы твёрдого вещества не проходят через поры бумаги и остаются на фильтре. Жидкость с растворёнными в ней веществами (её называют фильтратом) свободно просачивается через него и становится совершенно прозрачной.
Фильтрование — очень распространённый процесс и в быту, и в технике, и в природе.
На водоочистительных станциях воду фильтруют через слой чистого песка, на котором задерживаются ил, примеси нефтепродуктов, частицы почвы и глины. Топливо и масло в двигателе автомобиля обязательно проходят через фильтрующие элементы.
Клеточные мембраны, стенки кишечника или желудка — это тоже своеобразные биологические фильтры, поры которых пропускают одни вещества и задерживают другие.
Фильтровать можно не только жидкие смеси. Не раз вы видели людей в марлевых повязках, да и самим, наверное, приходилось ими пользоваться. Проходя через несколько слоёв марли с проложенной между ними ватой, вдыхаемый воздух очищается от частиц пыли, смога, болезнетворных микробов. В промышленности для защиты органов дыхания от пыли используют специальные приспособления — респираторы. Воздух, попадающий в двигатель автомобиля, тоже очищают от пыли тканевыми или бумажными фильтрами.
Лабораторный опыт
Положите на стол кубик льда из морозильной камеры. На верхнюю грань кубика положите конец нитки и посыпьте кубик солью. Через минуту потяните нитку вверх. Что произошло? Объясните почему.
Далее мы подробно рассмотрим дисперсные системы и растворы, образованные смесями из различных веществ.
Теперь вы знаете
Теперь вы можете
Выполните задания
а) железная и медная стружка;
б) песока и древесные опилки;
в) бензин и вода;
г) меловая побелка на мел и воду;
д) раствор этилового спирта в воде.
Основные агрегатные состояния вещества
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.
Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
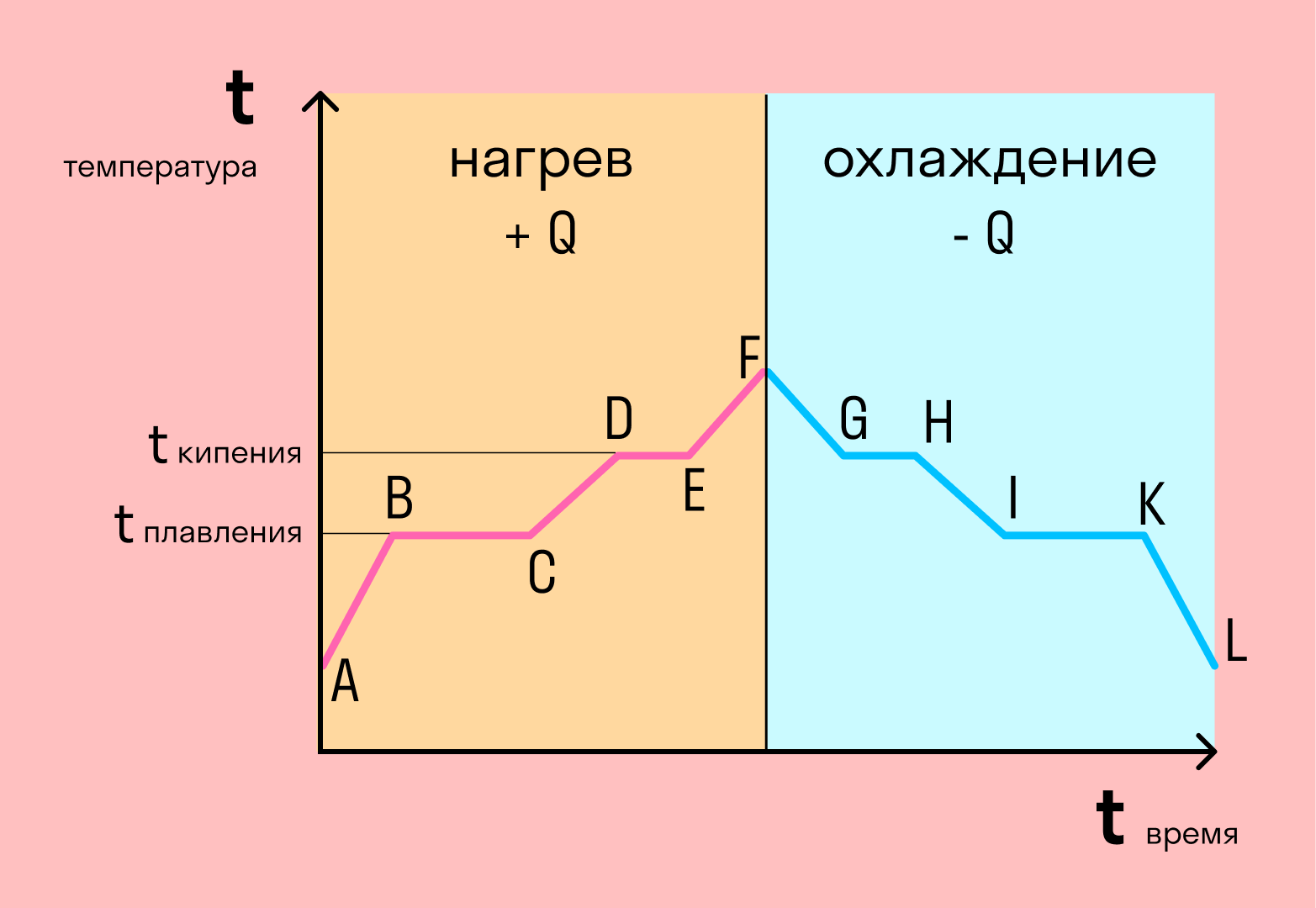
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
Первый шаг в обратную сторону — охлаждение до температуры кипения.
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Онлайн-уроки физики в Skysmart не менее увлекательны, чем наши статьи!
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
80 кДж/кг = 80000 Дж/кг
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
Примерчики из жизни🤓
Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка.
Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха.
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.