Что такое гемагглютинин вируса гриппа
Гемагглютинин
Гемагглютинин — любое вещество, вызывающее гемагглютинацию, реакцию агглютинации эритроцитов крови.
Примеры
Гемагглютинин вируса гриппа
Одним из примеров гемагглютинина является поверхностный белок вируса гриппа, обеспечивающий способность вируса присоединяться к клетке-хозяину. Видовую специфичность рецептора определяет тип связи N-ацетил-нейраминовой кислоты с галактозой (альфа2-3 или альфа2-6). Переключение рецепторной специфичности с альфа2-3 (у птиц) на альфа2-6 (у человека) является главным механизмом адаптации вируса к человеческой популяции. Основные иммуногенные детерминанты располагаются на поверхности вириона в структуре гемагглютинина, индуцируют в организме образование нейтрализующих антител и кодируются 4-м сегментом вирионной РНК вируса гриппа.
Антитела к гемагглютинину обеспечивают основной иммунитет против вируса.
По антигенным вариантам поверхностных гликопротеидов гемагглютинина (Н) и нейраминидазы (N) выделяют подтипы вируса гриппа A. Вирусы, вызывающие грипп у человека, имеют три основных антигенных подтипа гемагглютинина (Н1, Н2 и НЗ). Два варианта гемагглютинина, которые ранее считались подтипами Н0 и Hsw1, сейчас признают вариантами подтипа Н1. Отдельные штаммы обозначают по географическому происхождению, порядковому номеру штамма, году выделения и подтипу вируса, например: вирус гриппа A/Йоханнесбург/33/94 (H3N2).
Штаммы вирусов гриппа В и С обозначают так же, но подтипы вируса не выделяют, так как вариантов антигенов Н и N у них значительно меньше.
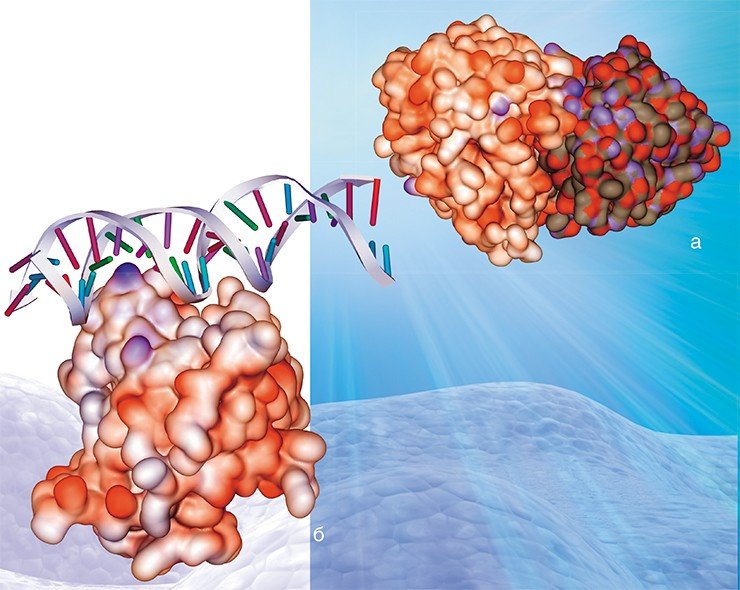
Гемагглютинин вируса гриппа представляет собой тример, построенный из двух различных по структуре участков: трехнитчатой закрученной в спираль конструкции из a-спиралей, отстоящей на 7,6 нм от мембраны, и глобулярного участка антипаралельной b-поверхности,которая содержит сайт связывания рецептора.
Ионный щит вируса гриппа
Геном вируса гриппа, как известно, способен мутировать исключительно высокими темпами благодаря случайным «ошибкам» при тиражировании своей наследственной информации. Частота нуклеотидных замен в его наследственном материале в сотни тысяч раз выше, чем в геноме человека.
Именно эта особенность вируса лежит в основе эффективного механизма, защищающего его от иммунной системы человека, поскольку приводит к появлению таких штаммов, с которыми не могут связываться антитела, ранее наработанные в организме в ответ на инфекцию или вакцинацию. Мутантный штамм поэтому активно размножается до тех пор, пока в организме не будут выработаны новые специфичные антитела.
Молекулярные механизмы, обеспечивающие проникновение вируса внутрь клетки-мишени, до сих пор остаются предметом многих научных исследований. Главная цель последних – помочь в разработке лекарственных препаратов, способных предотвратить инфицирование клетки вирусом. Остановить болезнь на начальной стадии крайне важно – это означает не дать вирусной частице создать армию своих клонов, готовых к заражению других здоровых клеток.
В настоящее время в связи с возможностью новой пандемии гриппа, причиной которой может стать мутированный штамм так называемого птичьего гриппа, исследования вируса гриппа типа А (к нему относится большинство штаммов гриппа млекопитающих и птиц) приобрели еще большую актуальность. Создание новых эффективных средств профилактики и лечения этого заболевания требует глубокого понимания сложных механизмов межмолекулярных взаимодействий, процессов регуляции работы генов как вируса, так и организма хозяина.
Не только для широкого круга читателей, но и для многих специалистов необычным и малоизвестным подходом в этой области являются методы компьютерного моделирования, позволяющие реконструировать закономерности молекулярной эволюции и проводить своего рода виртуальные «эксперименты» как с отдельно взятыми молекулами, так и с молекулярно-генетическими системами. Благодаря этим методам можно выявить перспективные молекулярные мишени для создания лекарственных препаратов нового поколения против различных вирусных и бактериальных инфекций.
В лаборатории теоретической генетики ИЦиГ СО РАН компьютерные методы и подходы в эволюционной биологии и протеомики (науки о белках) активно развиваются в течение последних 15 лет. Одним из важнейших объектов исследований в настоящее время стал вирус гриппа А, точнее – гемагглютинин, один из его поверхностных белков.
Гемагглютинин – «абордажный крюк» вируса
Прежде чем перейти непосредственно к результатам компьютерного моделирования, необходимо ближе познакомиться со строением и «образом жизни» гриппозного вириона, особенно с его структурно-функциональными белковыми структурами.
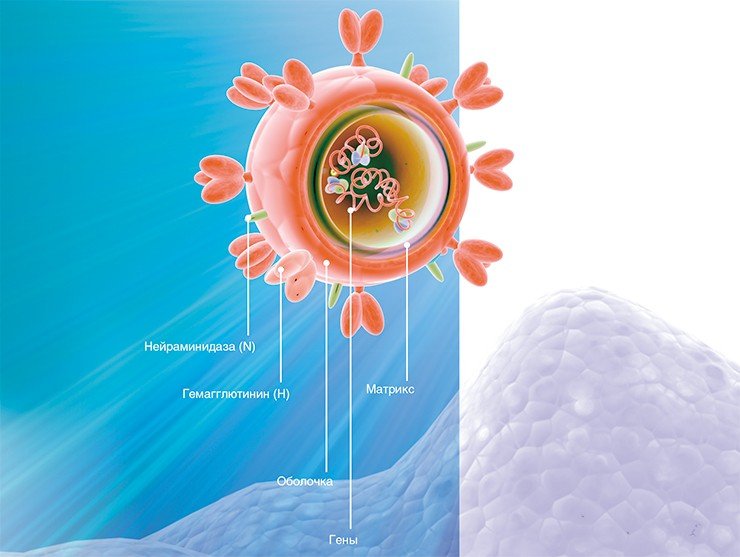
Генетический материал вируса защищен оболочкой из особого белка, вокруг которой располагается мембрана из липидов (жироподобных веществ). В ней удерживаются молекулы трех белков: гемагглютинина, нейраминидазы и белка М 2, формирующего особые ионные каналы. При помощи гемагглютинина вирус прикрепляется к клеточной мембране, а нейраминидаза ее разрушает, открывая вирусу путь внутрь клетки. Затем внутри вириона-захватчика благодаря ионным каналам изменяется кислотность среды (pH), чем создаются условия для освобождения генетического материала из вирусной капсулы.
Таким образом, гемагглютинин играет одну из важнейших ролей при инфицировании вирусом клетки-мишени. На поверхности вирусной оболочки он присутствует в виде тримеров, т. е. комплексов из трех молекул. Каждая молекула, в свою очередь, состоит из двух субъединиц: одна обеспечивает первичный контакт с клеткой, вторая отвечает за слияние с клеточной мембраной. Процесс слияния также далеко не прост и сопровождается значительными перестройками самой молекулы гемагглютинина, в результате которых из внутренней части глобулы белка высвобождается «спрятанный» там особый пептид слияния.
Для инфицированного организма поверхностные белки вируса, включая гемагглютинин, представляют объект, требующий пристального внимания, поскольку являются антигенами – веществами, по которым иммунная система распознает инфекционного интервента. В вирусных белках можно выделить так называемые антигенные детерминанты – участки, с которыми предпочтительно связываются антитела, специфические защитные белки иммунной системы. Мутации, вызывающие структурные изменения в подобных местах, т. е. меняющие форму и расположение антигенных детерминант, как раз и приводят к образованию новых вирусных штаммов. Такие вирусы становятся практически «невидимыми» для антител, уже циркулирующих в крови зараженного организма, что делает его безоружным перед нашествием.
Мы предположили, что в ряду мутаций, защищающих вирусные белки от действия антител, помимо структурных могут существовать и другие. Речь идет о том, что в местах антигенных детерминант в результате мутаций появляются участки, с которыми могут связываться лиганды – молекулы или ионы, способные образовывать с белком комплексные соединения. В результате антитела инфицированного организма не могут взаимодействовать с подобными хорошо «защищенным» вирусными антигенами. Проверка этой гипотезы была осуществлена с применением разработанных в нашей лаборатории компьютерных методов молекулярного моделирования.
Что увидел компьютер
В принципе белковые молекулы могут взаимодействовать с другими молекулами самой разной природы: с макромолекулами, в числе которых могут быть белки или нуклеиновые кислоты, носители генетической информации; с низкомолекулярными соединениями; а также с различными ионами. И в этом смысле белки вирусов ничем не отличаются от белков других живых организмов, в том числе человека.
Подобные универсальные взаимодействия лежат в основе метаболических путей, транспортных молекулярных потоков, путей передачи сигналов. На поверхности белков находятся специальные места «посадки» молекул-лигандов – функциональные сайты, – которые своей уникальной структурой и обеспечивают специфическое связывание с этими молекулами.
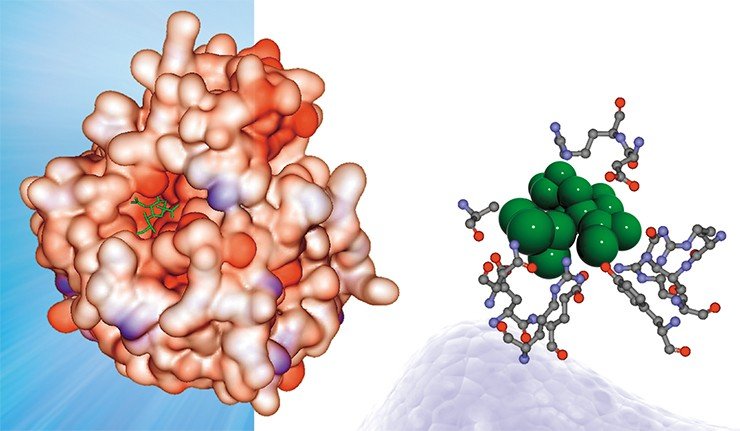
А теперь давайте вернемся к нашему «герою» – гемагглютинину – и посмотрим результаты компьютерного анализа. Прежде всего отметим, что поверхность гемагглютинина в отличие от других белков в высокой степени обогащена местами посадки различных ионов. Более того — на ней присутствует большое число потенциальных мест такой посадки, которые могут превратиться в «действующие» сайты связывания уже в результате одиночной мутации, т. е. замены всего лишь одной пары нуклеотидов!
Возможно, именно эти свойства гемагглютинина позволяют вирусу гриппа с легкостью ускользать от нашей иммунной системы, обеспечивая его высокую эпидемичность. Аргументом в пользу этого соображения является тот факт, что выявленные участки связывания ионов практически перекрываются с участками расположения антигенных детерминант.
В лаборатории теоретической генетики ИЦиГ СО РАН создана база данных (PDBSite), содержащая информацию о пространственных структурах более чем 30 тыс. различных функциональных участков (сайтов) белков, включая каталитические центры ферментов, сайты взаимодействий белок–белок, белок–ДНК/РНК, белок–лекарственные препараты и т. д. В базе в удобном для поиска и использования виде хранятся данные о физико-химических, структурных и эволюционных характеристиках этих сайтов, полученные с помощью компьютерного анализа экспериментально расшифрованных комплексов. Эти сведения успешно используются для распознавания функциональных сайтов в пространственных структурах малоизученных белков путем определения их структурного сходства с известными. Например, в результате анализа структуры гемагглютинина – поверхностного белка вируса гриппа – выяснилось, что один из его участков схож с сайтом связывания сульфат-иона (SO4), что свидетельствует о потенциальной способности этого белка связываться в этом участке с сульфат-ионом
Как известно, антитела, выработанные в результате иммунного ответа на инфекцию, связываются с антигенными детерминантами, что приводит к нейтрализации вирусных частиц и их дальнейшему разрушению под действием иммунной системы. Очевидно, что связывание иона с антигенной детерминантой будет препятствовать образованию устойчивого комплекса антиген–антитело, в результате чего вирус будет «щитом» отгорожен от воздействия иммунной системы.
Подтверждением нашей гипотезы «ионного щита» вируса гриппа стала еще одна особенность, которую удалось обнаружить у гемагглютинина: предполагаемые сайты связывания ионов на его молекуле совпадают с уже известными участками, отвечающими за адаптивную молекулярную эволюцию этого белка.
Адаптивными обычно считаются такие мутации, которые повышают приспособленность несущего их организма. И действительно, мутации, повреждающие антигенные детерминанты, являются для вируса гриппа адаптивными. Одним из основных механизмов адаптивной эволюции поверхностного белка вируса гриппа, очевидно, как раз и является возникновение сайтов связывания ионов в этих важнейших для воспроизводства и выживания вируса участках. Результаты исследования недвусмысленно свидетельствуют, что новое поколение вакцин для нейтрализации вируса гриппа должно конструироваться с учетом возможного связывания ионов с поверхностным вирусным белком – крайне простого и эффективного механизма защиты вируса, основанного на результатах одиночных мутационных событий. Нельзя не учитывать и другие возможные последствия формирования «ионного щита»: например, заряженные частицы на поверхности вируса могут облегчать его слияние с клеточной мембраной и проникновение в клетку.
В пространственной структуре поверхностного белка вируса гриппа обнаружено множество сайтов связывания различных ионов (а также потенциальных мест такой посадки), благодаря чему вокруг вируса может формироваться своеобразный ионный щит, защищающий его от атак иммунной системы
Высказанные нами предположения, позволившие сформировать новый взгляд на проблему механизмов защиты вирусов от атаки иммунной системы организма-хозяина, а также обнаружить новых молекулярных участников, задействованных в процессе проникновения вируса внутрь клетки, безусловно, требуют дальнейшего анализа и экспериментальной проверки.
Однако то, что ионы могут быть важными факторами, регулирующими жизненный цикл вируса гриппа, уже не вызывает сомнения. Как и то, что исследования подобных молекулярных механизмов будут содействовать открытию новых фармакологических мишеней и созданию эффективных вакцин и лекарственных препаратов.
Что такое гемагглютинин вируса гриппа
Вирус гриппа типа А (ВГА) является одним из важнейших инфекционных агентов человека и животных. Столь высокий потенциал ВГА связан с их быстрой эволюцией, в результате чего может повысить свою патогенность по отношению к птице и приобрести эпидемическую опасность [1]. Возбудителем болезни является ВГА семейства ортомиксовирусов, имеющих подтиповые варианты, которые устанавливаются двумя наружными белками – гемагглютинином (Н1-Н16) и нейраминидазой (N1-N10). Гемагглютинин и нейраминидаза являются факторами агрессии вируса гриппа. Интенсивность интоксикации при гриппе определяется свойствами гемагглютинина, а нейраминидаза обладает выраженным иммунодепрессивным действием. Оба поверхностных антигена характеризуются выраженной способностью к изменчивости, в результате чего появляются новые антигенные варианты вируса. Гемагглютинины 1, 2, 3-го типов и нейраминидазы 1, 2-го типов содержат вирусы, которые поражают человека. Другие антигены характерны для вирусов гриппа животных (свиней, собак, лошадей, многих видов птиц и др.) [2].
Эффективная борьба с ВГА невозможна без своевременной и достоверной серологической диагностики, а также проведения постоянного диагностического мониторинга эпизоотической обстановки, которые являются первоочередными задачами медицинской и ветеринарной служб.
Основная роль в диагностике и профилактике вирусных заболеваний принадлежит специфическим сывороточным препаратам, получаемым от различных животных – продуцентов [3]. Экспериментально доказано, что большое значение в получении активных и специфичных антисывороток имеют неспецифические стимуляторы антителообразования или адъюванты, а также доза и пути введения антигена [4].
В связи с этим получение высокоактивных и специфических диагностических препаратов к ВГА актуально в том плане, что появится возможность своевременного, высокоэффективного и точного типирования ВГА на территории Республики Казахстан.
Цель исследования
Выделение НА подтипов ВГА и на их основе получение диагностических препаратов.
Материалы и методы исследования
Вирус: В работе использовали штаммы А/утка/Альберта/35/76 (Н1N1), А/серебристая чайка/Атырау/2186/07 (Н2N2), А/утка/Германия/215/73 (Н2N3), А/чирок свистунок/Коргалжын/1797/06 (Н3N8), А/малая поганка/Алаколь/791/04 (Н4N6), А/домашний гусь /Павлодар/1/05(Н5N1), А/duch/Singapore-Q/F-119-2/97 (Н5N3), A/turkey/Massachusetts/3740/65 (Н6N2), А/цыпленок/Росток/29 (Н7N1) и А/черноголовый хохотун/Атырау/284/02 (Н13N6) ВГА, которые находятся в лаборатории «Коллекция микроорганизмов» РГП НИИПББ КН МОН РК. Данные штаммы были выращены в РКЭ согласно установленным регламентам [5].
Животные. В качестве доноров противогриппозных антител к подтипам ВГА служили кролики и козы местной породы в возрасте до одного года. Использование высокоспецифичных антисывороток, полученных от этих животных, рекомендовано Экспертным комитетом ВОЗ для уверенного антигенного субтипирования HА и NА ВГА, так как они дают самые минимальные неспецифические реакции [6].
Очистка суспензий ВГА. Вируссодержащую суспензию ВГА осветляли центрифугированием при 3000 об/мин, затем рН доводили до 8,5, и с целью концентрирования к суспензии добавляли ПЭГ-6000 до конечной концентрации 7 % и оставляли в течение 24 ч при 4 °C. Далее вирус осаждали центрифугированием при 5000 g в течение 1 ч. Затем вирус подвергали ультрацентрифугированию при 106000 g в течение 2 ч. Осадок вируса гомогенизировали и осветляли при 5000 g в течение 10 мин. Вирус при необходимости, очищали в градиенте плотности (20–60 %) сахарозы. Очищенный вирус ресуспендировали в 100-кратном объёме стерильного 0,05 М фосфатно-буферного раствора с рН 7,2–7,4.
Выделение HA+NA ВГА. Очищенные препараты ВГА разрушали тритоном в конечной концентрации 0,5 % в течение ночи при 4 °С. Для выделения фракции HA + NA, разрушенный вирус наслаивали на 25 % сахарозу и центрифугировали 1,5 часа при 250000 g при 4 °С. Верхний слой, над сахарозой, согласно методике, содержал фракцию очищенных поверхностных белков вируса гриппа (HA – NA). Далее фракцию HA – NA диализовали в течение 3 суток против 0,01М ФБС. Очищенный препарат должен содержать только HA – NA.
Разделение НА от NA. Очистку НА от NA проводили с помощью адсорбции на формалинизированных эритроцитах петуха в течение 10–15 мин при 4 °С. Элюция НА с эритроцитов осуществлялась теплым физиологическим раствором в течение 4–6 ч при 37 °С.
Получение антисывороток. Схема гипериммунизации кроликов состояла из 3 введений HA в возрастающей дозе (512, 1024 и 2048 ГАЕ/кг) в область надколенных лимфоузлов задних ног с интервалом между введениями в 1 неделю в комплексе с адъювантом ISA-71, в соотношении 1:1. За неделю до начала цикла гипериммунизации кроликам вводили, в область надколенных лимфоузлов задних ног по 0,5 мл HA+NA.
Схема гипериммунизации коз также состояла из 3 введений HA, в возрастающей дозе (512,1024,2048 ГАЕ/кг) в область предлопаточных лимфоузлов с интервалом между введениями в 1 неделю в комплексе с сапонином (2–3 введение). За 21 день до начала цикла гипериммунизации козам вводили HA в дозе 256 ГАЕ/кг массы тела.
Постановка РГА и РТГА. Гемагглютинирующую активность вируса определяли в РГА микрометодом по общепринятому методу [5].
Реакцию РТГА проводили микрометодом в 96-луночных планшетах фирмы «Costar» (США) согласно рекомендациям МЭБ [5].
Содержание белка определяли по методу Lowry [7], используя в качестве стандарта БСА фирмы «Sigma» (США).
Результаты исследования и их обсуждение
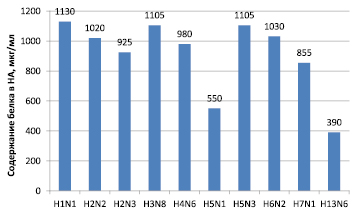
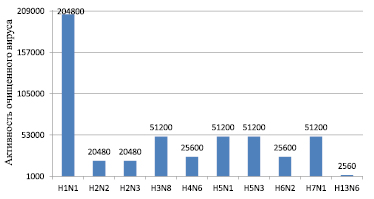
Как известно, препаративное выделение высокоочищенных антигенов вируса гриппа является одним из важнейших этапов получения диагностических иммунореагентов. Для очистки вируса из вируссодержащих суспензий нами был применен широко используемый метод осаждения и очистки вируса гриппа с помощью ПЭГ-6000 с последующим ультрацентрифугированием и осветлением. Результаты концентрирования белка и активности в РГА очищенных подтипов ВГА представлены на рис. 1 и 2.
Рис. 1. Концентрация белков подтипов ВГА
Рис. 2. Активность очищенных препаратов подтипов ВГА в РГА
Очищенный вирус представлял собой гомогенный препарат, гемагглютинирующая активность составляла 1:2560–2048000, при исходной активности вируса 1:512–1:1024, содержание белка 390–1130 мкг/мл. Очищенные препараты были использованы для выделения гемагглютинина и нейраминидазы.
Выделение гемагглютинина и нейраминидазы в чистом виде связано с определёнными трудностями. Оба антигена являются гликопротеидами и прикрепляются к липидной оболочке вируса последовательностями гидрофобных аминокислот.
Для снятия с поверхности вириона гликопротеинов ортомиксовирусов обычно используют большой спектр реагентов. Чаще других неионные детергенты Тритон Х-100, NP-40, Твин-20, эфир, ионный детергент додецилсульфат натрия (ДСН), а также бромелайн и n-октилглюкозид (октилглюкопиранозид, 1-O-n-octyl-β-d-glucopyranoside) [8].
В результате проведенных исследований было установлено, что оптимальным реагентом для получения чистого препарата НА ВГА оказался тритон Х-100.
Активность очищенных препаратов ВГА исследовали в РГА. Результаты представлены на рис. 3.
Рис. 3. Активность НА подтипов ВГА в РГА
Рис. 4. Активность антисывороток к НА подтипов ВГА в РТГА
В результате очищенные препараты НА ВГА показали высокую гемагглютинирующую активность в РГА – с 1:128 до 1:2048. Очищенные препараты (НА) в дальнейшем были использованы для получения специфических сывороток к НА Н1, Н2, Н3, Н4, Н5, Н6, Н7 и Н13 ВГА на козах и кроликах.
В практике чаще всего применяют введение возрастающих доз антигена с интервалами в 4–5 и более дней. Способствует повышению иммунологической реактивности продуцентов гипериммунизация [4].
Через 7 суток после последней инъекции у коз и кроликов брали пробу крови и проводили контроль активности антителообразования в РТГА (рис. 4).
Как видно из рис. 4, активность антисывороток к НА, полученных на кроликах, составила в РТГА 1:256-1:16368, активность козьих антисывороток составила в РТГА 1:256-1:4096.
Полученные антисыворотки к НА Н1, Н2, Н3, Н4, Н5, Н6, Н7 и Н13 ВГА на козах и кроликах были проверены на специфичность и чувствительность методами ИФА (набор ФГБУ «ВНИИЗЖ») и РТГА (набор ОАО «Покровский завод биопрепаратов»). В результате опыта приготовленные препараты оказались пригодными для ИФА и РТГА для диагностики ВГА.
Заключение
В результате проведённых исследований, из концентрированных и очищенных препаратов штаммов ВГА А/утка/Альберта/35/76 (Н1N1), А/серебристая чайка/Атырау/2186/07 (Н2N2), А/утка/Германия/215/73 (Н2N3), А/чирок свистунок/Коргалжын/1797/06 (Н3N8), А/малая поганка/Алаколь/791/04 (Н4N6), А/домашний гусь /Павлодар/1/05(Н5N1), А/duch/Singapore-Q/F-119-2/97 (Н5N3), A/turkey/Massachusetts/3740/65 (Н6N2), А/цыпленок/Росток/29 (Н7N1) и А/черноголовый хохотун/Атырау/284/02 (Н13N6) вируса гриппа типа А были выделены и очищены гемагглютинин, и на основе НА были получены активные и специфичные сыворотки на козах и кроликах. Полученные препараты были апробированы методами ИФА (ФГБУ «ВНИИЗЖ») и РТГА (ОАО «Покровский завод биопрепаратов»).
Приготовленные препараты могут быть использованы в диагностических тест-системах (РТГА и ИФА) с целью типирования вируса гриппа типа А и для определения напряженности иммунитета.
Что такое гемагглютинин вируса гриппа
Патогенетические процессы, происходящие при проникновении вируса гриппа в организм человека, чрезвычайно сложны. Основной мишенью вируса являются клетки однослойного многорядного цилиндрического реснитчатого эпителия дыхательных путей. Для заражения, вирус должен преодолеть факторы неспецифической резистентности дыхательных путей: вязкие свойства слизи, постоянное движение ресничек цилиндрического эпителия, неспецифические ингибиторы репликации вируса, которые содержатся в слизи секрета дыхательных путей, макрофаги, захватывающие вирус и таким образом приостанавливающие его действие, секреторные IgA.
После проникновения вирус прикрепляется с помощью гемагглютинина к рецепторам клеток-мишеней и проникает внутрь, где происходит внутриклеточный цикл репликации. Уже через 4-6 часов в клетке создается партия новых вирусов, которая «выталкивается» из клетки через поры мембраны. Через 24 часа число вирусов, предшественник которых проник в клетку, может достигать нескольких сотен миллионов. Важную роль в высвобождении вируса играет нейраминидаза, предотвращающая аггрегацию вирионов-потомков. Она обеспечивает два важнейших процесса: проникновение вирусной частицы в клетку-хозяина и способность вирусных частиц выходить из клетки после размножения.
Гемагглютинин способен вызывать агглютинацию (склеивание) эритроцитов, что обеспечивает возможность вируса гриппа закрепиться на клетке организма человека. Молекулярными структурами, ответственными за гемагглютинирующую активность вируса гриппа, являются равномерно распределенные радиальные поверхностные выступы, образуемые субъединицами гликопротеида. Удаление этих выступов приводит к потере инфекционности и гемагглютинирующей активности. Таким образом, взаимодействие гемагглютинина с клеточной мембраной является первым этапом инфекционного цикла.
Освободившиеся вирионы поражают соседние клетки, часть вирусов проникает в кровь. Поражённые эпителиальные клетки теряют продолговатую форму, округляются, ядро их сморщивается и фрагментируется. Происходит вакуолизация цитоплазмы с появлением в ней базофильных и оксифильных включений, теряются реснички. Последующая гибель этих клеток обусловлена не столько цитопатогенным действием вируса гриппа, сколько неспособностью клетки полностью восстанавливаться после активного потребления её ресурсов в процессе синтеза в клетке всех компонентов вирусного нуклеокапсида.
Особое внимание привлекает патогенное воздействие вируса гриппа на эритроциты. Изменяется и форма эритроцитов. Эритроциты изменённой формы характеризуются нарушенной деформабельностью; это взаимосвязано со способностью к агрегации, что в свою очередь оказывает влияние на выполнение эритроцитами своих жизненно важных функций и на состояние микроциркуляции в целом. При комплексном исследовании были выявлены взаимосвязанные нарушения гемостаза и микроциркуляции при гриппе ‒ повышение агрегационной способности эритроцитов с формированием их многомерных конгломератов способствует повышению вязкости крови, тканевой гипоксии, микроциркуляторному блоку. Увеличение вязкости крови в свою очередь приводит к агрегации форменных элементов и сопровождается снижением объёмной скорости выброса и кровотока, что может стать первопричиной возрастания нагрузки на миокард. Эти гемодинамические нарушения также способствуют изменению калибра сосудов, внутрисосудистой агрегации, развитию сладж-феномена через замедление кровотока.
Таким образом, патогенетические процессы, происходящие при проникновении вируса гриппа в организм человека, имеют обширную направленность и способны произвести мощный разрушающий «удар» как по клеткам, тканям и системам органов, так и по организму в целом.