Что такое генетическая запрограммированность
Генетические программы онтогенеза



По современным представлениям, в зачатке особи (например, в зиготе) заложена программа развития особи. В ходе онтогенеза происходит реализация этой программы в результате взаимодействия между ядром и цитоплазмой, между разными частями зародыша; в общем, между молекулярно-генетическими факторами, с одной стороны, и внутренней и внешней средой, с другой.
Доказана генетическая запрограммированность продолжительность жизни. Какие бы идеальные условия ни были созданы для лабораторных мышей, они живут не более 3…3,5 лет, причем есть линии короткоживущие и долгоживущие. На среднюю продолжительность жизни существенно влияют внешние факторы, но максимальную продолжительность жизни изменить очень трудно. Так, средняя продолжительность жизни человека за последние 100 лет увеличилась примерно в два раза, тогда как на максимальной продолжительности жизни это никак не сказалось.
Молекулярные механизмы генетической детерминации продолжительности жизни до сих пор детально не изучены, хотя в геронтологии выдвинуто множество гипотез, объясняющих закономерности старения. Например, допускается, что старение начинается с накопления повреждений в ДНК, которые постепенно разрушают систему генетической регуляции. Ионизирующие излучения и химические мутагены, дефекты репарации ДНК, ускоряющие накопление повреждений в геноме, снижают продолжительность жизни. Наконец, эндогенные факторы, в частности свободные радикалы – побочные продукты клеточного метаболизма, в числе других химических компонентов клетки повреждают и генетические молекулы. Предполагается, что нарушение генов регуляции систем репарации, постепенно развивающееся под действием эндогенных факторов, приводит к накоплению ошибок в процессе «текущего ремонта» ДНК вплоть до ее деградации с последующей гибелью клетки.
Запрограммированность продолжительности жизни. Генетическая программа самоликвидации клеток организма
Размышления о смысле понятия «программа» приводят нас к выводу о том, что это понятие предполагает существование определенной цели, достижению которой она служит. В этом смысле можно говорить, что многие полезные признаки сельскохозяйственных животных и растений генетически запрограммированы, поскольку в отношении этих признаков долгое время велся целенаправленный отбор. В случае же естественных условий жизни выбор цели определяется борьбой за существование и отбором по тем признакам и в том конкретном направлении, которые способствуют выживанию в данных конкретных условиях.
Таким образом, о запрограммированности признака можно говорить только тогда, когда существует понятие цели и можно ответить, кем (человек) или чем (эволюция) такая программа была сформирована. Следовательно, вопрос о запрограммированности продолжительности жизни сводится к выяснению ее значения для биологической эволюции.
Если с эволюционных позиций подойти к проблеме запрограммированности продолжительности жизни, то становится очевидным, что специальные механизмы, сокращающие жизнь, вряд ли могли способствовать успешной борьбе особей за свое существование. Скорее наоборот, те особи, у которых действие подобной программы самоуничтожения было бы нарушено в результате случайной мутации, быстро вытеснили бы всех остальных, поскольку за свою более длительную жизнь они производили бы больше потомства.
Тем более удивительно, что убеждение в существовании специальной генетической программы самоликвидации организма широко распространено и активно пропагандируется. Например, в одном из учебников по биологической кибернетике для студентов изложению подобных представлений посвящен специальнй раздел и даже курсивом выделено утверждение об «активном дополнительном регуляторном механизме, который на определенном этапе онтогенеза вступает в борьбу с механизмами обеспечения жизни и прерывает ее течение» [Коган и др., 1977, с. 65].
Наконец, даже в аком респектабельном издании, как «Британская энциклопедия», к ожно прочесть следующее: «В коде генетического материала находятся инструкции, которые определяют возраст, свыше которого вид не может прожить даже при наиболее благоприятных условиях» [The New Encyclopaedia Britannica, 1989, vol. 20, p. 471]. Ни одно из этих утверждений не является доказанным, и, более того, как уже отмечалось, подобные утверждения даже теоретически несостоятельны. Однако, учитывая популярность таких представлений, следует более тщательно отнестись к их проверке, не ограничиваясь ссылками на их недоказанность и теоретическую несостоятельность, а обратившись к анализу реальных данных.
На первый взгляд может показаться очевидным, что проверка гипотезы генетически запрограммированной смерти возможна только с помощью прямых молекулярно-генетических, биохимических, цитологических и физиологических экспериментов. Казалось бы, данные о распределении продолжительности жизни организмов в различных популяциях здесь абсолютно бесполезны. Однако при более глубоком анализе проблемы можно предложить, по крайней мере, два разных способа использования таблиц продолжительности жизни, позволяющих провести достаточно надежную проверку гипотезы запрограммированной смерти.
Первый способ проверки основан на сопоставлении таблиц продолжительности жизни особей одного вида, полученных в естественных (диких) и искусственных (лабораторных, домашних, цивилизованных) условиях. Если проверяемая гипотезы верна, то между такими таблицами не должно быть слишком больших различий по срокам жизни взрослых особей. Действительно, чтобы программа самоликвидации могла возникнуть, закрепиться и сохраниться в ходе эволюции, она по меньшей мере должна иметь возможность хоть как-то проявиться в естественных (диких) условиях.
Следовательно, возраст включения такой программы должен быть не очень большим, иначе в результате высокой смертности в диких условиях от хищников, голода и инфекций и суровых природных условий просто никто не доживет до рокового возраста и механизм самоликвидации не успеет даже проявиться. Отсюда следует, что продолжительность жизни даже в самых благоприятных условиях не может существенно превышать тех сроков, до которых в диких условиях доживает наиболее выносливая часть популяции, если, конечно, проверяемая концепция верна.
Теперь, если мы обратимся к анализу реальных данных, мы увидим картину, прямо противоположную тому, что следовало ожидать из проверяемой концепции: продолжительность жизни организмов в благоприятных для долголетия условиях намного превышает те сроки жизни, которые наблюдаются в естественных (диких) условиях. Ввиду обилия подобных фактов, ограничимся лишь некоторыми примерами.
Известно, что в благоприятных условиях зяблик (Fringilla coelebs) может прожить 29 лет [Комфорт, 1967]. Однако в диких условиях это практически исключено, поскольку вследствие голода, холода, болезней и нападений хищников около половины птиц погибает в течение одного года, и средняя продолжительность их жизни составляет всего 1,4—1,5 года [Паевский, 1985]. В результате такой высокой смертности до возраста И лет доживает лишь О, IX исходного числа зябликов [Там же].
Аналогичные результаты получены и для полевок (Mircrotus arvalis Pall). В лабораторных условиях средняя продолжительность жизни полевок составляет 7—8 месяцев, причем отдельные экземпляры доживают до 25 месяцев. В диких же условиях средняя продолжительность жизни полевок составляет всего 1,2 месяца, а до возраста 10 месяцев доживает только 0,1% исходного их числа [Фе- нюк, Шейкина, 1940]. Таким образом, если оценить возраст запрограммированной смерти по продолжительности жизни в лабораторных условиях, то становится очевидным, что никакая программа самоликвидации не могла ни возникнуть, ни сохраниться в эволюции, хотя бы уже потому, что она никак не могла проявиться в естественных условиях, где практически никто не доживает до таких возрастов.
Тот же вывод получается при анализе данных по продолжительности жизни человека. В настоящее время средняя продолжительность жизни в развитых странах достигает 70—80 лет, а подтвержденный рекорд долголетия составляет 120 лет.
Если мы примем эти числа в качестве оценки возраста включения программы самоликвидации, то мы должны признать, что подобная программа никак не могла проявиться в эволюции человека, поскольку, согласно данным палеодемографии, до таких возрастов практически никто не доживал. Например, по данным Ачади и Немешкери [Acsadi, Nemeskeri, 1970], возраст, до которого доживала только половина всех родившихся, составлял в позднем палеолите всего 8—9 лет, а в неолите — 26 лет.
Более того, даже в эпоху средневековья (IX—XII в.) ожидаемая продолжительность жизни при рождении не превышала 27—29 лет. Изучение скелетов американских индейцев показало, что всего два века назад до возраста 50 лет доживало только 4% населения [Owsley, Bass, 1979]. Для сравнения отметим, что сейчас вероятность дожития до этого возраста в развитых странах составляет 94—96Х. Если сопоставить эти факты, то трудно удержаться от вопроса: неужели гарантированное уничтожение нескольких случайно уцелевших и обреченных в диких условиях стариков может быть достаточным эволюционным основанием для формирования и сохранения в геноме человека специальной программы самоликвидации? С этих позиций абсурдность гипотезы запрограммированной смерти становится очевидной.
Приведенные факты, несмотря на их принципиальное значение, могут, однако, показаться недостаточно убедительными для тех, кто скептически относится к теории эволюции и склонен усматривать в ограниченных сроках жизни промысел божий. Поскольку время нашей жизни ничтожно по сравнению с характерными временами биологической эволюции, аргументы, построенные на эволюционных соображениях, для таких людей могут показаться слишком абстрактными и гипотетичными. Нам приходилось сталкиваться и с такой позицией: «Все это было настолько давно, что теперь уже никто не может знать, как оно было на самом деле». И хотя приведенные выше эволюционные аргументы неоднократно высказывались, начиная с 50-х годов нашего века [Medawar, 1957; Williams, 1957], эти аргументы принимаются далеко не всеми исследователями.
Код жизни: прочесть не значит понять
Код жизни: прочесть не значит понять
Секвенирование геномов — это не только самые современные приборы, но и большой объем вычислений на суперкомпьютерах!
Авторы
Редакторы
Последний год жизни авторы этой статьи посвятили созданию инфраструктуры по получению, хранению и анализу кода жизни — генетической информации, которая записана в молекуле ДНК. Что такое ДНК с точки зрения математика, каковы основные принципы построения компьютерной архитектуры для анализа огромных массивов генетической информации и что ждать в будущем от тотальной прозрачности и доступности теперь уже и нашего индивидуального кода жизни, — обо всём этом расскажет предлагаемая вашему вниманию статья.
Сегодня все знают, что информация, необходимая оплодотворённой яйцеклетке, чтобы развиться сначала в эмбрион, а потом и во взрослый организм, записана в молекулах ДНК, последовательность нуклеотидных остатков в которой можно представить в виде текста. В этом тексте, как и в любом другом, самое важное — это последовательность букв (в ДНК их, как известно, всего четыре). Совокупность всех молекул ДНК ядра клетки (каждая из которых, взаимодействуя с белками, образует отдельные хромосомы) называют ядерным генóмом (митохондрии, бывшие в незапамятные времена свободноживущими микроорганизамами, имеют свой собственный геном). К примеру, бактерии, обитающие у нас в кишечнике и помогающие переваривать пищу, имеют геном длиной порядка нескольких миллионов букв. Простая вошь — уже 500 миллионов, а геном человека составляет более трех миллиардов букв. Для сравнения, все четыре тома «Войны и мира» Толстого содержат около двух миллионов букв, — т. е., примерно эквивалентны генетической информации бактерии, а геном человека можно сравнить со всей библиотекой Толстого в Ясной Поляне. (С другой стороны, объём кинофильма в формате Blu-ray уже существенно превосходит размер генома, — так что говорить нужно, конечно, не только об объёме информации, но и о её «качестве».)
В первом приближении можно считать, что все клетки взрослого человека имеют один и тот же генетический текст. («Нормальное» исключение составляют половые клетки и лимфоциты, а патологическое — клетки раковой опухоли.) Так же, как и в книге, где фрагменты текста объединяются в главы, в геноме протяжённые последовательности нуклеотидов объединяются в гены, контролирующие функции клетки и организма [1]. Лишь десять лет назад геном человека был в общих чертах «прочитан» — в 2000 году две команды исследователей объявили о независимом друг от друга завершении проекта по секвенированию (определению последовательности ДНК) генома человека. Результат их работы сейчас считается «золотым стандартом» генома человека (то, с чем исследователи, как с эталоном, сравнивают вновь полученные генетические тексты). Общие затраты на эту работу оцениваются в интервале 3–10 миллиардов долларов [2].
Словарик
Читать — не перечитать
За прошедшие 10 лет технологии расшифровки генетических последовательностей развивались очень бурно, — в первую очередь, благодаря миниатюризации и автоматизации [3]. Следующее поколение методов секвенирования «информационных» молекул, будет, несомненно, связано с переходом к определению последовательности единичных молекул ДНК/РНК с применением нанотехнологических подходов. (Подробнее об этих технологиях, уже делающих первые уверенные шаги, «биомолекула» как-нибудь обязательно расскажет.)
Современная геномная лаборатория — например, Лаборатория геномики в Курчатовском Институте в Москве, — способна за один день «начитать» последовательность длиной до 20 миллиардов нуклеотидов. Что же касается стоимости таких работ, — прочтение одного человеческого генома уже подешевело почти до 10 000 долларов, — т. е., за 10 лет цена упала на 6 порядков (в миллион раз!). По оценкам экспертов, ценовой рубеж, когда персональная геномика войдёт в жизнь каждого из нас через медицину, страховки, работодателей и через прочие социальные институты, составляет 1000 долларов за индивидуальный геном. По всей видимости, он будет достигнут в ближайшие 5 лет.
Видимо, следует сделать оговорку — каждым из 6 миллиардов, достаточно обеспеченным, чтобы позволить себе тратить деньги на такие «пустяки». — Ред.
Внешние отличия, умственные способности и даже психологические особенности каждого человека в той или иной степени заложены в его геноме [4]. (Конечно, не стоит считать эти качества 100%-предопределёнными.) Считается, что основные генетические отличия одного человека от другого сосредоточены в однобуквенных заменах — своеобразных «опечатках» или «вариантах» текста ДНК, называемых однонуклеотидными полиморфизмами (ОНП). Как одна буква в названии книги «Война и мир» способна изменить его смысл (к примеру «Война и мор»), так и замены в генетических текстах могут привести к тому, что, например, одни люди будут болеть чаще, чем другие. Одни из нас — высокие и черноглазые, а другие — низкие и с голубыми глазами, и этим мы тоже обязаны генам. (И не только мы — например, «белая» окраска лошадей тоже обусловлена генетически [5].)
Зная генотип человека, теоретически можно предсказать многие его характерные черты, — не только цвет глаз и рост, но и предрасположенность к заболеваниям (именно это больше всего и интересует учёных и врачей) и даже к вредным привычкам [6]! Однако самое сложное здесь то, что большинство таких признаков определяется совокупностью большого, хотя и конечного числа «опечаток» в геноме, которые потребуется обнаружить. Результат появления той или иной «опечатки» не всегда бывает предсказуемым и понятным. Зачастую эффект от замены одной буквы слишком незначителен, и у исследователей нет ясности, как она в принципе может влиять на фенотип. Однако совокупность сотен и тысяч ОНП может эмпирически коррелировать с тем или иным признаком, хотя механизм, обусловливающий связь с признаком, может оставаться загадкой. Для этого необходимы данные о генотипах различных групп людей — как здоровых, так и больных, — чтобы иметь достаточную статистику для анализа отличий в геномах и поиска тех «опечаток», которые ответственны за склонность к заболеванию. (Подробнее о таких исследованиях, получивших название GWAS — genome-wide association studies — см. в статье «Загадочная генетика „загадочной болезни кожи“ — витилиго» [7].) Например, для проекта по исследованию рака почки генотипировано больше 12 тысяч человек. Таких проектов в мире можно насчитать уже несколько десятков, — то есть, всего насчитывается уже несколько сотен тысяч людей с установленными генотипами. Кстати говоря, уже и число полных геномов перевалило за тысячу [8].
Технология
Современные технологические платформы, предназначенные для чтения генетических текстов (для простоты такие приборы называют секвенаторами «нового поколения»), определяют последовательность не всей молекулы ДНК за раз, а лишь достаточно скромных её фрагментов — при большей длине, увы, возникает слишком много ошибок. Стадии секвенирования предшествует случайное «измельчение» ДНК на отрезки со средней длиной 500 нуклеотидов; само «считывание» осуществляется сразу с двух физических концов этого отрезка, в результате чего образуется пара фрагментов «текста» ДНК. Длина таких фрагментов, являющихся основным результатом работы секвенатора и на жаргоне именуемых «ридами» (от англ. read — читать), колеблется (в зависимости от производителя оборудования) в диапазоне 35–400 букв. Следует отметить, что большáя часть последовательности фрагмента неизбежно остаётся непрочитанной, поскольку длины «рида» (допустим, 100 букв) не хватает, чтобы перекрыть всю длину фрагмента (≈500 букв).
Подробнее об инструментальных основах секвенирования мы уже писали (см. «454-секвенирование (высокопроизводительное пиросеквенирование ДНК)» [3]); сейчас же разговор пойдёт главным образом о том, как скомбинировать из огромной библиотеки фрагментов текста «готовую» генетическую последовательность, как она записана в геноме. Современный прибор за один запуск длительностью около 10 дней способен сгенерировать до 300 миллионов пар «ридов» (рис. 1). Точная сборка этого «стройматериала» в геномную последовательность — проблема не из лёгких, и решаться она может двумя путями, в зависимости от наличия «эталонного» генома.
Рисунок 1. Секвенаторы SOLiD компании Applied Biosystems (Life Technologies) в лаборатории Queensland Centre for Medical Genomics, Австралия. Одна из миссий центра — «разрабатывать и улучшать технологию для рутинного анализа полной последовательности человеческого генома». Научных институтов, ориентированных на развитие «персонализованной медицины», с каждым годом становиться все больше и больше.
Задача первая: ресеквенирование
Возвращаясь к аналогии с произведением Льва Николаевича, ресеквенирование можно сравнить с поиском опечаток в исходном тексте «Войны и мира». Мы считаем, что геном изучаемого объекта имеет то же строение, что и «золотой стандарт» генома 2000-го года (хотя и этот эталон постоянно уточняется — сейчас доступна уже 37-я его версия). Сопоставляя участки текста, для каждого из многих миллионов «ридов» определяются его координаты на одной из хромосом: «страница», «абзац», «отступ слева» и т. д. В случае если обнаруживается расхождение с эталоном — опечатка, маленькая вставка или выпадение текста (на жаргоне такие отличия называют short indels — short insertions/deletions), — эти вариации включаются в отчёт о сравнении. Так, сравнивая миллионы и миллиарды «ридов» с исходным текстом, можно получить полный перечень отличий изучаемого генома от эталонного «золотого стандарта». Более того, если каждая буква исходного текста проверяется многократными прочтениями, это увеличивает статистическую достоверность найденных генетических особенностей и аномалий. Сегодня считается, что геном ресеквенирован с высоким «покрытием» (deep sequencing), если каждая его буква была прочитана в среднем 30 раз или более (30×).
С точки зрения биоинформатических алгоритмов, ресеквенирование — это относительно лёгкая процедура: для обработки данных от одного запуска прибора требуется всего около 10 часов работы программы на 20 процессорных ядрах и 20 Гб оперативной памяти.
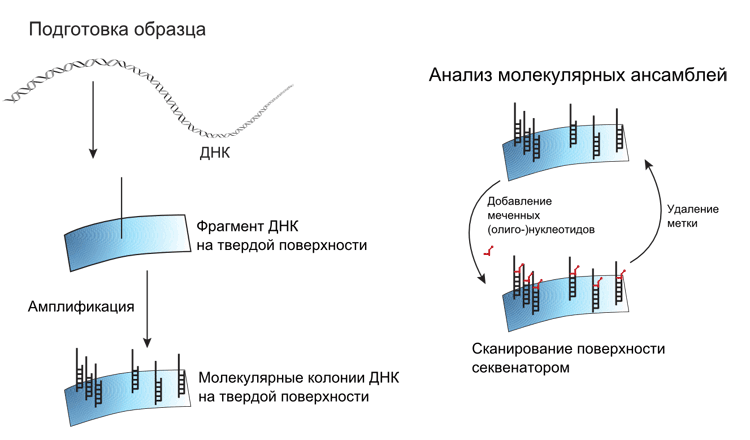
Рисунок 2. Общий принцип секвенирования нового («второго») поколения. Первый этап процесса подготовки образца состоит из фрагментации длинных молекул ДНК ультразвуком или каким-нибудь другим методом, не зависящим от последовательности ДНК, до размера 250–500 пар нуклеотидов. Далее следует стадия, во время которой концы ДНК-фрагментов приводятся в порядок: сначала удаляются или достраиваются выступающие концы молекул, затем лигируются адаптерные олигонуклеотиды. Полученная библиотека предварительно амплифицируется для увеличения представленности каждого фрагмента ДНК. Последний шаг — создание молекулярных колоний — клональная амплификация каждого фрагмента библиотеки на твердой поверхности. Все это происходит вне секвенатора. Расшифровка последовательности ДНК-фрагментов происходит через параллельный анализ миллионов и даже миллиардов молекулярных ансамблей в секвенаторе. В приборе стадии подачи реактивов для секвенирования (нуклеотидов или олигонуклеотидов с флуорофором и соответствующих ферментов) чередуются со стадиями сканирования поверхности и регистрации получаемых изображений.
Задача вторая: секвенирование de novo
Вторая задача является и экспериментально, и алгоритмически, и вычислительно более сложной — тут требуется реконструировать текст из набора «ридов», не имея эталона для сборки. Подход основан на том, что, в силу случайности разбиения молекул ДНК на фрагменты, при достаточно плотном «покрытии» обязательно найдутся несколько частично перекрывающихся «ридов», при совмещении которых текст будет постепенно наращиваться. «Подрастающий» текст (в данном случае называемый контигом) используется для поиска среди миллиарда «ридов» такого, который максимально (но не полностью) с ним перекрывается.
Процедура объединения контигов продолжается до тех пор, пока с обоих концов фрагмента генетического текста не начнутся области протяжённых повторов, характерные для «кончиков» хромосом. Если повтор имеет длину большую, чем длина «рида», то его длина, а значит, и точная последовательность, остаётся неизвестной. Однако здесь на помощь приходит информация о парности чтений: как правило, они находятся на более-менее известном расстоянии друг от друга. Таким образом, если одно из чтений пары попадает на один контиг, а второе — на другой, то эти контиги можно объединить в связку, называемую скаффолдом. Впоследствии непрочитанные «дыры» в скаффолдах можно будет прочесть другими методами. Сборка de novo является алгоритмически сложным и вычислительно затратным процессом.
Рисунок 3. Повторное секвенирование («ре-секвенирование») генома с целью выявления разнообразных структурных вариаций (однонуклеотидных полиморфизмов, или «снипов», а также инсерций, делеций, повторов, инверсий, транслокаций). В отличие от секвенирования неизвестных последовательностей de novo, при котором прочтения соотносятся друг с другом и собираются в контиги, для ре-секвенирования достаточно просто «картировать» прочтения на референсную последовательность, уже имеющуюся под рукой. Снипы выглядят как однонуклеотидные замены в коротких прочтениях, при этом количество прочтений с заменой говорит о состоянии аллеля — гомозиготном (все прочтения с заменой) или гетерозиготном (половина прочтений с заменой).
Такие задачи решаются с использованием теории графов, но идеального «сборщика» текстов для de novo-секвенирования ещё не создали. Основной проблемой сборки является наличие в генетических текстах длинных (от 200 до нескольких тысяч букв) элементов, содержащих повторы длиной от 4 до 150 нуклеотидных оснований. Очевидно, что именно из-за присутствия повторов текст во время сборки может оборваться. Для преодоления этого используют экспериментальные ухищрения, заключающиеся в генерации исходной библиотеки фрагментов со средней длиной не 500, а 3000 или даже 10000 букв. В этом случае существенно увеличивается вероятность захватить парой «ридов» уникальные участки текста, оставив повторы внутри.
Описав очень схематично схему алгоритма секвенирования, приступим к описанию вычислительных мощностей, которые авторы привлекают для анализа генетических текстов.
Секвенирование: без суперкомпьютеров не обошлось
«Сборка» текста генома из набора фрагментов, полученных на секвенаторе, — алгоритмически и вычислительно сложная задача, невозможная без использования суперкомпьютерных кластеров. Например, каждая сборка генома печёночного сосальщика, основанная на данных нескольких запусков секвенатора, требует до недели работы кластера из двух десятков узлов по 8 ядер и 8 Гб оперативной памяти в каждом (объединение по интерфейсу MPI). Однако одного запуска почти всегда недостаточно — таких сборок может быть несколько из-за необходимости подбора оптимальных параметров алгоритма и добавления новых экспериментальных данных. Есть и альтернативные варианты решения этой задачи, основанные не только на кластерах, но и популярных сегодня «облачных» вычислениях.
В целом, сборка de novo является более перспективным методом, чем ресеквенирование, и практически единственным подходом — когда эталонной последовательности генома исследуемого организма ещё не существует (как правило, для этого и проводится первое секвенирование). Оно позволяет выявлять существенные перестройки в геноме, обозревая его как одно целое. Впрочем, для многих практических целей и ресеквенирования бывает вполне достаточно.
Запрограммируй это
Читателю уже должно было стать ясно, что без серьёзных компьютерных мощностей решить задачу секвенирования генома шансов немного. Некоторые исследователи видят решение проблемы доступности дешёвых вычислений в так называемых «персональных суперкомпьютерах», под которыми имеются в виду системы на базе графических процессоров. Действительно, их специализация на операциях с векторами и массивная параллелизация находят всё более широкое применение во многих областях науки. В то же время относительно низкая цена и стоимость и владения такими компьютерами существенно снижают порог вхождения; их могут позволить себе не только институты, но и отдельные лаборатории.
Однако переход на новую технологию обязательно приносит с собой ряд проблем, и в биоинформатике они ощущаются особенно остро. В частности, часто необходимо использовать специальные алгоритмы, требующие от программиста знания архитектуры графических процессоров; в то же время большинство программного обеспечения в биологии разрабатывается биологами, для которых программирование — лишь дополнительный навык. Это же обусловливает и приверженность биологов к скриптовым языкам программирования: часто требуется написать простую программу «на раз» — только для проверки очередной гипотезы. Традиционно используемый в биоинформатике язык Perl на настоящий момент не имеет доступа к OpenCL (программный комплекс для облегчения программирования графических процессоров), хотя некоторые другие языки, например, Python или Java, уже оснащены привязкой к этому фреймворку.
Можно назвать три основных особенности использования графических сопроцессоров в геномной биоинформатике. Во-первых, это текстовый формат геномных данных, в то время как единого стандарта для их представления в удобном (с точки зрения вычислений, компактном и быстром) цифровом виде до сих пор нет. Во-вторых, высокая «квантуемость» данных («ридов» секвенатора, полиморфизмов и др.) способствует многопоточной обработке. И, в-третьих, огромные требования к оперативной памяти, запас которой непосредственно на графическом ускорителе пока относительно мал; это может привести к дополнительному усложнению и без того порой неочевидных алгоритмов.
Требования к аппаратному обеспечению, накладываемые практическими задачами, почти всегда опережают реальные возможности вычислительных машин. Для многих приложений биоинформатики — таких как сборка геномов de novo — часто не хватает ресурсов даже самых современных кластеров, включающих сотни вычислительных узлов, соединенных быстрой сетью Infiniband.
Возможное решение проблемы компьютерных мощностей — глобальная грид-инфраструктура, объединяющая десятки суперкомпьютерных центров и позволяющая использовать их мощности через единый интерфейс. Кроме того, грид-технология позволяет создавать распределённое хранилище данных, — а ведь когда речь идёт о геномике, дискового пространства не бывает много. Последнее время это направление распределённых вычислений очень активно развивается, — например европейский проект EGEE является примером создания крупнейшей грид-инфраструктуры, объединяющей участников из более чем 50 стран и включающей в себя более 260 компьютерных центров. Общее количество вычислительных ядер в этой сети более 150 тысяч, а дисковое пространство превышает 28 петабайт. Возможно, использование грид-технологий сможет отодвинуть границу доступных задач в биоинформатике уже в самом ближайшем будущем.
Секвенирование геномов в России
Надо сказать, что в нашей стране дела с полногеномным секвенированием не так уж и плохи. Первые секвенаторы «нового поколения» — приборы Applied Biosystems (сейчас в составе Life Technologies) SOLiD и Illumina GAII — заработали в Российском научном центре «Курчатовский институт» в начале 2009 года. В Лаборатории геномного анализа, которую возглавляет Егор Прохорчук (специально для этого вернувшийся из-за границы), и был расшифрован первый российский геном человека. Разумеется, русского человека. Предварительные результаты этой работы были опубликованы в отечественном журнале Acta Naturae [10]. В настоящее время в лаборатории ведется работа по расшифровке ещё нескольких человеческих геномов в рамках крупного международного проекта по исследованию раковых заболеваний.
Сейчас Курчатовский институт (со своим отдельным финансированием и руководством, не зависящим от Российской академии наук) является самым крупным российским геномным центром, заметным даже по европейским меркам (но не по американским или китайским, где число секвенаторов только одного типа может переваливать за сотню). Но и другие институты, уже в составе РАН, не отстают от «Курчатника» (см. таблицу). Как известно, Россия прирастает Сибирью. Сибиряки из Института химической биологии и фундаментальной медицины, что находится в новосибирском Академгородке, имеют в своём распоряжении две, в некотором смысле комплементарные, платформы для высокопроизводительного секвенирования — SOLiD и 454 FLX Titanium («Roche — всем хорош»). В институте работает центр коллективного пользования «Секвенирование ДНК», которым руководит доктор Игорь Морозов. Именно в этом ЦКП и осуществляется несколько различных научных проектов с использованием высокопроизводительных секвенаторов.
Медицинские НИИ тоже участвуют в полногеномных исследованиях. В НИИ физико-химической медицины в лаборатории профессора Вадима Говоруна прибор Applied Biosystems SOLiD 4 будет работать на благо российской биомедицины.
Также пара мощных приборов двух конкурирующих компаний (Life Technologies и Illumina) устанавливаются в Москве в Институте общей генетики РАН им. Н. И. Вавилова в лаборатории профессора Евгения Рогаева, известного и за рубежом российского ученого, прославившегося своими исследованиями болезни Альцгеймера, а также расшифровкой ДНК из останков царской семьи [11].
Ещё несколько приборов разбросанно по московским и периферийным институтам; один SOLiD скоро заработает в коммерческой компании, специализирующейся на предоставлении услуг по высокопроизводительному секвенированию и генотипированию. Такая картина не может не вселять определенный оптимизм в стороннего наблюдателя, следящего за вялым возрождением отечественной науки. Остается только с нетерпением ждать появления публикаций в престижных журналах, ведь у работ с привлечением (пока еще!) передовых методов и оборудования шансов на успех должно быть больше.
Заключение
Как же будет выглядеть персональная геномика через несколько лет? Нам видится, что буквально в каждом крупном городе будет лаборатория по чтению индивидуальных геномов. Скорее всего, не стоит опасаться того, что индивидуальная информация станет доступна лаборанту, обслуживающему секвенатор — он все равно не сможет её интерпретировать. Хотя, безусловно, сохранности персональной тайны пациента следует уделить самое пристальное внимание. Последовательности геномов будут поступать в единый информационный центр, который проведёт автоматизированный анализ и сравнение с геномами других людей, для которых уже создана история болезни. На основании этого можно будет делать индивидуальный прогноз для каждого пациента, который, быть может, ещё и не пациент вовсе, а всего лишь новорожденный.
Более того, все болезни, физические параметры, психофизиологические особенности, наблюдаемые у него в будущем, также можно будет занести в его персональный файл и соотнести с генетическим текстом. Приходя на приём к врачу, человек получит рекомендации по лечению и приёму лекарств, наиболее соответствующих его метаболизму и предрасположенностям.
| Название учреждения | Платформа |
|---|---|
| РНЦ «Курчатовский институт», Москва | Illumina GA IIx (×3) Applied Biosystems SOLiD 4 (×2) |
| НИИ химической биологии и фундаментальной медицины СО РАН, Новосибирск | Applied Biosystems SOLiD 4 454/Roche FLX Titanium |
| Инновационно-технологический центр «Биологически активные соединения и их применение» РАН, Москва | llumina GA IIx |
| Институт общей генетики им Н. И. Вавилова, Москва | Applied Biosystems SOLiD 4 llumina HiSeq 2000 |
| Институт молекулярной биологии им. В. А. Энгельгардта РАН, Москва | llumina GA IIx |
| Генаналитика, Москва | Applied Biosystems SOLiD 4 |
| Секретная станция переливания крови, Киров | 454/Roche FLX Titanium |
| Лимнологический институт СО РАН, Иркутск | 454/Roche FLX Titanium |
| Центр «Биоинженерия» РАН, Москва | 454/Roche FLX Titanium |
| НИИ физико-химической медицины, Москва | Applied Biosystems SOLiD 4 |
| Биологический факультет МГУ им. М. В. Ломоносова, Москва | Applied Biosystems SOLiD 4 |
. Над всем этим неумолимо нависает призрак киберпанка, предвосхищая растворение человека в океане цифр и знаков. Большой брат будет следить и за тобой. Но только если ты этого захочешь. Это наступит неотвратимо, но не через один год жизни...
Первоначально сокращённый вариант этой статьи был опубликован в журнале «Суперкомпьютеры» [9].
Статья написана в соавторстве с Чекановым Н.Н. и Теслюком А.Б. при участии коллектива «биомолекулы». Врезку, таблицу, картинки и «словарик» подготовил Павел Натальин.