Что такое генный допинг
Генетически модифицированные спортсмены: Чемпионы из пробирки
Всемирная антидопинговая ассоциация выделяет на разработку методов выявления генного допинга около миллиона долларов в год. По определению ВАДА генный допинг — это «нетерапевтическое применение клеток, генов, генетических элементов или модуляторов экспрессии генов, обладающих способностью повышать спортивные результаты». Экспрессия генов — это в конечном счете синтез закодированных в них белков. Под определение «генетические элементы» подходят, например, модифицированные гены, а «модуляторы экспрессии» — это, в частности, разные типы РНК, которые переносят информацию из ДНК или регулируют синтез белков. Начнем с самого простого — с клеток.
Клетки, на старт!
Применяют ли в спорте стволовые клетки? Вполне возможно — для ускоренного заживления травм. Их можно использовать для улучшения физической формы — ведь многие медицинские фирмы рекламируют клеточные технологии как средство оздоровления. При многих наследственных заболеваниях для доставки в организм здоровых генов можно ввести их в собственные стволовые клетки больного, а они уже приживутся в нужном месте. Судя по тому, с какой скоростью внедряются в качестве допинга другие достижения медицины и биологии, такие частично модифицированные спортсмены появятся раньше, чем будут официально одобрены клеточные технологии лечения больных.
Он — первый!
Пептидные стимуляторы кроветворения — технологии вчерашнего дня. Зачем вводить в организм эритропоэтин, если можно синтезировать его в собственных ГМ- клетках? Эксперименты на обезьянах в 1997 году дали слишком хороший результат: из-за резкого увеличения числа эритроцитов кровь у бабуинов стала настолько густой, что без постоянных капельниц с плазмой их сердца не справлялись с работой. А в 2003-м было заведено первое в мире уголовное дело о применении в спорте репоксигена — препарата на основе популярного в генной инженерии аденовирусного вектора, несущего ген эритропоэтина.
Генетический допинг немецкий тренер-экспериментатор Томас Спрингштейн опробовал на юниорах до 18 лет (его подопечных и раньше не раз ловили на применении допингов). Избыток эритропоэтина может привести к сгущению крови и образованию тромбов, но фирма-производитель разводит руками: они думали о больных анемией, а не о рекордах и вообще сомневаются, что их препарат будет эффективен в качестве допинга. Но репоксиген только первая ласточка (или первый блин). Другие методы генотерапии наверняка попадут в спорт в ближайшие годы.
Белок! Еще белок!
Мышата, в мышцы которых ученые из Пенсильванского и Гарвардского университетов под руководством профессора Ли Суини ввели дополнительную копию гена инсулиноподобного фактора роста I (ИФР-1), наращивали мышечную массу на 15−30% быстрее обычных — и это при малоподвижном образе жизни. У взрослых мышей обколотые геном ИФР-1 мускулы не росли, зато мышцы оставались по всем показателям «молодыми». Трансгенные мыши, выросшие из яйцеклеток, в ядро которых ввели тот же ген, синтезировали его белок во всех мышечных клетках. Мышцы у таких мышей были на 20−50% больше нормы и тоже не слабели к старости. Клинические испытания этой методики для лечения миотонической дистрофии начнутся лет через десять. Применение в спорте — возможно, раньше.
Белок миостатин тормозит рост мышц начиная с эмбриональной стадии. У спортсменов он препятствует чрезмерному росту и делению мышечных клеток и запускает процесс частичной атрофии мышц после прекращения усиленных нагрузок. У трансгенных мышей, из генома которых ген миостатина удален, растет число мышечных волокон мышечная масса. Такие мышки показывают в три раза лучшие «спортивные» достижения, чем обычные.
Чтобы удалить или испортить ген миостатина, нужно начинать работу на стадии яйцеклетки. Да и представьте, что вырастет, если мышцы будут расти без тормозов. Но начала производства ингибиторов миостатина с нетерпением ждут животноводы: у взрослого животного можно частично заблокировать этот тормоз, мешающий привесам-удоям.
Самый очевидный способ — введение в организм антител к соответствующему белку. Клинические испытания одного из таких препаратов на основе антител к миостатину для лечения мышечной дистрофии Дюшенна (наследственной болезни, поражающей примерно одного мальчика из 5000, мышцы у больных атрофируются, и дольше 20 лет они не живут) тоже запланированы — может быть, сейчас они уже начались. Может быть, их уже применяют в большом спорте. Правда, антитела могут вызвать аллергические реакции, а сами антитела или последствия их применения легко обнаружить.
На животных испытан и метод введения в клетки намеренно подпорченного гена миостатина. Его белок блокирует соответствующие рецепторы клеточных мембран и делает их недоступными для нормальных молекул. У здоровых мышей это вызывает гипертрофию мышц и их ускоренное и качественное, без рубцов, заживление после травм — чем спортсмены хуже?
Самый новый и очень перспективный метод блокировки синтеза белков — с помощью si-РНК («si» — short interfering, короткие интерферирующие; о Нобелевской премии, полученной за их открытие, читайте в «ПМ» №12’2006). Препараты на их основе (например, в липосомальной форме, позволяющей доставить нежный продукт по назначению) разрабатывают для всех известных науке болезней, связанных с избыточным производством белков. В качестве допинга такие препараты будут незаменимы: эффект от них временный, обратимый и не поддающийся обнаружению.
Мышечные волокна делятся на несколько типов. Медленные, но выносливые волокна типа I требуют хорошего снабжения кислородом и глюкозой и содержат много клеточных энергостанций — митохондрий. Быстрые волокна типа II быстро устают, зато в пиковом режиме способны работать в анаэробных условиях, получая «взрывную» энергию из гликогена (многие спринтеры делают глубокий вдох перед стартом и выдыхают секунд через десять, пробежав стометровку). В любой мышце есть волокна обоих типов: в мышцах туловища, выполняющих в основном статические нагрузки, больше «медленных» волокон, в конечностях — «быстрых», приспособленных к динамическим нагрузкам. Склонность к ожирению и диабету второго типа связана с уменьшением в мышцах волокон типа I, и мышь-марафонца ученые из двух калифорнийских и одного сеульского университетов под руководством Рональда Эванса создали в поисках способа борьбы с ожирением.
Что волокна разных типов под влиянием тренировок превращаются друг в друга, известно давно. А вот биохимические механизмы этого явления открыты совсем недавно. В частности, большую роль в таком превращении играет белок PPARd — один из рецепторов клеточной мембраны, стимулирующий деление митохондрий. Вариант «дельта» выбрали потому, что другие формы того же белка намного менее эффективны: a — в 10, а g — в 50 раз.
Чтобы проверить, как PPARd повлияет на обмен веществ, ученые ввели в мышиные эмбрионы его немного модифицированный ген, соединенный с промотором (участком гена, дающим команду к его считыванию) человеческого актина — белка, который вместе с миозином обеспечивает сокращение мышц. Без этого ген мог бы заработать не в мышечной, а в любой другой ткани, а изготовление мышей с повышенным интеллектом или волчьим аппетитом в планы исследователей на этот раз не входило. Синтезированный в мышцах белок, добравшись до жировой ткани, препятствовал ее росту и ускорял сжигание жира: просидев три месяца на «диете по Аткинсу» (35% жира против обычных 4%), трансгенные мыши растолстели в три раза меньше, чем обычные. А мышцы у них так изменились, что это было видно невооруженным глазом (к сожалению, только на срезе). Из-за увеличения концентрации миоглобина — белка, сходного по строению с гемоглобином и снабжающего мышечные клетки кислородом, — трансгенные мышцы были заметно краснее, чем такие же мышцы обычных мышей. Волокон I типа в них было намного больше обычного. Концентрация ферментов, необходимых для окисления глюкозы и синтеза АТФ, тоже выросла. В результате без тренировок, на одной генетике, стройные и мускулистые трансгенные мыши могли бежать на 2/3 (на целый час) дольше и почти в два раза (на километр) дальше, чем обычные. И это — результат работы всего одного из сотен генов, которые изучают в надежде разработать методы лечения наследственных заболеваний. и которые можно использовать для создания генетически модифицированных спортсменов.
Генный допинг

Историческое развитие интереса к генному допингу у спортсменов и опасения по поводу риска генного допинга и способов его обнаружения развивались параллельно с развитием области генной терапии, особенно с публикацией в 1998 году работы о сверхэкспрессии инсулиноподобного фактора роста-1 у трансгенной мыши, которая была намного сильнее обычной мыши даже в пожилом возрасте, а также после доклинических исследований, опубликованных в 2002 году по способу доставки эритропоэтина (ЭПО) с помощью генной терапии, и публикации в 2004 году информации о создании «марафонской мыши», обладающей гораздо большей выносливостью, чем обычная мышь. Марафонская мышь была создана путем доставки ей гена, экспрессирующего PPAR-гамма. С учеными, создавшими эти публикации, напрямую связывались спортсмены и тренеры, стремящиеся заполучить доступ к таким технологиям. Общественность узнала об этих исследованиях в 2006 году, во время суда над немецким тренером. Сами ученые, а также органы, в том числе Всемирное антидопинговое агентство (ВАДА), Международный олимпийский комитет и Американская ассоциация развития науки, начали обсуждать риск допинга генов в 2001 году, а к 2003 году ВАДА добавила генный допинг к списку запрещенных допинговых практик, и вскоре после этого началось финансирование исследований по методам выявления генного допинга. Генетическое улучшение включает в себя манипулирование генами или передачу генов с целью физического улучшения работоспособности у спортсменов. Генетическое улучшение включает в себя допинг генов и может стать предметом злоупотребления у спортсменов, способствуя политической и этической полемике.
История
Препараты
Альфа-актинин-3
Альфа-актинин-3 обнаружен только в скелетных мышцах у людей, и был идентифицирован в нескольких генетических исследованиях как имеющий различный полиморфизм у спортсменов мирового класса по сравнению с нормальными людьми. Одна форма, которая заставляет ген вырабатывать больше белка, обнаруживается у спринтеров и связана с увеличением силы; другая форма, которая заставляет ген производить меньше белка, обнаружена у выносливых атлетов. 10) Генные легирующие средства могут быть разработаны либо с полиморфизмом, либо для выносливых атлетов, с некоторыми ДНК-конструкциями, которые вмешиваются в экспрессию, как небольшая вмешивающаяся РНК.
Миостатин
Миостатин – это белок, ответственный за ингибирование дифференцировки и роста мышц. Удаление гена миостатина или иное ограничение его экспрессии приводит к увеличению размера и силы мышц. Это было продемонстрировано на нокаутных мышах, у которых отсутствует ген миостатина. Этих мышей прозвали «мышами Шварценеггера». 11) Люди, рожденные с дефектными генами, также могут служить «нокаут-моделями». Немецкий мальчик с мутацией в обеих копиях гена миостатина родился с хорошо развитыми мышцами. Опережающий рост мышц продолжался после рождения, и мальчик мог поднимать вес 3 кг в возрасте 4 лет. В работе, опубликованной в 2009 году, ученые вводили фоллистатин с помощью генной терапии в квадрицепс приматов, отличных от человека, что приводило к локальному росту мышц, подобно мышам.
Эритропоэтин (ЭПО)
Инсулиноподобный фактор роста 1
Инсулиноподобный фактор роста 1 представляет собой белок, участвующий в опосредовании гормона роста. Введение IGF-1 мышам привело к увеличению мышечного роста и более быстрой регенерации мышц и нервов. 13) Устойчивое производство IGF-1 могло бы вызывать болезни сердца и рак.
Другие
Модуляция уровней белков, которые влияют на психологию, также являются потенциальными целями для легирования генов; например, восприятие боли зависит от эндорфинов и энкефалинов, реакция на стресс зависит от BDNF, а увеличение синтеза монаминов может улучшить настроение спортсменов. Препроэнкефалин вводили с помощью генной терапии с использованием вируса простого герпеса с дефицитом репликации, который воздействует на нервы, мышам. Результаты были столь хороши, что была оправдана первая фаза клинических испытаний у людей с терминальным раком с неконтролируемой болью. Принятие такого подхода для спортсменов было бы проблематичным, поскольку ослабление боли, вероятно, будет постоянным. VEGF был протестирован в клинических испытаниях для увеличения кровотока и считался потенциальным агентом для легирования генов; однако, длительное наблюдение за испытуемыми дало плохие результаты. То же самое относится и к фактору роста фибробластов. Глюкагоноподобный пептид-1 увеличивает количество глюкозы в печени и вводится с помощью генной терапии в печень мышей с моделями диабета, и было показано, что он увеличивает глюконеогенез у спортсменов, это связано с увеличением энергии и уменьшением накопления молочной кислоты.
Обнаружение
Всемирное антидопинговое агентство (WADA) является основной регулирующей организацией, занимающейся проблемой выявления легирования генов. Организация исследует как прямые, так и косвенные методы тестирования. Непосредственное обнаружение использования генной терапии обычно требует обнаружения рекомбинантных белков или векторов вставки генов, в то время как большинство косвенных методов включает исследование спортсменов в попытке обнаружить телесные изменения или структурные различия между эндогенными и рекомбинантными белками. Косвенные методы по своей природе более субъективны, так как становится очень трудно определить, какие аномалии являются доказательством легирования генов, а какие просто естественными, хотя и необычными, биологическими свойствами. Например, у Ээро Мянтиранта, олимпийского лыжника, была мутация, которая заставляла его тело вырабатывать аномально большое количество эритроцитов. Было бы очень трудно определить, обусловлены ли уровни эритроцитов Мянтиранты врожденным генетическим преимуществом или искусственным.
Исследования
Обзор 2016 года показал, что в литературе было выявлено около 120 полиморфизмов ДНК, связанных с некоторыми аспектами спортивных результатов, 77 – с выносливостью и 43 – с силой. 11 были воспроизведены в трех или более исследованиях, и шесть были идентифицированы в исследованиях ассоциации всего генома, но 29 не были воспроизведены ни в, по крайней мере, одном исследовании. 11 реплицированными маркерами были:
Генный допинг
Спорт в последние десятилетия все меньше становится спортом и постепенно превращается в состязания фармакологов. Многие эксперты убеждены, что допингом злоупотребляют десятки и сотни спортсменов, целые команды, а попадаются единицы. Международное антидопинговое агентство непрерывно разрабатывает новые тесты для выявления запрещенных препаратов, в то же время фармакологи непрерывно разрабатывают новые стимуляторы, причем неизменно оказываясь на шаг впереди.
В попытках поставить преграду допинговой стихии специалисты Немецкой высшей спортивной школы в Кельне пошли по пути создания методов обнаружения таких препаратов и биологически активных веществ, которые, как они предполагают, скорее всего будут использованы в этом качестве уже в ближайшей перспективе. Об этом пишет Deutsche Welle. Сами ученые именуют свою работу превентивными антидопинговыми исследованиями.
Сейчас их главная цель — борьба с маячащим на горизонте генным допингом. Профессор Марио Тэвис поясняет: «Генный допинг в узком смысле этого слова, то есть перенос постороннего генетического материала или чужеродных клеток в организм спортсмена, можно рассматривать как злоупотребление генной терапией, методами, предназначенными для лечения тяжелых наследственных заболеваний. Это очень сложные методы, и мы полагаем, что дело еще не дошло до их применения — по крайней мере в широких масштабах».
Имели ли место не выявленные пока случаи генного допинга в Ванкувере, еще неясно, но в научных лабораториях эффективность этих методов уже доказана. Марк Франкел, эксперт Американской ассоциации содействия развитию науки в Вашингтоне, говорит, что генетически модифицированные мыши легко наращивают в четыре или в пять раз больше мышечной массы, чем их нормальные собратья. Калифорнийским исследователям удалось так воздействовать на один из генов, что подопытные мыши стали марафонцами, бежали непрерывно, пока их насильственно не остановили.
Искусственно регулируя активность генов, кодирующих некоторые белки, можно придать организму исключительную физическую силу и выносливость практически без тренировок. Понятно, что спортсмены и тренеры, нацеленные на победу любой ценой, проявляют к генной инженерии повышенный интерес. В частности, скандально известный немецкий тренер по легкой атлетике Томас Шпрингштайн, попавший под суд за то, что давал допинг своим несовершеннолетним подопечным, еще в 2006 году, как выяснилось в ходе процесса, экспериментировал с репоксигеном — препаратом на основе известного в генной инженерии аденовирусного вектора, несущего ген гормона эритропоэтина.
Это препарат разрабатывался для генной терапии анемии, то есть малокровия, и в экспериментах на обезьянах существенно увеличивал количество эритроцитов в крови. Однако введение в организм чужеродных генов чревато тяжелыми побочными реакциями, заявляет Марк Франкел: «Такие методы грозят плачевными последствиями для здоровья спортсмена. Генный допинг гораздо опаснее любых анаболиков. Во Франции клинические испытания генной терапии хотя и позволили излечить саму болезнь, однако у ряда пациентов развился рак крови».
Пока более вероятным направлением развития допинга представляется не внедрение в организм спортсмена чужеродных генов, а модификация его собственных. Ведь классические допинговые средства вроде анаболических стероидов тоже влияют на активность генов, но число этих генов измеряется тысячами. Новые научные исследования позволили синтезировать вещества, действующие гораздо более избирательно и прицельно. А обнаружить их крайне сложно. В частности, особое внимание экспертов привлекло к себе вещество, получившее техническое обозначение GW1516 — субстанция, разработанная для лечения ожирения, которая является модулятором экспрессии (то есть активности) гена PPAR-д. Этот ген играет ключевую роль в расщеплении жиров и в трансформации мышечных волокон второго типа («быстрых», но маловыносливых) в мышечные волокна первого типа («медленные», но очень выносливые). Обычно такая трансформация достигается регулярными изнурительными тренировками, но опыты на мышах-марафонцах показали, что тренировки с успехом может заменить вещество GW1516. Сегодня это вещество входит в перечень запрещенных препаратов, составляемый Международным антидопинговым агентством.
Методику, позволяющую обнаружить его в крови спортсменов, разработали кельнские ученые. Сначала пробу крови помещают в центрифугу, что позволяет отделить плазму от клеточных компонентов. Затем мешающие анализу примеси удаляют методом хроматографии. И, наконец, масс-спектрометрия позволяет обнаружить в крови сам допинг, если он там есть. Метод вполне надежен, а вся необходимая для анализа аппаратура имеется в любой допинг-лаборатории. Теперь ученые хотят распространить методику и на мочу, поскольку чаще всего для допинг-анализа привозят именно мочу. Они считают, что вообще самый перспективный путь — искать не сам допинг, а вызываемые им специфические изменения метаболизма, следы его воздействия.
Крупнейший российский специалист по спортивной медицине Николай Дурманов предупреждает о разрушительных последствиях «генного цунами» для организма спортсмена — перестройка сердечной мышцы под воздействием таких препаратов может привести к самым фатальным последствиям. Перед соблазном олимпийской короны, однако, трудно устоять.
Генный допинг
Генный допинг [ править | править код ]
Английская «TIMES» 1 августа 2008 г. со своих страниц заявила, что «исследователи обнаружили и протестировали на мышах два вещества, способных существенно повысить силу и выносливость мышц. Одно из этих соединений продемонстрировало способность улучшать физические возможности животных даже в отсутствие тренировки». Руководитель исследования, сотрудник Института Говарда Хьюга Р. Эванс, как сообщала газета, некоторое время назад сумел вдвое повысить выносливость мышей, встроив в геном животных модифицированную версию гена ядерного клеточного рецептора PPAR-δ (ППАР-дельта), регулирующего процессы метаболизма в клетках. Это было расценено как начало эры генного допинга. Затем Р. Эванс и его коллеги из Института биологических исследований Солка попытались достичь аналогичного эффекта при помощи экспериментальных лекарств. Путем длительного подбора ученые идентифицировали химическое соединение под названием GW 1516. Результат эксперимента оправдал ожидания лишь отчасти. Получавшие его мыши не демонстрировали никаких экстраординарных способностей без тренировки, однако после начала физических упражнений их сила и выносливость увеличивались значительно быстрее, чем у обычных мышей после таких же нагрузок. Однако, к сожалению, газета «TIMES» не упомянула, что GW 1516 был обнаружен в процессе изучения механизмов влияния антидиабетических препаратов нового поколения на синтез гликогена и утилизацию глюкозы (более ранее название GW1516 — GSK 516 — вполне может указывать на связь изучаемого вещества с действием фермента киназы гликогенсинтазы — ГСК, играющей важную роль в метаболизме углеводов).
За две недели до старта летнего чемпионата мира-2009 по легкой атлетике Антидопинговая комиссия Всероссийской федерации легкой атлетики (ВФЛА) со страниц своего официального сайта выступила с заявлением о том, что генный допинг, об опасности которого говорили последнее время в научных и спортивных кругах, выходит на широкий нелегальный рынок. В заявлении говорилось, что два препарата под названием GW 1516 и AICAR активно рекламируются в Интернете. Об этих препаратах как о потенциальной угрозе уже несколько лет предупреждают специалисты в области спортивной медицины и функционеры международных антидопинговых служб. Известный российский специалист по борьбе с допингом, глава медицинской комиссии Континентальной хоккейной лиги, а в прошлом глава антидопинговой службы Росспорта, Николай Дурманов присоединился к этому заявлению, подчеркнув в своих интервью для широкой общественности огромную опасность использования таких препаратов. В интервью Интернет-изданию «infox.ru» он рассказал, что такое GW 1516 и AICAR, и почему ВФЛА назвала этот допинг смертельным: GW 1516 и AICAR перестраивают работу генов в организме человека. Мыши, обработанные этими препаратами, бегают на 60—70 % дольше и дальше, чем их обычные собратья. Эти вещества влияют на гены мышечных клеток, и опыты на животных показали, что они якобы значительно увеличивают выносливость организма, многократно превосходя по своему действию все имеющиеся «традиционные» допинги. Ученые крайне озабочены тем фактом, что разрекламированные «магические» свойства этих препаратов приведут к их быстрому распространению в спортивном мире. При этом не было проведено достаточных исследований по влиянию препаратов на организм человека. В частности, большую настороженность вызывает потенциальное воздействие этих веществ на сердечно-сосудистую систему человека, что может привести к таким катастрофичным последствиям, как инфаркт миокарда. Специалисты-медики из Антидопинговой комиссии ВФЛА считают своим долгом предупредить спортсменов, тренеров, врачей о серьезной опасности, связанной с приемом этих веществ. Как отметил Н. Д. Дурманов, «пусть никого не обманывает легкомысленная реклама и искусственный ажиотаж вокруг этих генных допингов. Они смертельно опасны. К сожалению, в прессе и Интернете распространены заявления, что уже налажено подпольное производство запрещенного товара, так как сама структура этих веществ не очень сложная, и имеются указания, где их можно приобрести».
Когда сведения о AICAR и GW 1516 появились в научной литературе, средства массовой информации назвали их «таблетками зарядки». В самом обобщенном виде механизм их действия связан с воздействием на процессы выработки энергии. В частности, новые субстанции повышают образование и последующее окисление жиров (липидов), служащих одним из важных источников энергии при физической нагрузке, и увеличивают скорость кровотока, что обеспечивает стабильный транспорт липидов к местам их метаболизма. Кроме того, и AICAR, и GW 1516 связаны с процессами метаболизма углеводов — главной энергетической субстанцией при длительной физической нагрузке.
Еще в 2004 г. в российском Интернет-журнале «Коммерческая биотехнология» появилась научно-популярная статья А. Чубенко о генном допинге, в которой указывалось, что уже тогда под руководством Р. Эванса проводились исследования по модификации мышечных волокон. Однако целью поиска являлось совсем не повышение спортивных результатов. Посылка исследователей была совсем иной. Известно, что мышечные волокна делятся преимущественно на два типа: медленносокращающиеся, но выносливые, волокна типа I требуют хорошего снабжения кислородом и глюкозой и содержат много митохондрий; быстросокращающиеся волокна типа II быстро «устают», зато длительно способны работать в анаэробных условиях, получая энергию за счет распада гликогена. В любой мышце есть волокна обоих типов, однако в мышцах туловища, выполняющих в основном статические нагрузки, больше волокон типа I, в мышцах конечностей — типа II, приспособленных к динамическим нагрузкам. Склонность к ожирению и сахарному диабету II типа связана с уменьшением в мышцах именно волокон типа I, и ученые из двух калифорнийских и одного сеульского университетов под руководством Р. Эванса в поисках способа борьбы с ожирением создали «мышь-марафонца».
Биохимические механизмы превращения мышечных волокон из одного типа в другой под влиянием тренировочных занятий открыты совсем недавно. В частности, большую роль в таком превращении играет сигнальный белок PGC-1-α, один из кофакторов транскрипции коактиватора бета-рецептора (или, как его чаще называют, γ-рецептора), который активирует пролиферацию пероксисом (transcriptional cofactor Peroxisome proliferator-activated receptor-gamma coactivator) — PGC. PGC участвует в процессе пролиферации (роста и деления) митохондрий, активизируя белок PPARδ — рецептор активатора пролиферации пероксисом. Вариант δ выбрали потому, что другие изоформы того же белка в процессе превращения мышечных волокон намного менее эффективны: α — в 10, a γ — в 50 раз. Чтобы проверить, как PPAR-δ повлияет на обмен веществ, ученые ввели в мышиные эмбрионы его модифицированный ген, соединенный с промотором (участком гена, дающим команду к его считыванию) человеческого актина — белка, который вместе с миозином обеспечивает сокращение мышц. Без этого ген мог бы заработать не в мышечной, а в любой другой ткани. Синтезированный в мышцах белок, с кровотоком попавший в жировую ткань, эффективно препятствовал ее росту и ускорял сжигание жира: через три месяца пребывания на «диете по Аткинсу» (35 % жира против обычных 4 %), трансгенные мыши растолстели втрое меньше, чем обычные. При этом структура мышечной ткани у них настолько изменились, что при биопсии это было видно невооруженным глазом. Из-за увеличения концентрации миоглобина трансгенные мышцы были заметно краснее, чем такие же мышцы обычных мышей. Число волокон типа I в них было намного больше обычного (например, в такой типично смешанной по составу волокон мышце, как икроножная, — в 2 раза). Концентрация ферментов, необходимых для окисления глюкозы и синтеза АТФ, тоже существенно возросла.
В заключение А. Чубенко отмечает, что на одной генетике, без тренировки, стройные и мускулистые трансгенные мыши при занятии на тредмиле могли бежать на 2/3 (на 1 ч) дольше и почти в 2 раза (на 1 км) дальше, чем обычные. И это результат работы всего одного из сотен генов, которые изучают в надежде разработать методы лечения наследственных заболеваний и которые можно использовать для создания генетически модифицированных спортсменов. О «мышах-марафонцах» писали много, тем более что в электронной версии журнала «PLOS Biology» статья о них появилась во время Игр XXVIII Олимпиады. Но в популярных изданиях от широкой спортивной общественности скрыли самое главное, а именно, что такое же снижение массы тела наблюдалось у обычных мышей, когда им через желудочный зонд вводили вещество под кодовым названием GW501516. О его составе в статье группы Р. Эванса не сказано — по понятным причинам: обычно такими буквенно-цифровыми индексами обозначают потенциальные лекарственные препараты, пока они не получат одобрения медицинских властей и торгового названия. Известно было только, что это агонист (позитивный модулятор) PPARδ. С момента появления в Интернет-изданиях этих статей интерес спортивных функционеров к использованию GW 1516 и AICAR многократно возрос.
Все известные до того момента виды генного допинга, начиная с использования рекомбинантного гена эритропоэтина, ускоряющего синтез эритроцитов и гемоглобина, и заканчивая модификацией ростового фактора эндотелия сосудов (VEGF) для ускорения роста новых капилляров и артерий и, соответственно, скорости кровотока, влияли на спортивный результат опосредованно. Новые разработки ученых привели к появлению средств, непосредственно влияющих на ключевые звенья успеха в спорте— механизмы энергообеспечения и качество и длительность эффективного мышечного сокращения. Не случайно вскоре после появления упомянутых статей (в российском Интернет-журнале «Коммерческая биотехнология» и в «PLOS Biology») тогдашний директор WAD А Ричард Паунд в интервью газете «Тайме» в феврале 2004 г. заявил: «Не думаю, что мы столкнемся с генным допингом в Афинах, и очень сомневаюсь насчет Олимпиады в Пекине в 2008 г. Но в 2012 это будет вполне возможно». Он несколько ошибся в прогнозе — это произошло гораздо раньше.
Оба упомянутых выше средства (никак нельзя назвать их препаратами, поскольку они еще не имеют торгового зарегистрированного названия), последствия действия которых были описаны в онлайн-режиме в научном журнале «Cell» 31 июля 2008 г., по состоянию на 1 января 2009 г. уже были внесены в пункт М 3 «Генный допинг» Списка запрещенных веществ и методов. И хотя ранее подразумевалось, что при использовании генного допинга используются инъекционные формы, два выше названных вещества могут употребляться в виде таблеток. Что представляют собою GW 1516 и A1CAR?
PPARs активируются, связываясь с лигандами, и затем присоединяются к специфическим участкам ДНК. При связывании со специфическим лигандом PPAR изменяет свою конформацию (структуру), что позволяет включать один или несколько белков-активаторов. Каждый из PPARs управляет активностью определенного ансамбля генов, контролирующих многие процессы внутриклеточного обмена, рост и апоптоз (запрограммированная клеточная смерть) некоторых клеток, и ряд патологических процессов, в частности, воспаления и канцерогенеза. PPARs имеют важное значение в регуляции дифференцировки клеток, транкрипции (считывании информации, заложенной в генах), метаболизме углеводов, липидов, белков у высших организмов. Все PPARs в молекулярном плане тесно связаны с определенными ДНК-сгруктурами (нуклеотидными последовательностями) различных генов, что и дает возможность PPARs влиять на их транскрипцию и экспрессию (Feige et al., 2006). Функции PPARs могут варьировать в зависимости от способа прикрепления их лиганда к промоторной части гена, а также от количества коактиваторов и корепрессоров (веществ, способствующих угнетению функции) белков, наличие которых может стимулировать активность или препятствовать функционированию перокисомного рецептора (Yu, Reddy, 2007).
PPARα и PPARγ являются молекулярной мишенью многих разрешенных препаратов, в частности, как указывалось, на основе фибратов и тиазолидиндионов. Для PPARα такими агентами являются, во первых, фибраты (гемфиброзил, уфибрат, безофибрат и т. д.), широко распространенные в лечении сердечно-сосудистых заболеваний, сахарного диабета II типа, ожирения, а, во-вторых, нестероидные противоспалительные средства (НПВП), особенно часто используемые для снятия болевого синдрома, связанного с повреждением мышечных и костно-суставных структур. Для PPARγ, повышающих чувствительность к инсулину, синтетическими активаторами также являются прежде всего тиазолидиндионы, в меньшей степени — фибраты (Buzzetti et al., 2004; Meirhaeghe et al., 2004).
В организме одними из важнейших лигандов для PPARs являются свободные ненасыщенные жирные кислоты с длинной цепью: линолевая, линоленовая и арахидоновая (в основном для с-формы) и эйкозаноиды (предшественники и метаболиты простагландинов и других сходных по структуре биологически активных веществ). Например, PPARγ активируется простагландином PGJ2, a PPARα — медиатором воспаления лейкотриеном В4 (Haraguchi et al., 2003).
PPARs играют важную роль в метаболизме свободных жирных кислот, триацилглицеролов и холестерола в организме. Активация α-формы PPAR, посредством изменения активности транскрипции генов, участвующих в метаболизме липопротеидов, способствует снижению содержания атерогенных ЛПНП в сыворотке крови, повышает активность транспорта холестерола из периферических тканей в печень. В эксперименте показано, что при дефиците PPARα в условиях голодания концентрация глюкозы в крови через 24 ч снижается на 50 %, что свидетельствует о важной роли PPARα в гомеостазе глюкозы. PPARα обладают также противовоспалительными эффектами. Эти свойства были документально подтверждены главным образом в экспериментах in vitro, а также в опытах на животных.
Что касается действия веществ, усиливающих действие PPARs, то недавно было продемонстрировано, что у пациентов с сахарным диабетом II типа агонисты PPARα фибратной структуры уменьшают риск возникновения инфаркта миокарда и снижают частоту необходимости проведения коронарной реваскуляризации, что свидетельствует о благоприятных эффектах этих препаратов у данной категории пациентов. В модельных исследованиях с изолированными человеческими клетками на фоне стимуляции избыточной экспрессии PPARα до настоящего времени не выяснено, приводит ли активация PPARα к нежелательным эффектам со стороны сердца у людей, как это отмечалось в эксперименте на животных. Отсутствуют также какие-либо убедительные научные свидетельства о том, что терапия агонистами PPARα способна увеличить риск развития хронической сердечной недостаточности у человека (Kim et al., 2006).
Известно, что генный допинг на основе тиазолидиндионов, а именно пиоглитазон и троглитазон (последнее поколение — розиглитазон, торговое название Авандия), являются одними из самых современных для лечения сахарного диабета II типа. Они повышают чувствительность тканей к инсулину, позволяя контролировать уровень глюкозы. Активация PPARγ с помощью этих препаратов регулирует транскрипцию инсулин-чувствительных генов, участвующих в контроле синтеза, транспорта и утилизации глюкозы. Кроме этого, лиганды PPARγ на основе тиазолидиндионов влияют также на регуляцию обмена жирных кислот. Однако препараты этого класса имеют некоторые побочные эффекты, например, гепатотоксичность, особенно при превышении терапевтической дозы.
GW 1516, вокруг которого за столь короткий период сломано столько копий, по структуре представляет собой 2-[2-метил1-4-([4-метил-2-(4-(трифлуорометил)фенил)-1,3-тиазол-5-ил] метилсульфанил-феноксиацетат с молекулярной массой 453,498 г моль»1 (рис. 3.18).
На сегодняшний день метаболизм, биодоступность, период полужизни, пути экскреции, тератогенные эффекты и терапевтические дозировки GW 1516 не описаны. Разработана эта субстанция совместно сотрудниками институтов Хьюга и Солка в Сан-Диего по заказу фармацевтической корпорации «GlaxoSmith Kline» под руководством Р. Эванса. Уже одно упоминание о фармацевтической компании, занимающей одно из лидирующих мест в мире по производству многих жизненно необходимых препаратов, указывает, что никто специально не занимался разработкой допинговых субстанций, и задачи исследования были чисто терапевтическими. Первые сообщения именно об этом веществе появились в биохимической научной литературе в 2003 г. (Sznaidman et al., 2003). Оно, как свидетельствуют результаты исследований, опубликованные только в феврале 2008 г., продемонстрировало у страдающих ожирением мужчин с предиабетом возможность обратной трансформации возникших метаболических аномалий путем, вероятнее всего, стимулирования окисления свободных жирных кислот (Risurus et al., 2008). GW 1516 активирует аденозинмонофосфат-активированную протеинкиназу (фермент, участвующий в процессах энергообеспечения) и таким образом стимулирует поглощение глюкозы тканями скелетных мышц, а также утилизацию свободных жирных кислот (Kremer et al., 2007). В настоящее время проводится II фаза клинических испытаний относительно возможности использования GW 1516 в качестве средства для профилактики атеросклероза и лечения дислипидемий.
Когда в 2008 г. результаты экспериментов показали возможность повышения работоспособности на 68 % путем использовании GW 1516 при беге мышей на тредмиле, то еще до Игр XXIX Олимпиады были высказаны опасения относительно использования данного вещества в качестве допинга (Narkar et al., 2008). Тогда же Р. Эванс, руководивший экспериментальными исследованиями по изучению влияния GW 1516 на различные физиологические процессы в организме, в том числе, и на работоспособность, разработал тесты для обнаружения этой субстанции в моче и предоставил соответствующую информацию в распоряжение МОК и WADA medical-weight-loss-guide.com/AICAR.html..
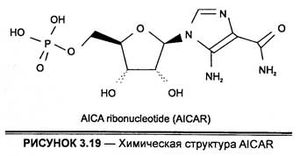
Другим, запрещенным в 2009 г., видом генного допинга, является AICA ribonucleotide или AICAR (aminoimidazole carboxamide ribonucleotide) — интермедиат (промежуточный продукт) генерирования инозинмонофосфата, выступающего в качестве агониста АМР-активированной протеинкиназы (АМРК) (Corton al., 1995). Субстанция AICAR стимулирует поглощение в скелетных мышцах глюкозы и увеличивает экспрессию р38-митоген-активированной протеинкиназы типов а и β (Lemieux et al., 2003), а также предотвращает процесс апоптоза путем торможения образования свободных радикалов, прежде всего химически активного атомарного кислорода, внутри клетки (Kim et al., 2008). Следует отметить, что достаточно давно биохимиками-теоретиками на молекулярном уровне установлена связь между действием АМРК и функционированием Na+-K+-АТФ-азы (натрий-калиевый насос), гидролизующей с образованием энергии 25 % всех запасов АТФ в клетке. Потому активность АМРК является сверхчувствительным сенсором энергозависимых процессов и отображает процессы выработки энергии и, в частности, нижней границы образования АТФ, инактивируется увеличением нижней границы соотношения АМФ/АТФ (Lingrel, Kuntzweiler, 1994).
В 2008 г. исследователи Института Солка под руководством Дж. Кима обнаружили что AICAR, в зависимости от интенсивности нагрузки, при использовании его в течение четырех недель у экспериментальных мышей значительно повышает их работоспособность на тредмиле в упражнениях на выносливость путем, по-видимому, преобразования быстросокращающихся мышечных волокон в более энергоэффективные, липидогенерирующие, медленносокращающиеся мышечные волокна. Было показано, что этот процесс опосредован торможением пальмитат-индуцированной клеточной смерти (апоптоза) эндотелиальных клеток путем угнетения процессов перекисного окисления липидов в них (Kim et al., 2008).
В эксперименте на крысиных и человеческих клетках установлено, что АМРК регулирует стимулированную при гиперкапнии накоплением С02 альвеолярную эпителиальную дисфункцию и соответственно улучшает легочную вентиляцию (Vadusz et al., 2008). Как показывают недавние исследования, в частности, проведенные на изолированных клетках миокарда и мышечных клетках, АМРК также стимулирует поглощение глюкозы этими структурами (Sugalen et al., 2007). Отсюда следует, что эффективные агонисты АМР-активированной протеинкиназы могут быть точкой приложения для стимуляции механизмов энергообеспечения. Как активатор АМР-активированной протеинкиназы, AICAR в эксперименте на животных увеличивает содержание свободных жирных кислот в обоих (быстрых и медленных) типах мышечных волокон через изменение уровней адипонектина и лептина (белков, участвующих в липидном обмене) и повышение содержания глюкозы в белых мышечных волокнах (рис. 3.20).