Что такое геномная селекция
Геномная селекция в разведении КРС
Оценка племенных качеств животных по генотипу (+ аудио)
В рамках выставки «Агроферма»-2013 прошел научный семинар «Геномная селекция в разведении крупного рогатого скота. Мировой опыт и использование в России». Сегодня мы расскажем о нем чуть подробнее.
Геном коровы расшифрован
В Голландии уже давно разработана система раннего прогнозирования генетических возможностей быков. И хоть в России о ней стало известно пять лет назад, сегодня еще мало кто действительно владеет этим вопросом в полной мере.
Быки, которых завозит Россия из Канады, Голландии и других стран Европы уже имеют геномную оценку, но грамотно воспользоваться этой информацией могут в нашей стране лишь единицы.
Ромейн Дассонневиль (Romain Dassonneville) – кандидат с/х наук, специалист по геномной селекции, генетическому моделированию, оценке и статистике выступил на семинаре с докладом об основных принципах геномной оценки бычков. Приводим здесь наиболее интересные фрагменты его выступления:
Методы оценки селекционного материала
Если говорить о геномной оценке, стоит сначала упомянуть о других методах, используемых в селекции КРС.
Сначала нам необходимо было решить, как выбрать тех животных, которые нам интересны. Ведь для выбора необходимо сравнить их.
Например, у нас два быка, дочери одного с продуктивностью 7,5 тысяч кг, другого – с продуктивностью 2 тысячи. На первый взгляд кажется, что тут все очевидно – следует выбрать быка, чьи дочери более продуктивны.
Но если мы будем ориентироваться только на производство молока, мы можем ошибиться. Поскольку как ни смотри на быков, не найти таких, все потомство которых дает молоко одинаково.
Когда же мы рассмотрим условия, в которых эти дочери содержались, то можем делать дальнейшие выводы. К примеру, дочери быка «А» живут на ферме с отличными условиями и высококачественным кормом. Здесь продуктивность может зависеть от условий содержания. Если условия разные, сделать выбор в пользу какого-нибудь быка уже не так просто.
Немаловажно также учитывать влияние коровы. Мы используем быков, дочери которых дают 9 тысяч кг, но один был использован на корове, дающей в среднем 8 тысяч, а другой – 11 тысяч.
Так что, если смотреть только на продуктивность дочерей – сделать действительно правильный выбор очень сложно.
Поэтому, для комплексной достоверной оценки нам необходима статистическая модель, объясняющая влияние окружающей среды и всех индивидуальных родственных связей. Сейчас во всем мире для этого используется метод BLUP.
Геномная оценка
Американская компания разработала чип, доступный для генотипирования у животных. Это позволяет определять генотип животного при исследовании его крови В чипе – 54 тыс маркеров, охватывающих все хозяйственно-полезные признаки животных, необходимые для селекционной работы. Метод позволяет прогнозировать необходимые признаки у животных даже при отсутствии информации о их предках.
Традиционная схема селекционного отбора по потомству выглядит следующим образом: Мы выбирали быков по хорошим родителям, когда они рождались, выращивали их до двухлетнего возраста, после чего брали у них спермодозы для получения потомства в хозяйствах. И только после того, как их дочери начинали производить молоко, быку-производителю можно было дать оценку. Продолжительность цикла составляла пять лет. Разумеется, в эффективности этого метода никто не сомневается, но он слишком длительный и очень затратный.
Геномный отбор все значительно упрощает. Уже после рождения у бычков можно взять кровь и сделать полную геномную оценку. И использовать такого быка можно сразу, как только он начнет производить семя. Геномный отбор намного дешевле, не нужно ждать 5 лет, а значит можно сэкономить на содержании быка все это время.
Чтобы делать генетическое улучшение популяции, необходима надежная оценка, высокая степень наследования и небольшой интервал между поколениями. Если сравнить геномный отбор и традиционную селекцию, по уровню качества потомства он практически такой же надежный, но более быстрый – здесь меньше интервал между поколениями. Геномный отбор может ускорить генетический прогресс.
У быков, которые оценивались по потомству, достоверность характеристик 80% и более, если смотреть достоверность индексов молодого бычка, у которого оценка только геномная, здесь достоверность 65-70% в зависимости от характеристик.
При оценке только по селекции и родословной достоверность не более 30%.
Чтобы создать геномную оценку необходимо:
Прежде всего – стандартная популяция животных – это популяция, у которой уже есть хорошая оценка по потомству. Быки, имеющие поколение дочерей, генотип которых также уже изучен. Такая популяция служит для создания таблицы сравнительных характеристик по маркерам. Когда есть и таблица и популяция, можно произвести генотипирование или геномную оценку у кандидатов и искать гены, которые приносит узкая геномная селекция.
Итак, оценка состоит из следующих этапов:
1. Хороший контроль продуктивности коров;
2. Оценка быков по потомству методом BLUP;
3. Информация о геномной оценке стандартной популяции – самый важный этап, позволяющий посмотреть влияние маркеров на хозяйственно-полезные признаки популяции;
4. Геномная оценка кандидатов в популяции;
5. Считывание индексов и отбор лучших быков для селекции.
Необходима информация о родословной, о фенотипе (по дочерям) и информацию по маркерам (из анализа крови), после этого идет отбор и тестирование различных моделей, существующих в мире.
Стандартные популяции мира
Стандартная популяция необходима для создания сравнительной таблицы. Чем она больше, тем информация по геномной оценке достовернее. К примеру, если мы рассматриваем только 4 тысячи животных, достоверность будет 40-50%, если 5 тысяч – достоверность приближается к 70%. Это самая важная задача – создать большую стандартную популяцию.
В Европе мы это сделали совместно с другими странами – у нас есть информация о животных совместной европейской популяции. В нее входят Германия, Франция, Скандинавия, Дания, Швеция, Испания, Польша и многие другие. В популяцию входят 25 тысяч быков с оценкой по потомству и геномной оценкой. А все новые геномные быки, которые есть в Европе, оцениваются и сравниваются с этой популяцией.
Северо-Американская популяция животных объединяет всех быков из США и Канады. Сегодня их стандартная популяция – 18,5 тысяч быков.
Romain Dassonneville – кандидат с/х наук, специалист по геномной селекции, генетическому моделированию, оценке и статистике
А знаете ли вы, что коров можно приучить есть сорняки? Читаем здесь
Что такое геномная селекция
В 1983 году американский ученый Кэри Муллисон изобрел технологию полимеразной цепной реакции. Она позволяла из небольших участков ДНК клонировать заданное число их копий. С помощью этой технологии ученые смогли изучать непосредственно ДНК живых организмов. Это дало толчок развитию маркерной и геномной селекции, которые с недавних пор внедряются в сельское хозяйство.
В России эту технологию изучают в научно-исследовательском центре геномной селекции, созданном на базе Белгородского государственного национально-исследовательского университета в 2017 году.
Руководитель центра Эдуард Снегин рассказал, какое практическое применение нашли маркерная и геномная селекция в сельском хозяйстве, и как построено сотрудничество центра с сельхозпроизводителями.
Эдуард Анатольевич, что такое маркерная технология и геномная селекция? В чем их различие?
— Маркерная селекция подразумевает отбор животных по отдельно взятым генам-маркерам, контролирующим различные значимые признаки: рост, вес, скорость роста, плодовитость и устойчивость к заболеваниям. Но геном — очень сложная скоординированная система, где все гены связаны между собой. Поэтому отбор по отдельно взятым генам-маркерам всегда сопровождался сложностью оценки их взаимодействия. Из-за этого маркерная селекция перестала удовлетворять запросы современных аграриев и науки в целом, что дало толчок развитию геномной селекции.
Она по своей сути похожа на маркерную, но если маркерная технология позволяет вести селекционный отбор только по отдельным генам, то геномная – по их комплексам, включающим сотни, тысячи и даже десятки тысяч генов.
Давно ли эти технологии пришли в Россию и как они развиваются сейчас?
— В мире развитие маркерной и геномной технологии началось в 90-е годы, после изобретения полимеразной цепной реакции Кэри
Муллисоном. Тогда же технология появилась и в России. На первых порах реактивы и оборудование нужно было завозить исключительно из-за рубежа, и в силу финансовых трудностей многие отечественные генетические лаборатории не могли позволить себе заниматься ДНК-технологиями в полной мере, как это происходило в США и странах Европы.
Тем не менее постепенно в России стали открываться собственные предприятия по производству реактивов и других расходных материалов, были налажены поставки относительно недорогих и качественных приборов и комплектующих из других стран и система грантовой поддержки научных лабораторий и институтов. Поэтому технология ПЦР стала вполне доступной даже для малобюджетных лабораторий.
Что касается внедрения в сельское хозяйство непосредственно маркерной и геномной селекции, то здесь в России возникли сложности. Так как аграрный сектор очень консервативный, то новые разработки сначала были восприняты весьма негативно. Большинство сельхозпроизводителей до сих пор используют устаревшие, но как они считают проверенные, методы традиционной селекции, основанной на исключительно внешних показателях животных. Именно здесь мы столкнулись с отголосками той трагедии, которая произошла в отечественной науке в середине ХХ века, когда генетика в СССР была запрещена как лженаука. Особенно это ударило по сельскохозяйственной генетике. В сельском хозяйстве у нас в стране долгое время доминировала старая школа, основанная на так называемой «лысенковщине». И эта проблема, к сожалению, на мой взгляд, до конца не решена.
Еще одним препятствием к интенсивному внедрению геномных технологий в России стало интенсивное освоение нашего сельхозрынка западными компаниями. Многие предприятия закупают скот за рубежом. При этом контракты составляются таким образом, что российский сельхозпроизводитель не имеет право проводить собственные селекционные мероприятия с закупленным поголовьем. Если он и проводит селекционную работу, то только по прямым указаниям зарубежных специалистов, которые крайне не заинтересованы в развитии этих технологий у нас в стране и всячески этому противодействуют.
Впрочем, сейчас эти технологии активно развиваются. Мы, например, сотрудничаем с более чем 50 хозяйствами со всей страны: от Бурятии до Калининграда.
Одинаковыми ли темпами развиваются маркерная и геномная селекция в животноводстве и растениеводстве?
Как эти технологии применяются на практике? Какую пользу от них могут получить аграрии в животноводстве.
— Наша работа заключается в расшифровке генов животных. Ген, как мы знаем, это участок ДНК, определенная последовательность нуклеотидов, в которой закодирована информация о синтезе одной молекулы белка (или РНК), и которая обеспечивает формирование какого-либо признака и передачу его по наследству.
Гены в популяции, если говорить простым языком, имеют несколько форм – аллелей, от которых зависит, какой именно признак передается. Такие гены называются полиморфными, и именно они обеспечивают разнообразие внутри вида. Однако лишь некоторые признаки находятся под контролем отдельных генов (например, окрас). Показатели продуктивности, как правило, являются количественными признаками, за развитие и проявление которых отвечают сразу несколько генов.
Для работы мы используем специальное устройство – секвенатор, с помощью которого автоматически определяется последовательность нуклеотидов в цепи ДНК. То есть, мы можем расшифровать ДНК конкретного животного, определить те самые аллели, которые отвечают за разные признаки.
Затем проводим отбор животных, у которых проявляются положительные признаки, например, высокая продуктивность, и отбраковываем тех, кто не удовлетворяет нас по характеристикам. На основе этих исследований мы рассчитываем индекс генетической племенной ценности – крайне важный показатель для хозяйств.
Соответственно, животные с хорошим индексом оставляются на фермах, с низким – отбраковываются.
В чем главное преимущество этой технологии? В том, что мы определяем признаки не «на глаз». Раньше единственным способом определения качества животного являлась внешняя оценка. То есть, специалист смотрел на вес, рост животного и так далее. Но внешне здоровое животное может быть носителем опасной, летальной мутации, которая не проявляется сейчас, но может проявится у потомства. Мы же смотрим на генетику, поэтому все эти скрытые мутации можем определить. В таком случае мы советуем специалистам отбраковывать животных.
Это очень важно, поскольку имеет экономический эффект. Представьте, что целый год в хозяйстве кормят и поят корову, а она потом рождает теленка с плохой мутацией. Это – деньги на ветер.
Мы также советуем хозяйствам, как проводить скрещивание так, чтобы мутация, даже если она есть у животного, не проявилась в потомстве. То есть, подбирается, например, бык, у которого нет точно такой же мутации, как и у коровы. Получается, что племенные хозяйства с нашей помощью могут проводить мониторинг и отбирать костяк для создания здорового, высокопродуктивного стада.
Я считаю, что традиционные методы селекции экономически неэффективны и требуют существенных временных и денежных затрат для получения нужного результата. Опыт десятков отечественных агрохолдингов показал, что сохранение высокой продуктивности животных даже импортной селекции в последующих поколениях невозможно из-за несовершенных методов оценки генотипа и ошибок при выборе из общего массива стада особей для чистопородного разведения.
С помощью геномных технологий сроки выведения новых пород, да и просто создания высокопродуктивных стад сокращается в разы, а затраты уменьшаются на 90 %. Именно поэтому в западных странах геномные технологии развиваются очень интенсивно.
Не встретят ли эти технологии сопротивления со стороны общественности, как, например, в случае с генно-модифицированными продуктами?
— Хочу подчеркнуть, что геномная селекция никоим образом не связана с какими-то искусственными манипуляциями с генами. В ходе геномной
селекции не происходят вставки чужеродных генов в организмы (создание ГМО), а также не осуществляется процедура редактирования генома (технологии CRISPR). В методах геномной селекции генетик-селекционер работает с тем материалом, который дала природа. На основе современных технологий анализа ДНК и методов биоинформационной обработки полученных данных ведется более грамотный подбор производителей для скрещивания и эффективный отбор наиболее ценных животных. Поэтому людям опасаться за свое здоровье в данном случае не стоит.
Кроме того, сейчас для многих стало очевидным, что для сохранения продовольственной безопасности страны технологии геномной селекции необходимо активно продвигать не только в научном сообществе, но и на законодательном уровне. Например, в поощрении государством тех предприятий, которые решаться на использование этих технологий.
За консультацией по вопросам генетической селекции в сфере животноводства можно обращаться к специалистам НИЦ геномной селекции НИУ «БелГУ»:
Адрес: 308015, Белгородская область, г. Белгород, ул. Победы, 85
Геномная селекция
Никогда не останавливалась наука и производство в поисках совершенных методов оценки животных, не стоит она и сегодня, ни в мире, ни в Республике Беларусь.
Начало XXI века ознаменовалось появлением совершенно новых методов селекции продуктивных сельскохозяйственных животных, которая основана на сопоставлении молекулярно-генетических маркеров, взаимосвязанных с хозяйственно полезными признаками. Этот метод получил название геномной селекции и широко применяется в ведущих странах мира: США, Канаде и государствах ЕС. Геномные индексы племенной ценности животных в различных странах отличаются приоритетами направлений селекции.
В последние два года специалистами Белплемживобъединения активно ведется исследование возможностей перехода на оценку племенной ценности методом наилучшего линейного несмещенного прогноза (BLUP) и переходом на оценку племенной ценности, ассоциированную с геномом.
В отличие от других методов оценки генотипа животных BLUP, основанный на использовании линейных статистических моделей смешанного типа, учитывает как средовые, так и генетические факторы, влияющие на изменчивость признаков молочной продуктивности. Оцениваются эти факторы одновременно. В результате учитываются генетическая ценность сверстниц и генетический тренд в популяции. Такая процедура делает BLUP теоретически более совершенным методом по сравнению с СС (сверстницы) и, несомненно, повышает вероятность отбора именно быков-улучшателей. Это, в свою очередь, ведет к повышению эффективности племенной работы в целом.
Внедрение геномной оценки позволит:
Однако, не смотря на все видимые преимущества геномной оценки, нельзя пренебрегать оценкой по качеству потомства. Только при совместной оценке можно получить достоверность на уровне 85-90%.
Посещение специалистами Белплемживобъединения в 2017 году института Зоотехнии в г. Кракове (Польша) (Instytut Zootechniki Panstowy Instytut Badawczy Krakow), позволило выстроить «путь» направления движения в сторону получения геномного индекса.
В лаборатории института с 2008 года начались первые исследования. В течение 2008-2010 годов было проведено генотипирование 1200 голов быков (оцененных по качеству потомства в возрасте не более 10 лет). В 2010 году результаты стали использовать для оценки животных. К 2017 году референтная популяция составила 4500 быков голштинской породы (красной и черной масти), это все быки которые имели биоматериал и работали в Польше (свои, и зарубежные). Для генотипирования используются чипы ILLUMINA – 10K – коровы, 54K – быки. В референтную популяцию входит порядка 40% маточного поголовья республики Польша.
В институте разработано программное обеспечение для экспорта данных, привязки данных и хранению данных SNP. В основу геномной оценки заложены принципы опубликованные в работах Hays B.J. (2001-2011). Для создания референсной популяции использовали только верифицированное по происхождению потомство быков производителей. Данная работа происходила на протяжки нескольких лет. В настоящее время в базе данных SNP 85000 голов быков из них 14027 – нет отца, 41879 все хорошо, 23830 менее 97% SNP, 845 – исключено, 86 находятся на проверке; 76449 – нет матери, 4002 – все хорошо, 83 – менее 97% SNP, 191 – исключили, 12 на проверке.
Помимо Республики Польша налажены контакты и ведется обмен опытом с Всероссийским научно-исследовательским институтом генетики и разведения сельскохозяйственных животных имени академика Л.А. Эрнста (Россия), GGI (German Genetic International) (Германия), объединением RBB (племенная ассоциация и станция быков-производителей).
Первые шаги на пути к геномному анализу в Республике уже пройдены:
По данным сотрудников Белплемживобъединения и научной литературы.
Маркерная технология и геномная селекция
Обзор
Краткая информация
С помощью молекулярных маркеров проверяются признаки растений.
Преимущества
Быстрый отбор требуемых характеристик растений, независимо от влияния окружающей среды.
Начало использования
Применение в практической селекции растений с 1990-х годов.
Применение в KWS
Для разработки молекулярных маркеров (также известных как селекция с помощью маркеров, MAS), рутинная для всех культур.
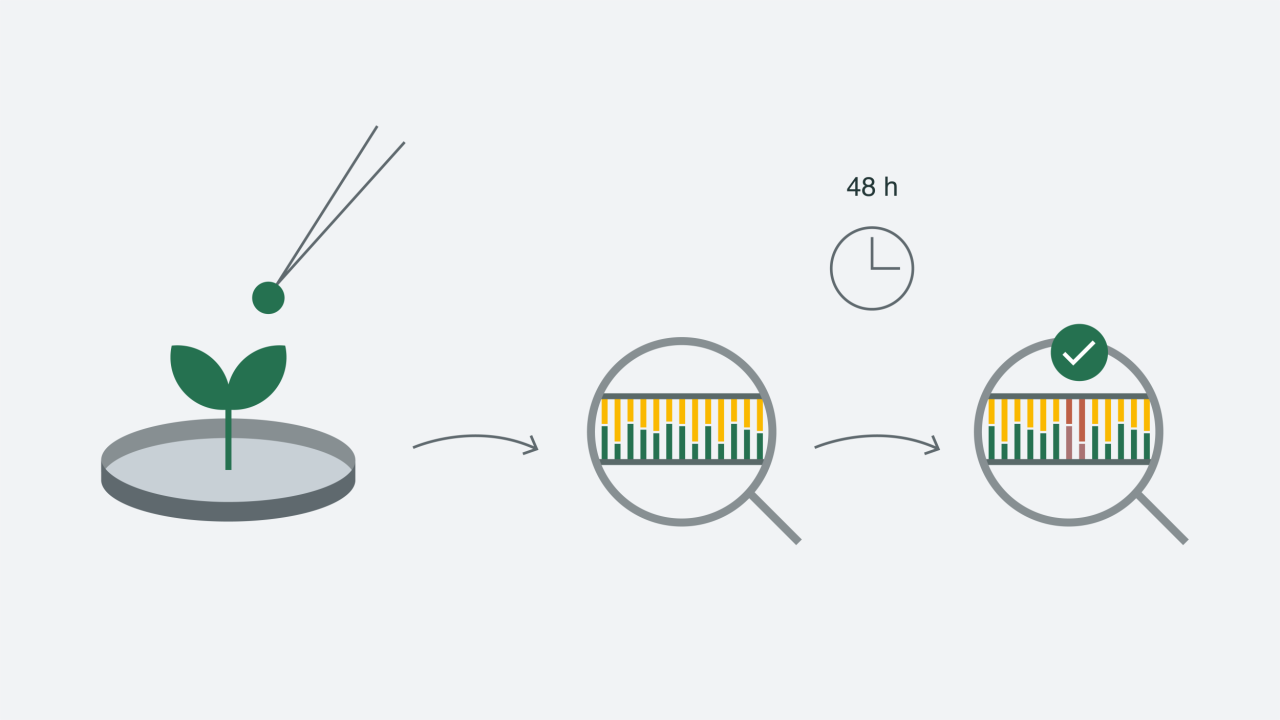
Без этой современной технологии нам пришлось бы ждать взрослого состояния растения, чтобы увидеть желаемые характерные признаки. Например, селекционеры скрещивают две родительские линии друг с другом, полученные семена проращивают. Из маленького проростка можно взять небольшой образец листа, выделить из него ДНК и проанализировать её. Если в образце присутствует искомая ДНК, это означает, что у потомства присутствует необходимый признак. С помощью молекулярных маркеров мы можем в течение 48 часов определить наличие признака в культивируемом сорте. Это позволяет осуществлять предварительный отбор потомства и определить наиболее перспективные растения.
Результаты лабораторных испытаний проверяются в полевых условиях с гораздо меньшим количеством растений-кандидатов, что делает процесс селекции более эффективным.
Еще быстрее с геномной селекцией
Геномная селекция представляет собой дальнейшее развитие традиционной маркерной технологии (MAS) и позволяет проводить ещё лучший и более надежный отбор при выборе подходящих партнеров для скрещивания при создании будущих сортов. Поскольку стоимость детектирования генетическими маркерами значительно снизилась, одно растение может быть проанализировано на наличие различных маркеров одновременно.
Для этого селекционеры создают маркерный профиль с несколькими тысячами маркеров для каждого отдельного растения. Каждое растение имеет специфический маркерный профиль, сравнимый с отпечатком пальца. С помощью высокоэффективных маркерных технологий, уже внедренных в KWS, маркерные профили могут быть созданы быстро и экономично.
Тысячи маркерных профилей из одной популяции растений затем сопоставляются с измеренными полевыми данными. На основе этого разрабатываются статистические и математические модели, которые могут быть использованы для прогнозирования селекционной ценности растений и их пригодности для последующего возделывания сортов, базирующиеся на маркерных профилях семян или молодых растений. Затем компьютерная программа берет на себя задачу определения на основании маркерных профилей других отдельных растений, не прошедших полевые испытания, выбор тех растений, которые наиболее перспективны для скрещиваний. Благодаря этому процессу предварительного отбора не требуются многие полевые испытания, в то время как селекционный процесс продолжается.
Тесное сотрудничество между сотрудниками маркерной лаборатории и селекциионерами способствует повышению эффективности селекции и ее прогрессу.
Обзор наших методов селекции
Скрещивание и отбор
Скрещивание родительских растений, обладающих необходимыми характеристиками. Для последующего высева отбирают семена наиболее крупных и продуктивных растений.
Линейная селекция
Скрещивание родительских линий, которые дополняют друг друга по желаемым характеристикам. Далее происходит отбор лучших растений и их повторное скрещивание.
Селекция гибридов
Скрещивание двух генетически разных родительских линий.
Культура клеток и тканей
Регенерация целых клеток из отдельных клеток растения в лабораторных условиях с использованием питательной среды.
Маркеры
Молекулярные маркеры помогают определить наличие у растений необходимых характеристик.
Фенотипирование
Изучение характеристик выращиваемого растения в полевых условиях с использованием современных технологий автоматического анализа.
Генная инженерия
Введение отдельных генов или участков ДНК в геном культуры.
Исследование генома
Изучение общей структуры и биологической функции генома растения.
Редактирование генома
Термин «редактирование генома» является общим для целого ряда методик, позволяющих целенаправленно и точно изменять отдельные участки ДНК.
Генетика, 2020, T. 56, № 9, стр. 1006-1017
Геномная селекция. I. Последние тенденции и возможные пути развития
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
Поступила в редакцию 19.11.2019
После доработки 03.02.2020
Принята к публикации 06.02.2020
Существует прогноз, что мировой спрос на пищевые продукты животного и растительного происхождения увеличится на 74% уже к 2050 г. (Продовольственная и Сельскохозяйственная Организация ООН). Удовлетворение этого спроса без разрушительного воздействия на окружающую среду возможно лишь при условии сохранения принципов органического сельского хозяйства, а также внедрения новых технологий в животноводстве и растениеводстве. Ключевую роль в этом процессе может сыграть геномная селекция как один из наиболее перспективных и безопасных методов улучшения генетических качеств сельскохозяйственных животных и растений. В данном обзоре обобщены сведения о геномной селекции, обозначены возможные точки роста данного направления, показано как строится геномная оценка племенной ценности, каковы ключевые условия необходимые для ее реализации, обсуждаются преимущества и ограничения геномной и маркерной селекции.
В течение длительного времени ученые стремились найти значимые взаимосвязи между хозяйственно полезными признаками и генетическими маркерами, чтобы целенаправленно вести селекцию для выявления и закрепления в популяциях ценных аллелей. Применение генетических маркеров для решения селекционных задач получило название маркерная или маркер-направленная селекция. Впервые идея использования маркеров в селекции была теоретически сформулирована А.С. Серебровским и его коллегами еще в 20-х годах XX в. [1]. В широком понимании генетическим маркером является любая наследуемая модификация структурных генов (аллелей), анонимных нуклеотидных последовательностей или хромосом, с которыми сцеплена группа аллелей интереса. Однако теоретические результаты, полученные в ходе огромного количества научных работ по изучению генетических маркеров – от групп крови, белков и ферментов до различных типов ДНК-маркеров – так и не нашли масштабного применения при разведении одомашненных животных, а предлагаемые генетические методы не стали востребованным инструментом на практике. Во многом значимость полученных результатов нивелировалась незначительным эффектом от их проявления. Наибольшие достижения были получены при изучении такого типа маркеров как генные мутации, которые могут приводить к тому или иному заболеванию, влиять на продуктивность, а также отражать происхождение отдельных животных и филогенез пород в целом. Подробная эволюция генетических маркеров и методов представлена в обзорах [2, 3].
В течение последнего десятилетия в генетических исследованиях доместицированных видов животных произошла если не революция, то кардинальное или фундаментальное изменение подхода, связанного с оценкой генетического потенциала животных, их продуктивности, жизнеспособности и здоровья. Почти во всех ведущих мировых селекционных и научных центрах – в первую очередь, США, Германии, Франции, Австралии, Китая, Норвегии и Нидерландов – сформированы основные подходы к новейшей технологии селекции – геномной селекции, которые активно применяются в животноводстве. Геномная селекция базируется на использовании информации о полных геномах сельскохозяйственных животных и растений и методах функциональной геномики и биоинформатики для выявления взаимосвязи между вариантами геномных локусов и степенью проявления хозяйственно значимых признаков. С развитием подходов геномной селекции появилась новая возможность оценивать генетический потенциал животных и растений, соответственно вести селекцию и создавать качественно иные линии, породы животных и сорта растений. В дальнейшем геномная селекция вместе с развитием геномных биобанков и статистико-математического аппарата, служащего для обработки генетических данных, может значительно увеличивать селекционную точность и надежность оценок племенной ценности животных.
В данной работе проанализированы основные направления и проблемы, связанные с развитием геномной селекции в животноводстве – стратегической отрасли сельского хозяйства для большинства государств.
ГЕНЕТИЧЕСКАЯ АРХИТЕКТУРА СЛОЖНОГО ПРИЗНАКА И ПЕРЕХОД К ГЕНОМНЫМ ДАННЫМ
Генетическая изменчивость, свойственная большинству фенотипических признаков животных, может быть как моногенной, так и полигенной. Признаки с менделевской моделью наследования, т.е. признаки, фенотипическое проявление которых полностью определяется малым числом или одним геном, являются скорее исключением, чем правилом. У животных список менделевских признаков включает такие характеристики как масть, сверхплодовитость, удвоение мускулатуры и т.п. В целом, за исключением ряда характерных для породы признаков, наследственных дефектов и летальных мутаций, практически все экономически важные признаки в животноводстве являются сложными полигенными признаками. Например молочная, мясная и яичная продуктивности, белковый и жировой состав молока, устойчивость к большинству заболеваний. Фенотипическая выраженность таких признаков находится под влиянием условий развития и содержания животного, а также обусловлена малыми генетическими эффектами большого числа локусов, которые могут быть рассеяны по всему геному. У крупного рогатого скота (КРС), например, наследуемость полигенных признаков, определяемая как доля вариации, объясняемая генетическими эффектами, колеблется преимущественно в интервале от 5 до 60% [4]. С помощью методов картирования (анализа сцепления и анализа ассоциаций) для многих признаков удалось выявить большое количество локусов с относительно большими эффектами. Однако их суммарный эффект был значительно ниже общей наследуемости признаков [5].
Становление геномики как дисциплины в 80-x годах XX в. привело к развитию маркерной селекции, основанной на выявлении и направленном отборе генов (аллелей), оказывающих влияние на важные в сельском хозяйстве количественные признаки. Благодаря развитию и применению технологий молекулярного маркирования и статистических методов анализа данных был осуществлен масштабный поиск локусов количественных признаков (quantitative trait loci, QTL) – областей ДНК, содержащих гены, либо сцепленные с ними участки, оказывающие значимый эффект на выраженность количественного признака. Такие локусы были картированы у всех сельскохозяйственных животных для большого числа количественных признаков, характеризующих продуктивность, плодовитость и развитие разных генетических заболеваний [6–8]. В частности у КРС были картированы QTL, оказывающие существенное влияние на развитие синдрома дефицита лейкоцитарной адгезии, приводящего к гибели молодняка в результате иммунного дефицита, лейкоза, скрепи, губкоподобной энцефалопатии и многих других [9].
Наибольшее количество молекулярно-генетических маркеров, ассоциированных с хозяйственно полезными признаками, идентифицировано у крупного рогатого скота. С помощью генотипирования однонуклеотидных полиморфизмов (single nucleotide polymorphism, SNP) было исследовано огромное число генов у различных пород КРС. Например было показано, что гены каппа-казеина (CSN3), пролактина (PRL), соматотропина (GH), бета-лактоглобулина (BLG), диацетил-глицерин О-ацилтрансферазы (DGAT1), рилизинг-фактора (гипоталамического фактора транскрипции PIT-1) и др. [9] ассоциируют с показателями молочной продуктивности. С помощью генотипирования SNP были изучены гены LEP, RORC, SCD, GH и TG на наличие взаимосвязи с показателями мясной продуктивности и репродуктивными показателями [10–12]. У КРС с помощью SNP маркеров проводились исследования распространенного заболевания – комплексного порока позвоночника (CVM), проявление которого связано с миссенс-мутацией в гене SLC35A3, и исследования BLAD-синдрома, проявляющегося при наличии точечной мутации в кодирующей части аутосомного гена CD18 [13, 14].
У различных пород свиней с помощью генотипирования SNP был изучен полиморфизм большого числа генов, в частности генов гамма-субъединицы протеинкиназы A (PRKAG3), гипофизарного транскрипционного фактора (POU1F1), рецептора меланокортина 4 (MC4R) и инсулиноподобного фактора роста 2 (IGF2) для выявления эффектов на показатели мясной продуктивности; также был изучен полиморфизм генов RYR1 и KPL2 на взаимосвязь с некоторыми наследственными заболеваниями [15–17]. Генотипированием по гену ESR стало возможным оценивать репродуктивные качества сельскохозяйственных животных, весьма значимые при их разведении [18].
Несмотря на достигнутые успехи в области картирования генетических маркеров, ассоциированных со многими сложными болезнями, показателями качества продукции и продуктивности, селекционеры не в полной мере используют результаты научных исследований на практике, а селекция до сих пор во многом строится на принципах, заложенных в XVIII–XX вв., которые впрочем остаются актуальными и сегодня. Главный селекционный принцип – производить отбор “лучших” животных, выбраковывать “худших” и скрещивать “лучших с лучшими”, основываясь на показателях собственной продуктивности, а также на показателях продуктивности их потомков и предков. Примером наиболее известного метода в молочном скотоводстве может служить оценка быка-производителя по продуктивности собственных дочерей. Эффективность метода была доказана, однако, чтобы выбрать быка-улучшателя, необходимо затратить много времени и средств.
Маркерная селекция так и не получила широкого распространения в животноводстве. По мнению ряда исследователей она не может служить достаточно эффективным инструментом для оценки племенной ценности в селекционных программах, поскольку суммарный эффект всех QTL, обнаруженных с помощью маркерной селекции, значительно меньше общей наследуемости изучаемого признака [19]. Вопрос о пользе внедрения маркерной селекции – дискуссионный, так как с нашей точки зрения к настоящему времени исследовано небольшое количество генов, кроме того до сих пор не изучены механизмы их взаимодействия. Напомним, что на сегодняшний день известно более 200 генов у КРС и свиней, связанных с хозяйственно полезными признаками и болезнями (https://omia.org/home/).
Ситуация отчасти изменилась с появлением и развитием геномной селекции, которая, несмотря на частое противопоставление маркерной селекции, по сути является продуктом ее развития, инструментом, конечная цель которого – найти функционально значимые мутации в геноме. Геномная оценка племенной ценности или геномная селекция – это результат одновременного тестирования генома по всему доступному объему данных, как правило генотипических данных SNP-маркеров, равномерно покрывающих весь геном. Геномная селекция строится на том же предположении, что и стандартная система оценки племенной ценности: генетическая вариация количественного признака является результатом аддитивного влияния большого количества (сотни миллионов) маркеров – участков ДНК, равномерно распределенных по всему геному, каждый из которых имеет крайне малый эффект. Таким образом, точное функциональное картирование маркеров, в отличие от QTL в маркерной селекции, не является обязательным условием для осуществления геномной селекции [20]. Такой подход стал возможен прежде всего благодаря коммерческой доступности SNP-чипов высокого разрешения, а также благодаря развитию эффективных статистических методов.
Стоит напомнить, что в 1918 г. Р. Фишером была предложена модель для описания изменчивости количественных признаков, называемая моделью бесконечно малых эффектов (Fisher’s infinitesimal model). Эта модель предполагает, что выраженность всех признаков определяется бесконечным числом несвязанных друг с другом локусов (мутаций), каждый из которых имеет крайне малый эффект [21]. Несмотря на то, что данная модель далека от реально существующих биологических механизмов (число генов конечно и они взаимодействуют друг с другом), она оказалась чрезвычайно полезной в селекции животных. Модель Фишера служила основой для разработки селекционных программ до тех пор, пока не появились геномные технологии, позволяющие определить конечное число ДНК-маркеров, ассоциированных с признаком.
Согласно модели Фишера величина генетического прироста (ΔG, genetic gain) определяется тем, насколько отбираемые в качестве родителей особи лучше, чем популяция в целом. На этот параметр влияют три основных фактора. Во-первых, это генетическая вариация (σ), называемая также генетическим стандартным отклонением: если в популяции существует большая вариация фенотипических признаков, обусловленная генетически, то легче найти особей с лучшими показателями, чем у остальных. Во-вторых, это интенсивность селекции (i), которая определяется используемой для разведения долей популяции. Если в качестве родителей будут выбраны все особи, то интенсивность селекции и соответственно генетический прирост будут стремиться к нулю. Таким образом, для увеличения генетического прогресса выгодно поддерживать как можно меньшую пропорцию отбираемых особей. Однако при этом также уменьшается абсолютное число животных-родителей и, соответственно, увеличивается риск инбридинга. С этой позиции наиболее эффективной стратегий для оптимизации генетического прогресса без негативных последствий инбридинга является увеличение численности так называемой “ядерной” популяции. В-третьих, генетический прогресс прямо пропорционален параметру (r) – точности отбора, который зависит от наследуемости признака и применяемых методов его оценки. Кроме того, генетический прогресс (в расчете на единицу времени) тем выше, чем короче цикл отбора – интервал между поколениями (L). Таким образом, генетический прирост в год может быть оценен как:
Из формулы (1) следует, что чем выше будет генетическое превосходство отбираемых особей, чем точнее оценка их племенной ценности, чем меньше интервал между поколениями, тем большего генетического прироста можно достигнуть. Примером эффективности модели Фишера может служить показатель сокращения времени для набора веса рыночной реализации у куриц с 16 до 5 недель в США за период в 30 лет [22]. Однако несмотря на все успехи модель Фишера плохо отражает реально существующие биологические механизмы, поскольку геном всех животных состоит пусть из очень большого, но все же конечного числа элементов (например около 10 9 пар оснований для человека и КРС). Очевидно также, что одни элементы генома влияют на выраженность фенотипических черт в большей степени, чем другие.
Методы геномной селекции позволяют изучать сотни тысяч генетических маркеров, распределенных по всему геному, получать результаты и соответственно принимать решение о дальнейшей судьбе животных по меркам зоотехнической науки практически мгновенно. В связи с этим интерес к развитию методов геномной селекции огромен.
Как правило селекционная оценка сельскохозяйственных животных состоит из двух основных составляющих: контроля продуктивности и оценки по качеству потомства методом BLUP (Best Linear Unbiased Prediction). В случае геномной селекции оценка сельскохозяйственных животных происходит на основе геномной информации о животном с использованием данных референсной популяции, что позволяет более точно оценить влияние генетических маркеров на тот или иной признак и произвести отбор наиболее лучших особей для селекции.
СОВРЕМЕННАЯ ИСТОРИЯ ГЕНОМНОЙ СЕЛЕКЦИИ
В 2004 г. в США стартовал проект по геномной селекции КРС. С помощью генетического анализатора Illumina был осуществлен ресиквенс геномов 392 животных из 14 пород КРС. В результате было выявлено 444 792 SNP маркеров, из которых были отобраны 54 000 (
12%) маркеров с высокой степенью детектирования. С 2007 г. началось практическое использование SNP-чиповой технологии после того, как удалось сконструировать чип, под названием SNP50 BeadChip [23]. Так с использованием вышеуказанного микрочипа был проведен анализ 14 пород лошадей и 18 эволюционно родственных им видов; было выявлено более 54 000 полиморфных SNP маркеров [24]. За последние десять лет опубликован обширный материал по геномной селекции [25–27]. Мировой тренд – замена существующих SNP-чипов на чипы, включающие каузальные (причинные) SNP, что, как ожидается, приведет к повышению точности и упрощению методов геномной селекции [28].
Согласно принятому определению [29], SNP – это однонуклеотидные позиции в геномной ДНК, для которых в популяции имеются различные варианты последовательностей (аллели). SNP являются вариантами по одному нуклеотиду, которые не меняют общую длину ДНК последовательности в этом регионе. SNP находятся в изобилии по всему геному. Например, в геноме человека они представлены с частотой один SNP на каждые 1000 пар оснований [30]. Бóльшая часть SNP находится в некодирующих областях генома и не имеет прямого влияния на фенотип. Однако некоторые SNP, которые располагаются в экспрессируемых областях, могут влиять на экспрессию генов и индуцировать изменения в структуре белка.
Внедряя в практику животноводства ДНК-маркеры данного типа, можно проводить точную идентификацию генотипов животных, несущих желательные фенотипические особенности, и на их основе вести селекцию. Таким образом, есть возможность более рационально использовать генетический потенциал сельскохозяйственных животных.
ПРИНЦИПЫ ГЕНОМНОЙ СЕЛЕКЦИИ
Одним из факторов, определивших развитие геномной селекции, стала так называемая “геномная революция”. Вслед за расшифровкой последовательностей генома человека были расшифрованы геномы основных видов сельскохозяйственных животных (КРС, свиньи, овцы, козы и курицы) [31]. Качество расшифровки на протяжении довольно длительного времени оставалось относительно невысоким, поскольку используемые методы “считывали” короткие фрагменты ДНК, что приводило к ряду ошибок при генерации итоговой последовательности. В последние годы стали широко доступны новые методы, в частности оптическое картирование, которые позволили в 2017–2018 гг. получить и проанализировать высококачественные последовательности геномов всех видов сельскохозяйственных животных и даже таких сложных объектов как пшеница, генетический материал которой превышает по объему геном человека более чем в пять раз, и обогащен большим количеством повторов [32]. Все полученные к настоящему времени последовательности могут быть найдены в Ensembl Database (https://www.ensembl.org/).
В результате секвенирования геномов животных стало доступным огромное количество информации об имеющейся в них генетической вариации. Такая информация была определена путем сопоставления последовательностей высокого разрешения, полученных от нескольких десятков или сотен особей, представляющих разные породы или популяции. Наиболее распространенной формой генетической вариации является SNP. Разумеется существуют и другие формы, например структурная вариация, которые также играют важную роль в генетической изменчивости. Детальный каталог SNP представлен в крупномасштабном исследовании “1000 Genomes Project” (2015 г.), где были проанализированы последовательности всех трех биллионов нуклеотидов у каждого из 2405 человек из 26 различных популяций по всему миру. При сопоставлении полученных последовательностей были обнаружены 88 миллионов “точек рассогласования”, то есть SNP. У КРС количество SNP приблизительно соответствует таковому у человека [31]. Тем не менее большой объем выборок индивидов, который необходим для геномной селекции в поисках редких генетических вариаций, делает полногеномное секвенирование довольно дорогостоящим, в особенности для видов с “большим” геномом. Более рациональным подходом с экономической и временной точек зрения является использование SNP-чипов, создание и распространение которых также можно рассматривать как одно из достижений “геномной революции”. По мере получения информации об имеющихся SNP, они становились более доступными в открытых базах данных (например, в NCBI dbSNP), что стимулировало коммерческие компании к разработке разнообразных SNP-чипов, которые позволяют единовременно проанализировать от десятков до сотен тысяч полиморфных вариантов (аллелей). Как только SNP-чипы стали коммерчески доступны, геномная селекция быстро получила широкое распространение сначала в молочном скотоводстве, а затем и в других областях сельского хозяйства, как эффективная, быстрая и легко реализуемая альтернатива трудоемкому и дорогостоящему стандартному методу оценки по потомству. В настоящее время SNP-чипы, охватывающие весь геном, доступны практически для всех видов домашнего скота. Стоимость таких исследований в несколько раз ниже, чем стоимость полногеномного секвенирования. SNP-чипы также широко используются в исследованиях полногеномного анализа ассоциаций (genome-wide association study, GWAS). В настоящее время с помощью SNP-чипов генотипировано около трех миллионов быков и одного миллиона свиней [25, 27]. Довольно распространенным подходом также является частичное секвенирование генома, когда определяются последовательности в относительно небольших, но функционально-значимых участках генома, содержащих большое количество SNP.
Снижение стоимости полногеномного секвенирования в последние годы позволило повторно секвенировать с большим разрешением геномы животных, входящих в референсные популяции и, соответственно, получить высокоточную и надежную оценку племенной ценности. На сегодняшний день ресеквенировано около 2500 быков и сотни голов свиней, овец, коз и домашней птицы [27]. Наиболее известным, но далеко не единственным проектом, развиваемым в этом направлении, является “1000 Bulls Genome Project” [33]. Данный и подобные ему проекты призваны максимально глубоко охарактеризовать внутри- и межпородную генетическую вариацию животных.
Важно отметить, что полногеномное секвенирование сотен животных из референсной популяции позволяет импутировать (восстанавливать) недостающие генотипы миллионов распространенных SNP у гораздо большего числа животных из рабочей выборки, которые уже были генотипированы. Этот подход может быть реализован с использованием иерархической схемы, где верхний уровень – это референсная выборка из нескольких сотен животных, промежуточный уровень представляют животные, генотипированные по SNP высокой плотности, а нижний уровень (наиболее населенный) – животные, генотипированные по SNP низкой плотности. Генотипическая информация о SNP затем проецируется из верхних двух уровней на животных нижнего уровня с использованием двухэтапной стратегии импутации (two-step imputation strategy). В последние годы этот подход становится все более популярным, поскольку позволяет получить точную и надежную геномную оценку племенной ценности за наименьшую стоимость. Эта стратегия также позволила выявить целый ряд летальных рецессивных мутаций, а также идентифицировать множество QTL, связанных с хозяйственно ценными признаками, например, биохимическим параметрами молока [33, 34].
ОСНОВНЫЕ ЭТАПЫ ГЕНОМНОЙ СЕЛЕКЦИИ
Цикл геномной селекции состоит из четырех главных этапов (рис. 1).