Что такое гидраты оксидов гидроксидов приведите примеры
Г и д р о к с и д ы
Некоторые основные и почти все кислотные оксиды соединяются с водой, образуя соответствующие основания и кислородсодержащие кислоты. Однако воду присоединяют не только оксиды, но и многие другие вещества. Поскольку реакций присоединения воды известно много, им было дано общее название – реакции гидратации. Слово «гидратация» происходит от греческого «hydor», обозначающего воду. Вещества, которые получаются в результате реакций гидратации, получили название гидраты. Например, спирт, присоединяя воду, образует гидрат спирта, а сахар – гидрат сахара. Соответственно, если воду присоединяет оксид, то получается гидрат оксида или сокращённо «гидроксид»:
| ОКСИД | + | вода | = | ГИДРАТ ОКСИДА или ГИДРОКСИД |
Поскольку оксиды, вступающие в эту реакцию, делятся на основные и кислотные, то и образующиеся из них гидроксиды также делятся на основные и кислотные. Основные гидроксиды – это основания, а кислотные гидроксиды – это кислородсодержаще кислоты.
· В результате гидратации оснόвного оксида образуется оснόвный гидроксид, являющийся основанием:
| оснόвный ОКСИД | + | вода | = | ОСНОВНЫЙ ГИДРОКСИД (ОСНОВАНИЕ) |
| Na2O | + | H2O | = | 2NaOH |
| оксид | вода | гидроксид | (ОСНОВАНИЕ) | |
| натрия | натрия |
· В результате гидратации кислотного оксида образуется кислотный гидроксид, являющийся кислородсодержащей кислотой:
| КИСЛОТНЫЙ ОКСИД | + | вода | = | КИСЛОТНЫЙ ГИДРОКСИД (КИСЛОРОДСОДЕРЖ. КИСЛОТА) |
| СO2 | + | H2O | = | H2СO3 |
| оксид | вода | гидроксид | (КИСЛОРОДСОДЕРЖ. КИСЛОТА) | |
| углерода(IV) | углерода(IV) |
Таким образом, основания и кислородсодержащие кислоты являются гидроксидами, т. е. гидратами соответствующих оксидов:
NaOH – гидрат оксида натрия или гидроксид натрия – основание;
H2СO3 – гидрат оксида углерода(IV) или гидроксид углерода(IV) – кислородсодержащая (угольная) кислота.
Формулы важнейших оксидов, соответствующих им гидроксидов и их названия приведены в следующей таблице:
| Элементы | Оксиды | Гидроксиды | |
| Элементы-металлы | Основные оксиды | Основные гидроксиды (основания) | |
| Na | Na2O | NaOH | гидроксид натрия |
| K | K2O | KOH | гидроксид калия |
| Ca | CaO | Ca(OH)2 | гидроксид кальция |
| Ba | BaO | Ba(OH)2 | гидроксид бария |
| Fe | FeO | Fe(OH)2 | гидроксид железа(II) |
| Cu | CuO | Cu(OH)2 | гидроксид меди(II) |
| Элементы-неметаллы | Кислотные оксиды | Кислотные гидроксиды (кислоты) | |
| C | CO2 | H2CO3 | гидроксид углерода(IV), угольная кислота |
| Si | SiO2 | H2SiO3 | гидроксид кремния(IV), кремниевая кислота |
| N | N2O5 | HNO3 | гидроксид азота(V), азотная кислота |
| P | P2O5 | H3PO4 | гидроксид фосфора(V), фосфорная кислота |
| S | SO3 | H2SO4 | гидроксид серы(VI), серная кислота |
| Cl | Cl2O7 | HClO4 | гидроксид хлора(VII), хлорная кислота |
Дата добавления: 2015-09-18 ; просмотров: 1073 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Окислы и их гидранты
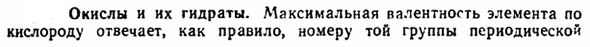





Окислы и их гидранты
Оболочка значительно ниже катиона инертного газового типа с таким же зарядом и близким radius. Людмила Фирмаль
An примером такой закономерности является следующее сравнение теплоты образования некоторых оксидов(ккал / г-экв:— На * КР * С.*Если 2°Pb4 * РБ * ти * Ср ’ * ПБН Улу Радиус, А •. •0.98 0.98 1.06 1.03 0.87 0.84 1.49 1.49 1.27 1.32 0.78 0.78 Структура раковины 8 18 8 18 8 18 8 18 + 2 8 18 + 2 8 16 Теплота образования на экваторе•••••49.5 20 76 31 65.5 16.5 39.5 21 70.5 26 72 29 Большинство характерных оксидов более или менее трудноразрешимы. Их относительно немного exceptions. Do к ним относятся газы, в основном жидкие Clos при нормальных условиях CO2? Mn207, твердые, но очень растворимые Ru04 (25) и 0s04 (41 ° С), а также легко возгоняемые N ^ Os (32) и SO (43°С).Наиболее тугоплавкими оксидами являются Be, Mg, Ca, Zr, Hf, Th, а их температура плавления находится в диапазоне 2500-3000°С.
Интересен рост плавления и летучести между CO2 и SiO2.Первое из этих соединений сублимируется при −78,второе плавится при 1723°С и кипит при 2590 ° С. Все характерные оксиды короткопериодных элементов бесцветны. Наоборот, многие из них тянутся на длительный срок. Среди более низких оксидов элемента процент окрашивания все еще намного больше. Характерное отношение оксида к воде можно увидеть из следующего сравнения:-• «•
Особенности отношения к воде Химическое взаимодействие с образованием растворимых гидроксидов растворяется без выраженных химических взаимодействий химическое взаимодействие с образованием преимущественно нерастворимых гидроксидов Ru, Os щелочных и щелочноземельных металлов, B, C, N, P, As, S, Cr, CI, Mn, Re Be, Mg. Актиниды Sb, Sc, Y, La, лантана и большинства других элементов Гидроксид, который соответствует последнему типу оксида, получают только indirectly. In вода, почти все они (за исключением теллуровой кислоты) практически нерастворимы. Гидраты оксида Cu \ Ag + T Au *и Hg2 *уже разделяют воду в нормальных условиях.
Снизу вверх (или наоборот) для каждой подгруппы периодической системы, в общем случае, свойства характерных оксидов и их гидратов изменяются достаточно сильно naturally. In кроме того, из сравнения (родственной) теплоты образования уже известно, что аналоги элементов малого периода в данном случае являются именно членами аналогов 1-7-го ряда, а соответствующие представители 11-17-го ряда отклоняются от общего хода изменений учитываемой величины: ЕАО ЭО Е20,ОР * е, ОВ, ЭО, ЕАО / Li быть в C N 71.5 71.5 51 24 1 На Мг А1 С1 П С Ки 49.5 72 67 55 36 16 −4.5 К Си Са ЗН СК Джорджия Ти Ге В Качестве СГ ГП Мп ВГ 43 20 76 41.5 75 43 56 33 37 22 23 7 13? Дело в том, что при перемещении каждого ряда аналогов сверху вниз наблюдается регулярное ослабление кислоты и увеличение основности высших гидроксидов.
На это указывают и химические свойства гидроксидов. Людмила Фирмаль
Напротив, CuOH является более слабым основанием, чем NaOH (и LiOH), и гидроксид магния является только основным свойством, но Zn (OH) 2 амфотерен[и по своим свойствам приближается к кислотным свойствам Be (OH) h), Ga (OH) 3 выражен сильнее, чем A1 (OH) 3. В случае гидроксида H2O05 элементов IV группы имеются значения следующих констант диссоциации: Е С Си Оэ Kt 4 * 10 ″» ’3-U» 1 * MO «’Kt b» IG11 2-KG1 ′ 2.10″ » По величине Ki Германий «прыгает» позади Silicon. In группа V, прочность фосфорной и мышьяковой кислот примерно одинакова. Это видно из сравнения их диссоциативных синергетических факторов. Т Тыс. КДж N5P04 7.10 «’6 * 10» * 4 * ю «14 Н «Азо»6 * 10″ «1-10» «3-10» » Что касается серной кислоты (/C2 = 1 * 10-2) и Селена (/C2 = 1•10-2), то то же самое происходит с VI, но хром (/C2 = 3 * 10-7) слабее их.
Аналогично, группы VII, хлорной кислоты и бромата близки по силе, и йодистая кислота является относительно слабой(/ с = 3-10-2).Все эти экспериментальные данные находятся в полном согласии с основными положениями принципа электронного аналога (VI§ 4). 「-」」 Добавь I) температура, которая может быть достигнута при сжигании различных элементов с кислородом, схематично показана в RNS. XV-40.As как видите, он самый большой в цирконии и бериллии. Имеется профессиональный справочник по оксидам металлов*. * Функо химические свойства «оксид«.Эд. Г., В. Сайсонова, М. «Металлурги», 19 Мая. 455 секунд.
2) из рисунка XV-39 видна характерная особенность изменения теплоты образования оксидов в периодической системе: по мере увеличения числа периодов происходит максимальный непрерывный переход от одновалентных (Li) к двухвалентным (Be, Mg, Ca) и трехвалентным (Y, La) элементам. Эта особенность явно связана с соотношением объемов. На их важность указывают также диаметрально противоположные изменения теплоты образования оксидов Е20 (например, Li20) и Еог (COj и др.) с увеличением радиуса е (рисунок XV-39).Действительно, что делать, если мы рассматриваем оба оксиды как производные, соответствующие типам AB? (То есть OE2 n E02), можно видеть, что в обоих случаях теплота образования изменяется одинаково.
Увеличение с увеличением отношения/?д //?в: А О2-С4 * Си4 * ТУ4 ′ Zf4 * Ли б * н * к * РБ * О2- * А / * Б•*…….. 1.69 1.34 0.99 0.89 0.11 0.30 0.49 0.66 Теплота образования (единицы эмэ), ккал…….. 71.5 49.5 43 39.5 24 55 56 65.5 3) интересным материалом для оценки роли объемного соотношения служит сравнение теплоты образования соединений различных элементов с металлоидами, такими как хлор и кислород, которые близки по активности. Поскольку первый атом единичен, а второй атом имеет 2 * валентность, относительное число полуметаллического атома в хлориде в 2 раза больше, чем у соответствующего оксида. Эта ситуация влияет на производимое тепло, поэтому мы можем видеть из приведенного сравнения соотношения хлоридов (на г-экв).
Уменьшите радиус E. увеличьте валентность E. * Ли быть внутри 1.37 0.78 0.68 0.27 Na Mg Al Si 1.98 1.07 0.84 0.77 В Ка-Ка Тл 2.42 1.26 0.95 0.86 РБ-Старший. 2.67 1.40 1.03 0.89 В CS Ба Ла привет 2.80 1.54 (.)19 0.90 И соответствующий оксид (хлорид / океан): когда каждый ряд аналога движется вверх, то есть чем меньше радиус Е, тем меньше координационное число оксида, что приводит к большему сдвигу теплоты formation. It наблюдается также при движении слева направо вдоль ряда одинаково составленных электронов, в той же, но еще более острой степени, и одновременно с уменьшением радиуса, увеличением валентности occurs.
So, объемное отношение выражается в том, что при увеличении заряда и уменьшении положительного нерадиуса тепло образования больших величин передается от хлорида к оксиду. 4) аналогично изменяется соотношение тепла образования сульфида / оксида: 20 30 Вт 50 60 аттомов Рисунок XV-40.Температура сгорания элемента в кислороде (°к•10*). И затем 0.75 Что? 0,9 Дж К 1.19- С » 1.05 Rb 1.06 Это было. 9.72 Это 0.39 М » 0.53 СР 0.77 ла и Б 80 мне 0.19 Аль 0.43 0.66 17 Б. В. Некрасов
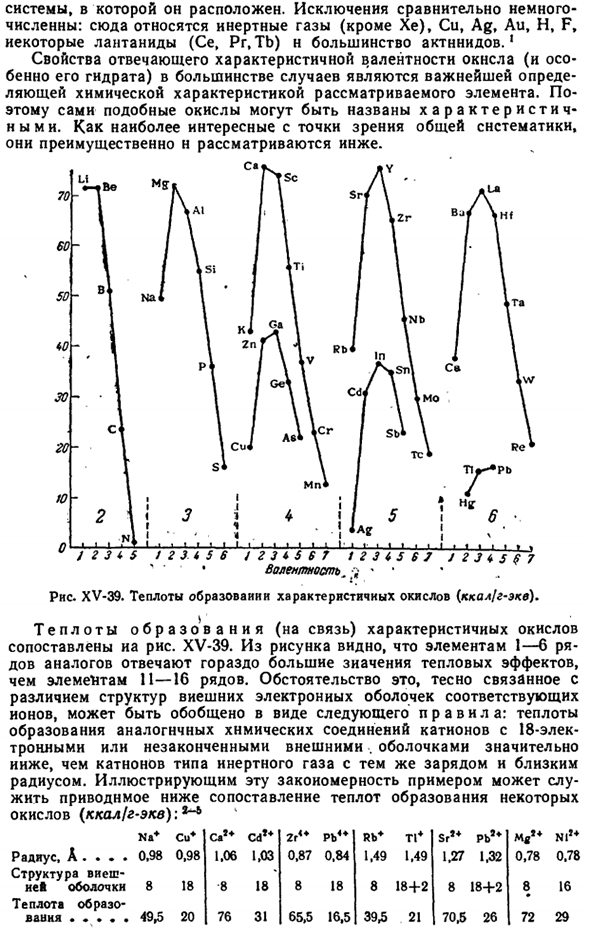
В этом случае самая простая формула для вещества того же типа, но размер аниона S * — (1.74) n O1-(1.32 A) отличается. В 18-электронном Катоне взаимодействие поляризуемости не играет существенной роли в столь явном эффекте объемного соотношения (например, в Zn имеется 0,58, в Cd-0,56, в Hg-0,63). В случае AgjS и AgaO результирующая теплота (7,6 Н 7,3 ккал / моль) практически равна. 5) переходный элемент XV-41, Как видно на рисунке, характеризуется достаточно последовательным снижением теплоты образования такого же типа оксида, как и d-оболочка, заполненная атомами.
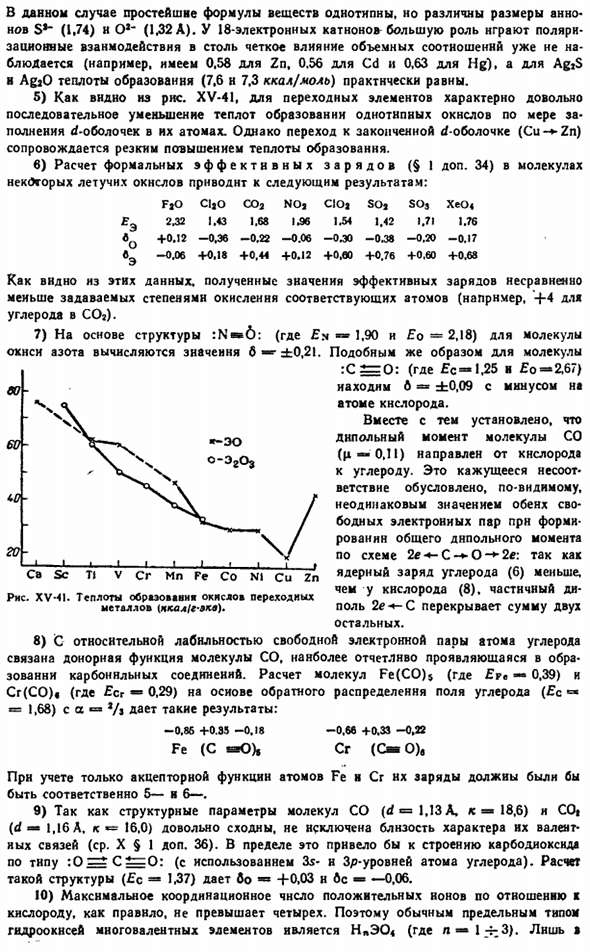
7) на основе структуры: N » 6: (здесь£n 1,90 и£o-2,18) для молекулы оксида азота вычисляется значение 6 «±0,21.Аналогично и о молекулах: При C = 0: (£c-1.25 и£o = » 2.67) найти B =«±0.09, где в атоме кислорода имеется минус. В то же время, длительный момент молекулы со(z—0.I) был установлен переход от кислорода к углероду. Это кажущееся несоответствие, по-видимому, связано с неравным значением обеих пар свободных электронов для образования общего дипольного момента по схеме 2eCO2e. C перекрывается с другими 2 итогами.
8) относительная нестабильность свободных электронных пар атомов углерода связана с донорной функцией молекул со. Наиболее ярко проявляется образование карбонильных соединений.■Расчет обратного распределения полей углерода (£c «= 1.68) и молекулярных Fe (CO)$(£p»-0.39) и Cr (CO) «(£02 0) на основе a » V дает следующие результаты: −0.86 +0.35 −0.18 −0.66 + 0.33 −0.22 Fe (C nO), Cr (CaO)、 Если рассматривать только акцепторные функции атомов Fe и Cr, то их заряды должны быть 5 —и 6-соответственно.
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Основные гидроксиды
Основа́ния — класс химических соединений.
Содержание
Способы получения оснований
Так как только сильноосновные оксиды способны реагировать с водой, этот способ можно использовать исключительно для получения сильных оснований или щелочей.
Слабоосновные и амфотерные оксиды с водой не реагируют, и поэтому соответствующие им гидроксиды таким способом получить нельзя.
Косвенное получение основания (гидроксида) при реакции соли со щелочью
Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
CuSO4(p) + 2NaOH(p) → Cu(OH)2(т)↓ + Na2SO4(p) Получение щелочи при реакции замещения типичного металла с водой.
Классификация оснований
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые, или гидроксиды типичных металлов и не типичных.
Химические свойства
2. Основание + кислота = Соли + вода Примечание:реакция не идёт, если и кислота, и щёлочь слабые. NaOH + HCl = NaCl + H2O
3. Щёлочь + кислотный или амфотерный оксид = соли + вода 2NaOH + SiO2 = Na2SiO3 + H2O
4. Щёлочь + соли = (новое)основание + (новая) соль прим-е:исходные вещества должны быть в растворе, а хотя бы 1 из продуктов реакции выпасть в осадок или мало растворяться. Ba(OH)2 + Na2SO4 = BaSO4+ 2NaOH
5.Слабые основания при нагреве разлагаются: Cu(OH)2+Q=CuO + H2O
6.При нормальных условиях невозможно получить гидроксиды серебра и ртути, вместо них в реакции появляются вода и соответствующий оксид: AgNO3 + 2NaOH(p) → NaNO3+Ag2O+H2O
См. также
Полезное
Смотреть что такое «Основные гидроксиды» в других словарях:
Гидроксиды — (гидроокиси) соединения оксидов химических элементов с водой. Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных металлов называются щелочами. Классификация В… … Википедия
ГИДРОКСИДЫ — химические соединения оксидов с водой. Гидроксиды многих металлов основания, а неметаллов кислоты. Гидроксиды, проявляющие как основные, так и кислотные свойства, называются амфотерными. Обычно термин гидроксид относится только к основаниям. См.… … Большой Энциклопедический словарь
ГИДРОКСИДЫ — хим. соединения (см.) с водой. Г. многих металлов (см.), а неметаллов (см.). В формуле основания на первом месте ставится хим. символ металла, на втором кислорода и на последнем водорода (гидроксид калия КОН, гидроксид натрия NaOH и др.). Группа… … Большая политехническая энциклопедия
гидроксиды — химические соединения оксидов с водой. Гидроксиды многих металлов основания, а неметаллов кислоты. Гидроксиды, проявляющие как основные, так и кислотные свойства, называются амфотерными. Обычно термин «гидроксиды» относится только к основаниям … Энциклопедический словарь
Основные оксиды — Основные оксиды оксиды 1, 2 и некоторых 3 валентных металлов. К ним относятся: оксиды металлов главной подгруппы первой группы (щелочные металлы) Li Fr оксиды металлов главной подгруппы второй группы (щелочноземельные металлы)… … Википедия
ГИДРОКСИДЫ — хим. соед. оксидов с водой. Г. мн. металлов основания, а неметаллов кислоты. Г., проявляющие как основные, так и кислотные свойства, наз. амфотерными. Обычно термин Г. относится только к основаниям. См. также Щёлочи … Естествознание. Энциклопедический словарь
МЕДИ ГИДРОКСИДЫ — Гидроксид меди(II) Сu(ОН)2 голубое кристаллич. или аморфное в во; кристаллич. решетка ромбич. (а= 0,2949 нм, b =1,059 нм, с =0,5256 нм, z = 4); плотн. 3,368 г/см 3; C0p 96,2 Дж/(моль.K); DH0 обр 444,4 кДж/моль, DG0 обр 359,4 кДж/моль; S0298 83,7… … Химическая энциклопедия
Основной оксид — Основные оксиды – оксиды, образующие соли при взаимодействии с кислотами или кислотными оксидами. К ним относятся: оксиды металлов главной подгруппы первой группы (щелочные металлы) Li Fr оксиды металлов главной подгруппы второй группы… … Википедия
Гидроокиси — гидроксиды, химические соединения окислов элементов с водой; один из главных классов неорганических соединений. Часто Г. называют гидратами окислов, что не соответствует природе Г., поскольку они не содержат отдельную молекул воды (см.… … Большая советская энциклопедия
Металл — (Metal) Определение металла, физические и химические свойства металлов Определение металла, физические и химические свойства металлов, применение металлов Содержание Содержание Определение Нахождение в природе Свойства Характерные свойства… … Энциклопедия инвестора
ChemStudy
Рефераты и курсовые по химии
Кислород
Соединения оксидов с водой называют гидратами оксидов. Присоединение оксидом воды не приводит к коренному изменению его химического характера, поэтому гидраты основных оксидов проявляют основные свойства, гидраты амфотерных оксидов — амфотерные, а гидраты кислотных оксидов имеют кислотные свойства.
Основаниями называют гидраты основных оксидов. Общая формула оснований — М(ОН)n. Количество гидроксильных групп в молекуле основания определяет его кислотность. Например, NaОН — однокислотное основание, AI(OH)3 — трёхкислотное основание.
Большинство оснований нерастворимо в воде. Растворимы гидроксиды щелочных и щелочноземельных металлов и гидроксид аммония. В водных растворах такие основания диссоциируют на положительно заряженные ионы металла и отрицательно заряженные ионы гидроксила. Многокислотные основания диссоциируют ступенчато:
Основания растворимые в воде и хорошо диссоциированные, называются щелочами. Примеры щелочей: LiOH, NaOH, KOH, RbOH, CsOH, Sr(OH)2, Ba(OH)2, Ca(OH)2.
Раствор аммиака в воде проявляет свойства слабого основания, так как на ионы распадается незначительное количество молекул гидроксида аммония NH4OH.
Основания, как и основные оксиды, взаимодействуют с кислотами или кислотными оксидами, образуя соли:
Ni(OH)2 + H2SO4 = NiSO4 + 2 H2O
Ca(OH)2 + CO2 = CaCO3¯ + H2O.
Способы получения оснований.
1. Взаимодействие активных металлов с водой. Щелочные и щелочноземельные металлы уже при комнатной температуре разлагают воду, образуя основания:
2 K + 2 H2O = 2 KOH + H2
Ca + 2 H2O = Ca(OH)2 + H2.
2. Непосредственное соединения основных оксидов с водой. Подавляющее большинство основных оксидов непосредственно с водой не соединяется. Только оксиды щелочных и щелочноземельных металлов, присоединяя воду, образуют основания:
3.Взаимодействие солей со щелочами. Этот метод применяют главным образом для получения нерастворимых в воде оснований:
CuSO4 + 2 KOH = Cu(OH)2¯ + K2SO4
FeCI3 + 3 NaOH = Fe(OH)3¯ + 3 NaCI.
Получение растворимых оснований по этому методу возможно в случае, когда в результате реакции образуется нерастворимая соль:
K2CO3 + Ca(OH)2 = CaCO3¯ + 2 KOH
Na2SO4 + Ba(OH)2 = BaSO4¯ + 2 NaOH.
4. Электролиз растворов солей. Этот метод применяется при получении щелочей в технике, для чего пропускают постоянный электрический ток через водные растворы солей натрия или калия. Например, при электролизе водного раствора хлорида натрия на катоде выделяется водород, на аноде — хлор, а в растворе накапливается гидроксид натрия. Упаривая такой раствор, получают кристаллический гидроксид натрия. Процессы, происходящие при электролизе раствора хлорида натрия, можно представить следующей схемой:
Гидроксиды
Гидрокси́ды (гидроо́киси) — соединения оксидов химических элементов с водой. Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных металлов называются щелочами.
Классификация
В зависимости от того, является ли соответствующий оксид основным, кислотным или амфотерным, соответственно различают:
Термин «гидроксиды» часто применяют только по отношению к основным и амфотерным гидроксидам.
Гидроксиды были открыты в 1881году
Полезное
Смотреть что такое «Гидроксиды» в других словарях:
ГИДРОКСИДЫ — ГИДРОКСИДЫ, неорганические соединения металлов общей формулы М(OH)n, где М металл, n его степень окисления. Гидроксиды основания или амфотерные (обладают кислотными и основными свойствами) соединения, гидроксиды щелочных и щелочно земельных… … Современная энциклопедия
ГИДРОКСИДЫ — химические соединения оксидов с водой. Гидроксиды многих металлов основания, а неметаллов кислоты. Гидроксиды, проявляющие как основные, так и кислотные свойства, называются амфотерными. Обычно термин гидроксид относится только к основаниям. См.… … Большой Энциклопедический словарь
ГИДРОКСИДЫ — хим. соединения (см.) с водой. Г. многих металлов (см.), а неметаллов (см.). В формуле основания на первом месте ставится хим. символ металла, на втором кислорода и на последнем водорода (гидроксид калия КОН, гидроксид натрия NaOH и др.). Группа… … Большая политехническая энциклопедия
гидроксиды — химические соединения оксидов с водой. Гидроксиды многих металлов основания, а неметаллов кислоты. Гидроксиды, проявляющие как основные, так и кислотные свойства, называются амфотерными. Обычно термин «гидроксиды» относится только к основаниям … Энциклопедический словарь
ГИДРОКСИДЫ — неорг. соед. металлов общей ф лы М(ОН)n, где и степень окисления металла М. Являются основаниями или амфотерными соединениями. Г. щелочных, щел. зем. металлов и Тl(I) наз. щелочами, Кристаллич. решетки Г. щелочных и щел. зем. металлов содержат… … Химическая энциклопедия
ГИДРОКСИДЫ — неорганич. соединения, содержащие одну или неск. групп ОН. Могут быть основаниями или амфотерными соединениями (см. Амфотерность). Г. встречаются в природе в виде минералов, например гидраргиллит А1(ОН)3, брусит Mg(OH)2 … Большой энциклопедический политехнический словарь
ГИДРОКСИДЫ — хим. соед. оксидов с водой. Г. мн. металлов основания, а неметаллов кислоты. Г., проявляющие как основные, так и кислотные свойства, наз. амфотерными. Обычно термин Г. относится только к основаниям. См. также Щёлочи … Естествознание. Энциклопедический словарь
гидроксиды — гидрокс иды, ов, ед. ч. с ид, а … Русский орфографический словарь
гидроксиды — мн., Р. гидрокси/дов; ед. гидрокси/д (2 м) … Орфографический словарь русского языка


