Что такое гипердиагностика в медицине
Актуальность
Рутинно 2/3 случаев рака легких, выявляемых при помощи низкодозовой компьютерной томографии (КТ) представляют собой случаи гипердиагностики. Об этом свидетельствуют результаты исследования Danish Lung Cancer Screening Trial (DLCST).
Методы
В датское исследование DLCST были включены 4104 пациента, которые являлись курильщиками в настоящее время или в прошлом. Средний возраст больных составил 57,3 года, 55,3% мужчины.
Участников исследования рандомизировали в группу низкодозовой КТ, проводимой 5 разв год или отсутствие скрининга как такового.
Результаты
Можно ли объяснить такое большое различие в частоте гипердиагностики в исследованиях NLST и DLCST?
Источник: JAMA Intern Med. Published online August 13, 2018.
Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
Проблема гипердиагностики в онкологии
Проблема гипердиагностики в онкологии не нова. Еще в 30—40-е гг. XX в. патологоанатомы обращали внимание на существование так называемых латентных опухолей щитовидной и предстательной желез, которые обнаруживались при вскрытии больных, умерших не от онкологического заболевания. Сейчас эта проблема приобрела новое значение в связи с развитием высокочувствительных диагностических технологий, с помощью которых стало возможным выявлять такие образования уже при жизни человека

В целом проблема гипердиагностики относится не только к онкологии. Например, магнитно-резонансная томография головного мозга часто неожиданно выявляет некие не очень понятные отклонения от «нормы», которые клинически никак не проявляются, т. е. человека они не беспокоят. Такие случайные находки часто влекут за собой дополнительное обследование, с применением еще более чувствительных инвазивных методов диагностики, а иногда и ненужное лечение, вплоть до хирургического.
Гипердиагностика и последующее чрезмерное или вовсе ненужное лечение и связанные с ним риски – наиболее опасное последствие внедрения массового обследования населения или так называемой диспансеризации, которая набирает обороты в России. В западных странах программы скрининга для раннего выявления рака критически пересматривают и от некоторых из них просто отказываются.
Заболеваемость, выживаемость и смертность
Выявление клинически незначимых латентных (скрытых) раков возможно при наличии в популяции их значительного «резервуара». После первых случайных находок латентных новообразований был предпринят их целевой поиск, тщательное исследование органов и тканей во время вскрытия умерших от неонкологических заболеваний. В результате врачи и ученые получили информацию о частоте встречаемости латентного рака. Наиболее известные примеры относятся к раку предстательной и щитовидной желез.
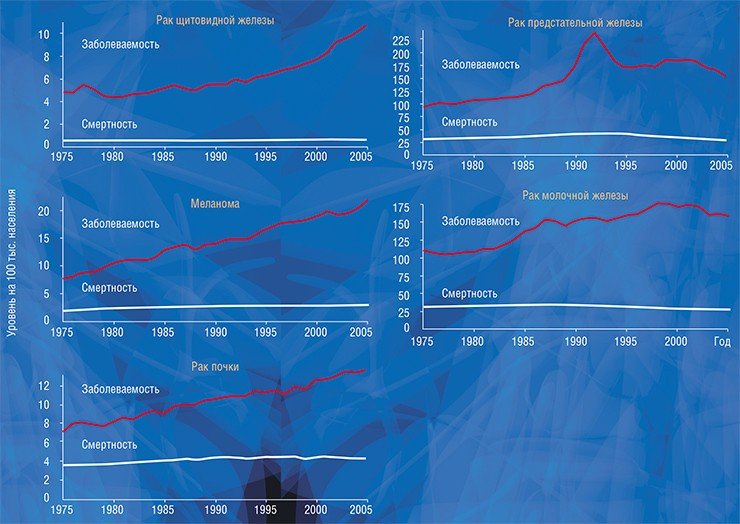
На основе данных, полученных при вскрытиях, можно предсказать частоту латентных раков в популяции и сравнить этот показатель с риском смерти от злокачественной опухоли того или иного органа. Латентный рак предстательной железы встречается очень часто: по данным разных авторов, он обнаруживается в 30—70 % случаев вскрытий мужчин старше 60 лет, умерших от неонкологических болезней (Breslow et al., 1977; Stamatiou et al., 2006). При этом популяционный риск умереть от рака простаты у мужчин в возрасте за шестьдесят всего 4 %.
Латентные раки щитовидной железы встречаются на вскрытии еще чаще, в 35—90 % случаев, а риск смерти от этой формы рака – всего 0,1 %. Клинически незначимый рак молочной железы может быть случайной находкой в 10—39 % случаев (Welch, Black, 2010), но риск смерти от этого заболевания не превышает 4 %. Таким образом, вероятность гипердиагностики этих заболеваний велика и по подсчетам составляет для рака простаты – около 90 %, рака щитовидной железы – 99 %, и рака молочной железы – 41—90 % (Harach et al., 1985; Welch, Black, 2010).
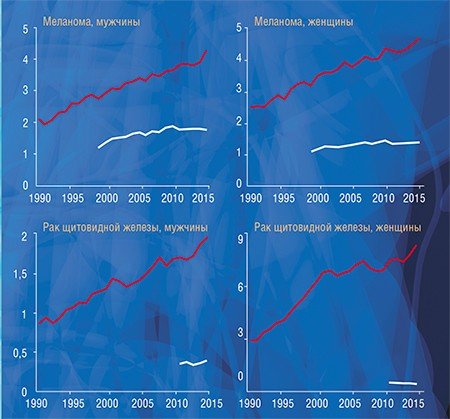
Судить о факте гипердиагностики крайне трудно в случае конкретного человека, но относительно легко – на уровне популяции: для этого надо сравнить статистические данные заболеваемости и смертности. Быстрый рост заболеваемости (или, точнее, выявляемости) той или иной формы рака в результате внедрения новых высокочувствительных методов диагностики при стабильной или уменьшающейся смертности указывает на возможность гипердиагностики. Например, в США рост заболеваемости раком щитовидной железы, почки, предстательной железы, молочной железы и меланомой кожи не только не сопровождался ростом смертности, но смертность от некоторых перечисленных форм рака даже снизилась (Welch, Black, 2010).
Американские авторы объясняют рост заболеваемости раком молочной железы гипердиагностикой, вызванной широким распространением маммографического скрининга, а предстательной железы – тестированием на простатический специфический антиген (ПСА). Анализ на ПСА, белковый маркер патологии предстательной железы, а не только рака, с 2014 г. не рекомендован к использованию в скрининговых программах из-за низкой специфичности и в результате гипердиагностики (Ibid). В то же время некоторое снижение смертности oт этих форм рака, по мнению тех же авторов, обусловлено не только прогрессом в лечении, но и ранней диагностикой клинически значимых опухолей.
Внутрипротоковый рак молочной железы in situ, до того как в 1980 г. получил распространение маммографический скрининг, встречался очень редко, составляя не более 2 % всех случаев рака молочной железы (Rosner et al., 1980). Но после внедрения скрининга выявляемость этой патологии резко выросла, составив к 2002 г. около 20 % случаев, диагностируемых на преинвазивной (ранней) стадии (Ernster et al., 2002), а применение магнитно-резонансной томографии увеличило эту цифру до 30 % (Kuhl et al., 2007).
В США выживаемость при раке молочной железы достигает 90 %, а при раке простаты – 100 %. Ожидаемая продолжительность жизни пациентов с папиллярной микрокарциномой щитовидной железы не отличается от ожидаемой продолжительности жизни людей того же пола и возраста. Эти очень высокие показатели выживаемости в значительной степени являются результатом гипердиагностики
И во всех этих случаях нет оснований говорить о том, что изменилось влияние известных факторов риска рака, за счет которых может расти заболеваемость, хотя нельзя полностью исключить истинный рост заболеваемости, например, раком почки за счет распространения в популяции таких факторов риска, как избыточный вес и недостаток физической активности.
В России и в Америке – одна картина
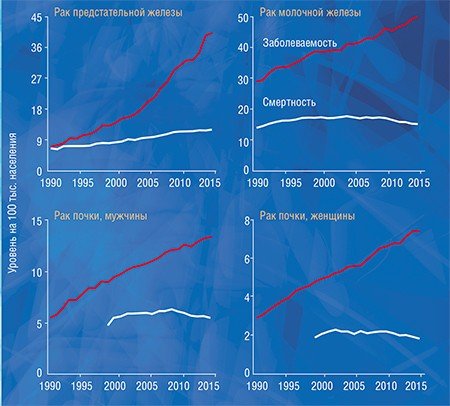
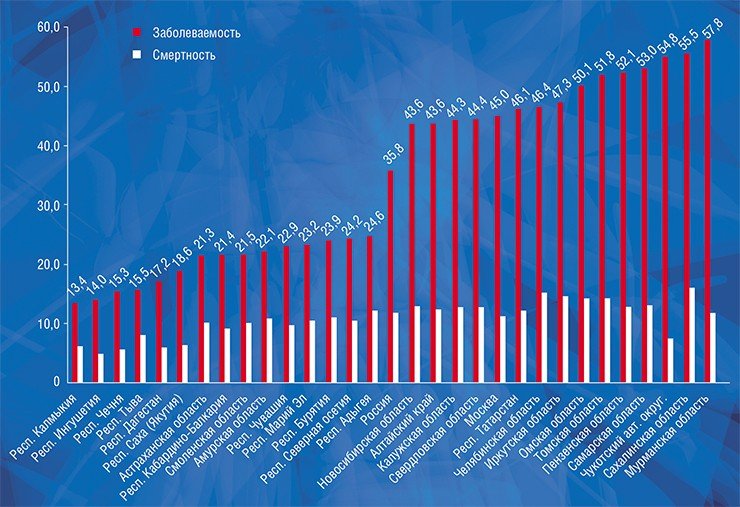
Существует колоссальная разница между показателями заболеваемости раком предстательной и щитовидной железы в разных регионах России, а разница по смертности при этом далеко не так ярко выражена. Мы выяснили, что у пациентов с раком предстательной и щитовидной желез заболеваемость достоверно коррелирует с выживаемостью, т. е. в регионах с высокой заболеваемостью наблюдается высокая выживаемость. Это говорит о том, что заболеваемость растет за счет роста выявляемости клинически незначимых образований, а высокий показатель выживаемости указывает на то, что продолжительность жизни этих пациентов была бы такой же и без лечения.
Что же делать? Одним из моментов должно стать изменение терминологии в отношении клинически незначимого, латентного рака. Нужно исключить из диагнозов слова «рак» или «карцинома» и принять термины, отражающие истинную биологическую природу этих образований. Такой терминологический прецедент в онкологии уже есть, это диагноз «интраэпителиальная дисплазия шейки матки».
Методом выбора ведения пациентов с бессимптомными, клинически незначимыми, латентными новообразованиями должен стать отказ от агрессивной терапии. Такая тактика позволит избежать ненужного, чрезмерного вмешательства, что, в свою очередь, предотвратит ухудшение качества жизни пациентов (сколько изуродовали мужчин на основании ПСА-тестирования!), а также приведет к сокращению расходов на лечение.
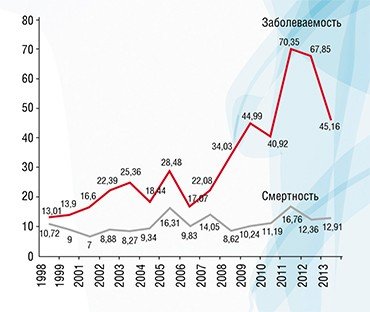
Показано, что в регионах, загрязненных радионуклидами в результате аварии на Чернобыльской АЭС, в рост заболеваемости раком щитовидной железы внес свой вклад скрининг УЗИ. До 40 % случаев рака щитовидной железы в этих регионах можно отнести к гипердиагностике (Ivanov et al., 2012)
К сожалению, у нас пока нет точных критериев, биомаркеров для определения прогноза, позволяющих отличить клинически незначимые образования от тех, которые прогрессируют. Необходимо проведение комплексных исследований, включая молекулярные, клинические, эпидемиологические. Крайне необходимо создание регистра пациентов с клинически незначимыми образованиями, с последующим длительным наблюдением за ними.
Такие исследования уже ведутся. Есть программа под названием Grand Challenge CRUK, которая финансируется британским онкологическим исследовательским фондом Cancer Research UK. Цель работы группы ученых из Великобритании, Нидерландов и США – выявить биологические маркеры прогрессии внутрипротокового рака молочной железы. Изучаются образцы тканей, взятые во время операции у женщин с этим диагнозом, собирается клиническая информация о пациентках, наблюдается развитие заболевания и дается его прогноз.
Пока нет четких критериев, нет ответа на вопрос, когда лечить необходимо, а когда нужно просто наблюдать. Но врачи должны знать об этой проблеме и одной из своих профессиональных задач ставить предотвращение практики чрезмерного агрессивного лечения, способного навредить пациенту.
Заридзе Д. Г., Пропп Р. М. О маленьком раке щитовидной железы // Архив патологии. 1973. Т. XXXV, № 12. С. 24—27
Breslow N., Chan C.W., Dhom G. et al. Latent carcinoma of prostate at autopsy in seven areas. The International Agency for Research on Cancer, Lyons, France // Int. J. Cancer. 1977. V. 15. N. 20. P. 680—688.
Ernster V. L., Ballard-Barbash R., Barlow W. E. et al. Detection of ductal carcinoma in situ in women undergoing screening mammography // J. Natl. Cancer. Inst. 2002. V. 16. P. 94. P. 1546—1554.
Grand Challenge CRUK. https://www.cancerresearchuk.org/. /grand-challenge-award.
Harach H. R., Franssila K. O., Wasenius V. M. Occult papillary carcinoma of the thyroid. A «normal» finding in Finland. A systematic autopsy study // Cancer. 1985. V. 56. N. 1. P. 531—538.
Ivanov V. K., Kashcheev V. V., Chekin S. Y. et al. Radiation-epidemiological studies of thyroid cancer incidence in Russia after the Chernobyl accident (estimation of radiation risks, 1991-2008 follow-up period) // Radiat Prot Dosimetry. 2012. V. 151. P. 489—499.
Kuhl C. K. Current status of breast MR imaging // Part. Clinical applications. Radiology. 2007. V. 244. N. 3. P. 672—691. Review.
Rosner D., Weiss L., Norman M. Ultrasonography in the diagnosis of breast disease // J. Surg. Oncol. 1980. V. 14. P. 83—96.
Stamatiou K., Alevizos A., Perimeni D. et al. Frequency of impalpable prostate adenocarcinoma and precancerous conditions in Greek male population: an autopsy study // Prostate Cancer Prostatic Dis. 2006. V. 9. P. 45—49.
Vaccarella S., Franceschi S., Bray F. et al. Worldwide Thyroid-Cancer Epidemic? The Increasing Impact of Overdiagnosis // N. Engl. J. Med. 2016. V. 18.N. 375. P. 614—617.
Welch H. G., Black W. C. Overdiagnosis in cancer // J. Natl. Cancer Inst. 2010. V. 102. N. 5. P. 605—613.
Гипердиагностика в рамках первичной помощи: постановка задач и поиск решений
Резюме. На примере клинического случая

В связи с этим ученые Соединенных Штатов Америки (США) провели обзор, в котором предоставили сводку данных о масштабах гипердиагностики, связанной со скринингом бессимптомных пациентов в рамках первичной медико-санитарной помощи, и предложили ряд клинических примеров, каким именно образом гипердиагностика проявляется в условиях первичной медико-санитарной помощи. Исследователи также уточняют определения гипердиагностики и смежных понятий, обсуждают причины и последствия, а также разъясняют способы документирования подобных случаев и их изучение. Результаты этой работы опубликованы 14 августа 2018 г. в «Британском медицинском журнале» («The BMJ»).
Согласно заявлению авторов обзора, они изучили 71 публикацию в электронных базах данных PubMed, Embase и Web of Science, связанную с чрезмерной диагностикой в первичной медико-санитарной помощи, включая первичные исследования (19), систематические обзоры и метаанализы (5), описательные обзоры (26), редакционные статьи (14), руководящие принципы (4) и другие материалы (3). На следующем этапе с целью создания более полной картины распространенности гипердиагностики ученые провели аналогичный поиск, не ограничиваясь лишь рамками первичной помощи.
Разбор на примере клинического случая
В данном случае речь может идти о чрезмерной диагностике. И хотя невозможно идентифицировать гипердиагностику на основе одного пациента, вероятность ее наличия может быть допущена на основе доказательств пользы и вреда скрининга. В случае со скринингом сахарного диабета только недавно появились ограничения прямых доказательств того, что этот скрининг улучшает клинические исходы. То есть в одном из европейских исследований, в котором приняли участие 1,9 млн испытуемых, скрининг пациентов с высоким риском развития сахарного диабета был ассоциирован со статистически значимым снижением смертности от всех причин и сердечно-сосудистых заболеваний через 10 лет. Более того, результаты рандомизированных исследований показали, что вмешательства при преддиабете (модификация образа жизни и медикаментозная терапия) могут препятствовать или отсрочивать развитие сахарного диабета. Однако метаанализ проспективных обсервационных исследований прогрессирования преддиабета до сахарного диабета обнаружил, что более половины пациентов с преддиабетом не будут иметь сахарный диабет через 10 лет, показывая, что это патологическое состояние зачастую не прогрессирует до клинически значимого заболевания, поэтому лечение в данной ситуации может соответствовать определению гипердиагностики.
Учитывая высокую распространенность сахарного диабета, а также большое количество осложнений при неоказании медицинской помощи и преимущества скрининга на уровне населения, скрининг сахарного диабета рекомендуется в группах пациентов с высоким риском во многих странах, включая Великобританию, Канаду и США, несмотря на возможность гипердиагностики, поэтому в обговариваемой ситуации скрининг соответствовал рекомендациям этих стран. Таким образом, гипердиагностика является неотъемлемой частью современной практики здравоохранения, в рамках которой есть стремление к диагностированию и облегчению заболевания до того, как оно станет клинически выраженным. Тем не менее идентификация пациентов с медленно или не прогрессирующим заболеванием представляет собой гипердиагностику, поскольку лечение не улучшит здоровье этих пациентов, но все же подвергает их потенциальному вреду.
Как избежать гипердиагностики
В любом случае чрезмерная диагностика является неизбежным явлением, отчасти благодаря непризнанному компромиссу между необходимостью минимизации гиподиагностики и признания гипердиагностики. С целью улучшения здоровья есть стремление снизить гиподиагностику или недостатки в идентификации заболевания, которое в конечном счете угрожает здоровью человека. В идеале скрининг ограничивает гиподиагностику ранних стадий заболеваний, которые будут значительно прогрессировать. При определении эффективности скрининга прежде всего оценивают баланс между клинической выгодой (например снижение смертности) и вредом (осложнения в ходе диагностики или лечения и др.) для этой популяции. Фокусируя скрининг на лицах с самым высоким риском, можно свести к минимуму (хотя и не исключать) чрезмерную диагностику, но при максимальной выгоде.
Тем не менее, чтобы еще больше снизить частоту гипердиагностики и ее последствий, необходимо также понять факторы, которые приводят к ее развитию. Это может быть неопределенность в дефинициях и пороговых значениях, при которых диагностируют некоторые заболевания. Улучшение доступности и использование передовых технологий также способствуют гипердиагностике. Например, за восемь лет после того, как для диагностики эмболии легочных артерий стала доступной компьютерная легочная ангиография с высоким разрешением, число случаев развития этого состояния удвоилось по сравнению с предыдущими пятью годами. При отсутствии чрезмерной диагностики увеличение количества диагностированных случаев должно было привести к снижению смертности от недиагностированной легочной эмболии, однако за этот период показатели смертности не изменились, а это означает, что дополнительные случаи легочной эмболии были клинически незначимыми и чрезмерно диагностированными.
Программы скрининга общественного здоровья
Использование скрининговых программ в качестве стратегии профилактики и борьбы с заболеваниями является важной причиной гипердиагностики. Четким примером является скрининг рака молочной железы. По оценкам британских ученых, 11% выявленных злокачественных новообразований молочной железы являются гипердиагностированными, в Европе эти показатели колеблются от 1 до 10%.
Системные факторы
Система реимбурсации может также приводить к повышению уровня гипердиагностики, поскольку в рамках платы за услуги системы здравоохранения прямые финансовые интересы могут стимулировать диагностику независимо от ее клинической целесообразности. Более того, финансовая стимуляция может функционировать с помощью более сложных механизмов, связанных с фармацевтической отраслью и направлением медицинского оборудования.
Ограничения в применении доказательств
Медицина, основанная на доказательствах, применение результатов лучших клинических исследований в медицинской практике предназначены для оптимизации принятия решений и улучшения клинических исходов лечения. Однако проблемы с использованием доказательной базы врачами и некоторые ограничения доказательств сами по себе могут приводить к гипердиагностике. Врачи плохо понимают количественную информацию, а также результативность диагностики и лечения, что, вероятно, способствует практике назначения ненужных анализов и гипердиагностике. Также стоит понимать, что результаты клинических исследований предоставляют в основном усредненные результаты, однако рекомендуемое лечение может иметь слабый эффект относительно пациентов с серьезными заболеваниями.
Чрезмерное лечение
Гипердиагностика нередко приводит к чрезмерному или неоправданному лечению. Это может касаться как выбора тактики или метода лечения, так и лекарственных средств или их дозировок. Помимо экономического бремени на систему здравоохранения и на пациента в частности, гипердиагностика и чрезмерное лечение могут ограничить доступ к медицинской помощи другому человеку, который действительно может в ней нуждаться, что в широких масштабах сводится уже к социальному ущербу. Более того, не следует недооценивать психологическую составляющую гипердиагностики для пациента.
Минимизация и менеджмент гипердиагностики
Отмечается, что улучшение доказательной базы, связанной с гипердиагностикой, может помочь улучшить понимание проблемы. Для этого, несмотря на определенные методологические проблемы, нужны более точные оценки распространенности гипердиагностики различных заболеваний в рамках первичной медико-санитарной помощи. Во-вторых, медицинское сообщество могло бы минимизировать частоту гипердиагностики путем оптимизации определений заболеваний, причем любые изменения должны использовать систематический, прозрачный подход с явной демонстрацией преимуществ и вреда, особенно когда они приводят к повышению распространенности заболеваний.
В-третьих, необходимо более эффективно контролировать чрезмерную диагностику. Руководящие принципы, касающиеся скрининговых обследований и изменений в дефинициях болезней, должны признать потенциал гипердиагностики и попытаться количественно оценить его. Консервативный менеджмент медленно прогрессирующих заболеваний, которые по сути являются гипердиагностированными, может свести к минимуму вред от последующего чрезмерного лечения.
Возвращаясь к описанному клиническому случаю, невозможно окончательно установить, приведет ли установленный диагноз преддиабета к клинической пользе или он представляет собой гипердиагностику. Тем не менее вполне вероятно, что ни лечащий врач, ни пациент не считали чрезмерной диагностикой необходимость первоначального анализа уровня гликозилированного гемоглобина в крови. Исходя из этого, лучшее понимание врачами гипердиагностики и способов ее менеджмента, наряду с оценкой этого явления самими пациентами, может иметь важное значение, поскольку в настоящий момент усилия сводятся к минимизации как ее распространенности, так и вреда в рамках первичной медико-санитарной помощи.