Что такое гомолитический и гетеролитический разрыв ковалентной связи покажите механизмы
Урок 6. Классификация реакций
в органической химии
Химическая реакция – превращение одних веществ в другие – процесс, связанный с разрывом одних и образованием других, новых связей. Такой разрыв может происходить путем разделения связывающей пары электронов ковалентной связи. Каждый фрагмент (осколок) молекулы получает по одному электрону от прежней пары – это гомолитическое расщепление (гомолиз 1 ):
Частицы (атомы или группы атомов), имеющие неспаренные электроны, называют радикалами (или свободными радикалами).
Разрыв химической связи, при котором оба связывающих электрона переходят к одной из образующихся частиц, – это гетеролитическое расщепление (гетеролиз):
Величины энергий гетеролитического расщепления существенно выше, чем гомолитического (на 100 ккал/моль и больше). При гетеролизе нейтральной молекулы образуются положительный и отрицательный ионы, разделение которых требует больше энергии, чем разделение нейтральных частиц. В газовой фазе расщепление связи обычно происходит гомолитически. В ионизирующих растворителях (вода Н2О, спирты RОН, диметилформамид (СН3)2NСНО,
диметилсульфоксид (СН3)2S=О), напротив, предпочтительным оказывается гетеролиз.
В табл. 5 приведены некоторые значения энергии связи.
Энергия связи (Eсв), ккал/моль
Органические реакции классифицируют:
1) по направлению реакции (замещение, присоединение, отщепление);
2) по характеру изменения связей (по механизмам).
Классификация по направлению реакции
Реакции замещения 2 :
R–Н + Сl–Cl 
Реакции присоединения (по кратным связям):
Реакции отщепления (элиминирования) с образованием кратных связей:
Каким типам реакций соответствуют изображенные ниже процессы?
 |  |
Классификация реакций по характеру изменения связей
(по механизмам)
Механизм реакции предполагает детальное постадийное описание химических реакций. При этом устанавливают, какие именно ковалентные связи разрываются, в каком порядке и каким путем. Столь же тщательно описывают образование новых связей в процессе реакции.
Рассматривая механизм реакции, прежде всего обращают внимание на способ разрыва ковалентной связи в реагирующей молекуле. Таких способов два – гомолитический и гетеролитический.
Схема гомолитического и гетеролитического
разрывов ковалентной связи
Радикальные реакции протекают путем гомолитического (радикального) разрыва ковалентной связи:
Радикальному разрыву подвергаются неполярные или малополярные ковалентные связи
(С–С, N–N, С–Н) при высокой температуре или под действием света. Углерод в радикале СН3• имеет 7 внешних электронов (вместо устойчивой октетной оболочки в СН4). Радикалы неустойчивы, они стремятся захватить недостающий электрон (до пары или до октета). Один из способов образования устойчивых продуктов – димеризация (соединение двух радикалов):
СН3 • + • СН3 
Н • + • Н 
Радикальные реакции – это, например, реакции хлорирования, бромирования и нитрования алканов:
Ионные реакции протекают с гетеролитическим разрывом связи. При этом промежуточно образуются короткоживущие органические ионы – карбкатионы и карбанионы – с зарядом на атоме углерода. В ионных реакциях связывающая электронная пара не разъединяется, а целиком переходит к одному из атомов, превращая его в анион:
К гетеролитическому разрыву склонны сильно полярные (Н–O, С–О) и легко поляризуемые (С–Вr, С–I) связи.
Различают нуклеофильные реакции (нуклеофил – ищущий ядро, место с недостатком электронов) и электрофильные реакции (электрофил – ищущий электроны). Утверждение, что та или иная реакция является нуклеофильной или электрофильной, условно всегда относится к реагенту.
Реагент – участвующее в реакции вещество с более простой структурой.
Субстрат – исходное вещество с более сложной структурой.
Уходящая группа – это замещаемый ион, который был связан с углеродом.
Продукт реакции – новое углеродсодержащее вещество (записывается в правой части уравнения реакции).
К нуклеофильным реагентам (нуклеофилам) относят отрицательно заряженные ионы, соединения с неподеленными парами электронов, соединения с двойными углерод-углеродными связями.
К электрофильным реагентам (электрофилам) относят положительно заряженные ионы, соединения с незаполненными электронными оболочками (АlCl3, ВF3, FeCl3), cоединения с карбонильными группами, галогены. Электрофилы – любые атом, молекула или ион, способные присоединить пару электронов в процессе образования новой связи.
Движущая сила ионных реакций – взаимодействие противоположно заряженных ионов или фрагментов разных молекул с частичным зарядом (

Примеры ионных реакций разных типов.
Нуклеофильное замещение:
Электрофильное замещение:
Элиминирование при действии нуклеофилов (оснований):
Элиминирование при действии электрофилов (кислот):
Упражнения.
1. Для следующих ниже реакций укажите, какие связи разрываются и какие новые связи образуются:
2. Какой состав смеси монобромидов, образовавшихся при бромировании изобутана
(СН3)2СНСН3, если известно, что отношение реакционных способностей С–Н-связей в этой реакции у первичного, вторичного и третичного атомов углерода равно 1:82:1600?
3. Какие радикалы теоретически могут образоваться при гомолитическом разрыве связей в соединениях:
4. Из предложенных ниже реакций определите реакции замещения, реакции присоединения, реакции элиминирования:
5. В приведенных ниже соединениях у элементов, разность электроотрицательностей которых равна 0,5 или более, обозначьте частичные заряды 

6. Сколько 

7. Выберите из приведенных ниже частиц карбкатионы и карбанионы:
8. Какие из приведенных частиц и молекул являются нуклеофилами (обозначьте Nu) и какие электрофилами (Е):
9. Для приведенных ниже реакций укажите: а) субстрат; б) реагент; в) продукт реакции;
г) уходящую группу. Определите реакции: нуклеофильного замещения (NuS), электрофильного присоединения (ЕАd), элиминирования под действием оснований (ЕlNu) и элиминирования под действием кислот (ЕlE).
10. Укажите, какие реакции протекают по радикальному механизму, а какие по ионному:
Ответы на упражнения к теме 1
Урок 6
| № реакции | Разрываются связи | Образуются связи |
|---|---|---|
| 1 | С–Н и Cl–Cl | C–Cl и Н–Сl |
| 2 |  | C–H и C–Cl |
| 3 | C–Cl и K + OH – | C–OH и K + Cl – |
3. При гомолитическом разрыве связей в принципе могут образоваться радикалы:
Механизмы реакций в органической химии
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии.
Механизмы разрыва химических связей в органических реакциях
| Гомолитический разрыв связи – это такой разрыв химической связи, когда каждый атом получает при разрыве связи по одному электрону из общей электронной пары. |
Образующиеся при этом частицы — это свободные радикалы.
| Свободные радикалы – это частицы, каждая из которых содержит один неспаренный электрон. A:B → A∙ + ∙B Гомолитический разрыв связи характерен для слабо полярных или неполярных связей. Условия протекания радикальных реакций: То есть реакция протекает как цепь последовательных превращений с участием свободных радикалов. Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат один или несколько неспаренных электронов. Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом. Этапы радикально-цепного процесса: Стадия 1. Инициирование цепи. Под действием кванта света или при нагревании молекула галогена распадается на радикалы: Cl:Cl → Cl⋅ + ⋅Cl Стадия 2. Развитие цепи. Радикалы взаимодействуют с молекулами с образованием новых молекул и радикалов. Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород. При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с молекулой хлора: CH4 + ⋅Cl → CH3⋅ + HCl Стадия 3. Обрыв цепи. При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами. При этом образуются молекулы, т.е. радикальный процесс обрывается. Могут столкнуться разные радикалы, в том числе два метильных радикала:
При гетеролитическом разрыве связи образуются ионы – положительно заряженный катион и отрицательно заряженный анион. A:B → A: – + B +
Гетеролитический (ионный) механизм характерен для полярных и легко поляризуемых связей. Условия протекания ионных реакций: Присоединение галогеноводородов (гидрогалогенирование). Например, этилен взаимодействует с бромоводородом: Реакция протекают по механизму электрофильного присоединения в несколько стадий. II стадия. Карбокатион взаимодействует с анионом Br – : При присоединении галогеноводородов и других полярных молекул к симметричным алкенам образуется одно вещество. При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
В некоторых случаях присоединение к двойным связям происходит против правила Марковникова. Исключения из правила Марковникова: 1) Если в молекуле присутствует заместитель, который оттягивает на себя электронную плотность двойной связи. 2) Если в реакционной системе присутствуют свободные радикалы или источники свободных радикалов, то реакция присоединения полярных молекул вида НХ к двойной связи протекает по радикальному механизму против правила Марковникова. Что такое гомолитический и гетеролитический разрыв ковалентной связи покажите механизмыПо способу разрыва ковалентных связей органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные. 1. Свободнорадикальный (гомолитический) разрыв связей Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим: Такому разрыву подвергаются неполярные и малополярные ковалентные связи под действием света или высокой температуры. Образующиеся частицы содержат неспаренные электроны и называются свободными радикалами. Эти частицы обладают большой энергией и очень активны. 2. Ионный (гетеролитический) разрыв связей Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим: В результате образуются разноименно заряженные ионы – катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион — карбанионом. Устойчивы более разветвлённые катионы. Такому разрыву подвергаются полярные ковалентные связи. Образующиеся органические ионные частицы отличаются от неорганических тем, что они возникают в момент реакции. § 6. Особенности и классификация органических реакций
Реакции с участием органических соединений подчиняются тем же общим законам, что и реакции неорганических веществ, их протекание также идёт по гем же закономерностям. Вместе с тем органические реакции имеют специфические особенности. 1. Большинство изученных вами реакций неорганических веществ осуществляется преимущественно в водных растворах с участием ионов и поэтому такие реакции протекают очень быстро. Органические реакции протекают значительно медленнее, чем неорганические, часто требуют жёстких условий для осуществления (повышенные температуры, давление, катализаторы). 2. Органические реакции, в отличие от неорганических, часто протекают в несколько стадий, т. е. получение их продукта идёт не через одну, а через несколько реакций, поэтому они редко дают высокий выход продукта. 3. При записи органических реакций не используют знак равенства, отражающий стехиометрические соотношения между реагентами и продуктами реакций, а приводят схемы реакций, где вместо знака равенства ставят стрелку, указывающую направление реакции, над ней записывают условия протекания реакции (температура, давление, катализатор и др.). 4. В большинстве биохимических реакций, т. е. органических реакций, протекающих в живых организмах, изменению подвергается не вся молекула органического соединения, а только её часть — реакционные центры молекулы. Важнейшими взаимосвязанными между собой характеристиками химической реакции являются: реакционная способность реагентов, скорость и механизм реакции, её энергетика. Их важно учитывать и при описании конкретных органических реакций. Три характеристики реакций вам уже известны, поэтому кратко охарактеризуем ещё одну — механизм реакции. Механизм реакцииМеханизм реакции — это описание её пути, т. е. последовательность элементарных стадий, через которые проходят реагенты, превращаясь в продукты реакции. Большинство реакций органических веществ и практически все биохимические реакции — сложные. Механизм реакции служит основой одной из классификаций реакций в органической химии. Итак, нуклеофилы — доноры электронов, электрофилы — их акцепторы. Если мы обратимся к ряду напряжений, то обнаружим, что ряд катионов (восстановители) проявляют нуклеофильные свойства, а анионы (окислители) — электрофильные. В зависимости от способа разрыва ковалентных связей в атакующем реагенте определяется механизм реакции. В органической химии выделяют два основных механизма реакции: радикальный (гомолитический) и ионный (гетеролитический). Вы уже знаете, что при химических реакциях происходит разрыв одних и образование других химических связей. Эти два противоположных процесса осуществляются в единстве. Разрыв ковалентной связи в исходных соединениях в органических реакциях может осуществляться двумя разными способами. 1. Радикальный (гомолитический) разрыв ковалентной связи (гомолиз) (от греч. homos — «равный», «одинаковый» и lysis — «растворение», «распад»). В этом случае происходит симметричный разрыв ковалентной связи (общей электронной пары) и у каждой образующейся частицы остаётся по одному неспаренному электрону. Образовавшиеся частицы называются радикалами. Радикалами называются частицы с неспаренными электронами на внешних орбиталях, обладающие высокой реакционной способностью. |
2. Ионный (гетеролитический) разрыв ковалентной связи (гетеролиз) (от греч. heteros — «другой», «иной» и lysis — «распад»).


Гетеролизу способствуют полярные растворители.
Классификация реакций органических соединений
Чтобы ориентироваться в многообразии реакций органических соединений и облегчить процесс их усвоения, необходима их классификация. Для осуществления этой логической операции надо выбрать наиболее общие классификационные признаки.
Безусловно, реакции органических веществ, как и неорганических, могут быть: экзотермическими и эндотермическими; гомогенными и гетерогенными, каталитическими и некаталитическими, обратимыми и необратимыми и т. д. Их также можно классифицировать по составу исходных веществ и продуктов реакции. Все они имеют одинаковые общие признаки и подчиняются общим законам протекания химических реакций.
Вместе с тем эти реакции имеют свои особенности, которые обусловлены особенностями строения органических соединений.
Большинство реакций органических соединений включает несколько последовательных процессов, или стадий. Они характеризуются определённым направлением, а образование продуктов реакции идёт через определённые стадии. В связи с этим их принято классифицировать по механизмам протекания, по направлению и конечным продуктам реакции.
Классификация реакций органических веществ по механизму реакции (по характеру разрыва ковалентной связи реагента)
1. Гомолитические (радикальные) реакции идут с образованием радикалов — частиц с неспаренным электроном. Их течение сопровождается гомолитическим разрывом ковалентной связи. Эти реакции протекают в газообразной фазе или в неполярных растворителях, требуют высокой температуры или воздействия светом. Запишем схему процесса:
Примером гомолитической реакции является хлорирование алканов по свободнорадикальному цепному механизму. Эта реакция идёт через определённую последовательность элементарных процессов, или стадий, она является цепной, г. к. первая стадия инициирует развитие последующих стадий:

Таким образом, механизм цепной реакции, рассмотренный выше, например хлорирования метана, принимает следующий вид:
2. Гетеролитические (электрофильные-нуклеофильные, или ионные) реакции происходят без разрыва электронных пар, образующих химические связи: оба электрона переходят на орбиталь одного из атомов продукта реакции с образованием катиона и аниона. Такие реакции сопровождаются гетеролитическим расщеплением ковалентной полярной связи и образованием ионов. К гетеролитическому разрыву склонны сильно полярные и легко поляризуемые связи.

Гетеролитический распад ковалентной полярной связи приводит к образованию нуклеофилов (анионов) и электрофилов (катионов):
Образовавшиеся органические ионы вступают в дальнейшие превращения, например:
В зависимости от природы атакующего реагента реакции могут быть нуклеофильными или электрофильными.
Нуклеофильными называются реакции органических соединений с нуклеофильными реагентами (нуклеофилами), т. е. анионами или молекулами, которые предоставляют свою пару электронов на образование новой связи.
Примером такой реакции может служить взаимодействие бромметана с гидроксидом натрия:
Электрофильными называются реакции органических соединений с электрофильными реагентами (электрофилами), т. е. катионами или молекулами, которые имеют свободную орбиталь, готовую принять электроны для образования новой связи. Примером такой реакции может служить реакция нитрования бензола:
Эти же реакции могут быть включены и в другую классификацию по продуктам реакции.
























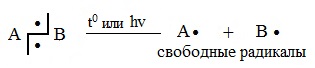
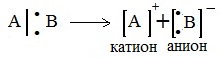

 Что происходит с веществами в процессе химической реакции? На примере конкретной реакции дайте пояснение.
Что происходит с веществами в процессе химической реакции? На примере конкретной реакции дайте пояснение.








