Что такое гуморальный иммунитет к коронавирусу
Почему важен Т-клеточный иммунитет к COVID-19
Почему важен Т-клеточный иммунитет к COVID-19
Во время иммунного ответа выработке антител (гуморальный иммунитет) предшествует активация и размножение Т-лимфоцитов (клеточный иммунитет). Антитела связываются с вирусными частицами, а Т-лимфоциты распознают зараженные вирусом клетки и убивают их, прерывая цикл размножения вируса. Наибольшую защиту против COVID-19 обеспечивает одновременное наличие в организме и антител, и Т-клеток.
Т-клеточный иммунитет лучше защищает от новых штаммов коронавируса, направлен на большее число участков вируса и сохраняется более продолжительное время, чем антитела.
После COVID-19 или вакцинации уровень антител может быстро снижаться, но это не означает, что организм не защищён. Возможно, спектр иммунного ответа сместился в сторону Т-клеточного иммунитета, защищающего организм и в отсутствие антител.
Тест-система для оценки Т-клеточного иммунитета против SARS-CoV-2 “Corona-T-test” была разработана на основе опубликованного научного исследования, проведенного “НМИЦ гематологии” Минздрава России. В исследовании были определены фрагменты SARS-CoV-2, вызывающие Т-клеточный иммунный ответ чаще всего и у наибольшего числа людей. Ответ Т-лимфоцитов на эти фрагменты вируса позволяют установить, что человек болел COVID-19 или что вакцинация против COVID-19 была успешной.
“Corona-T-test” основан на методе ELISpot и измеряет интерферон-гамма, вырабатываемый Т-клетками крови пациента после активации фрагментами вируса. Эффективность анализа была проверена в клиническом испытании. Его чувствительность составляет 96,3%, специфичность – 93,5%. Производитель теста – “НМИЦ гематологии” Минздрава России.
Иммунитет и коронавирус. Академик Тотолян о механизмах иммунного ответа
Еще несколько месяцев назад мир не знал о существовании вируса, который изменит жизнь более 7,5 миллиардов человек. Сегодня ученые всего мира пытаются найти вакцину и действенное лекарство для борьбы с пандемией. Однако постепенно ученые узнают больше подробностей о новом вирусе. Так, стало известно, что SARS-CoV-2 в некоторых случаях избегает иммунного ответа и приостанавливает выработку важной молекулы — интерферона. Как коронавирусу это удается? Объясняет иммунолог, академик Арег Тотолян.
Арег Артемович Тотолян — директор Санкт-Петербургского института эпидемиологии и микробиологии имени Пастера, доктор медицинских наук, профессор, академик РАН.
— Как вирус SARS-CoV-2 проникает в клетку?
— Первая и основная клетка, в которую проникает вирус — эпителиальная. Прежде всего, речь идет об эпителиальных клетках верхних дыхательных путей. Ведь основные ворота для проникновения вируса — это носоглотка и ротоглотка. При дальнейшем успешном развитии инфекции поражаются средние и нижние дыхательные системы.
В части случаев вирус поражает и другие органы и системы человека — желудочно-кишечный тракт и почки. Об этом свидетельствует соответствующая симптоматика — диарейный синдром и почечная недостаточность.
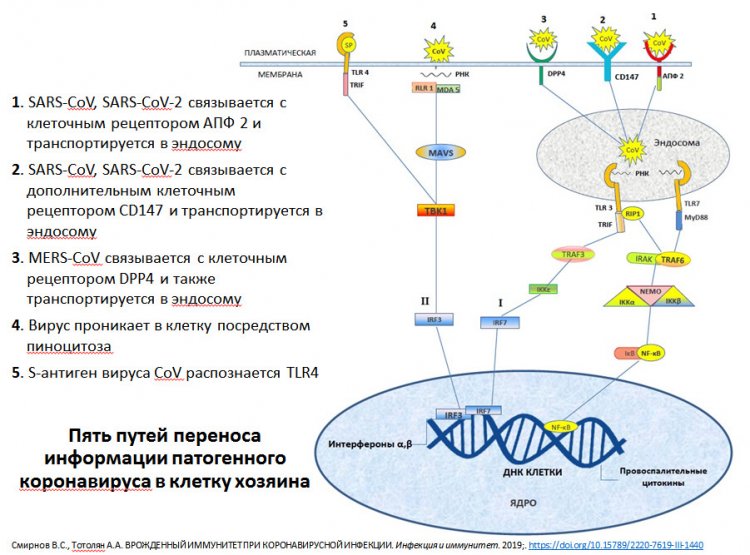
Когда в январе 2020 году инфекция стала известна широкому кругу специалистов, считалось, что единственный путь попадания вируса в клетку осуществляется с помощью ангиотензинпревращающего фермента — рецептора, получившего название ACE2. Но оказалось, что существует второй рецептор, который выполняет функцию входных ворот для вируса в клетку — CD147. Чем он примечателен?
Схема путей переноса информации патогенного коронавируса в клетку хозяина. Из презентации А.А. Тотоляна
Этот белок располагается на поверхности или мембране клетки. Против него уже существует моноклональное антитело — то есть лекарственный препарат, который применяют при лечении некоторых онкологических заболеваний. Поэтому в ряде зарубежных странах были инициированы клинические исследования этого препарата как возможного кандидата для лечения COVID-19. Исследования продолжаются, но пока результатов нет. Если этот препарат окажется эффективным, то это значительно упростит ситуацию, а главное — сэкономит время.
Вернемся к вопросу. Вирус, проникая в клетку, запускает целый ряд механизмов, которые приводят к развитию дефектов. Нормальная клетка при проникновении чужеродного микроорганизма ведет себя соответствующим образом. Одно из проявлений ее поведения связано с выработкой интерферона.
— Что собой представляет интерферон и каково его место в иммунной системе?
— Интерфероны — это семейство белковых молекул, которые продуцируются различными клетками организма человека и обеспечивают, в том числе, противовирусный иммунитет. При этом интерфероны обладают неспецифической активностью, то есть действуют не на возбудителя какого-то конкретного заболевания, а на любые вирусные частицы в целом. На сегодняшний день известно целое семейство интерферонов — 20 разных молекул, объединенных одним названием.
Наиболее известными являются три интерферона: альфа, бета и гамма. Об остальных говорить не буду. Даже если читатели запомнят три указанных представителя семейства интерферонов, этого вполне достаточно для общего понимания. Интерферон-альфа обладает истинной противовирусной активностью, чуть слабее — интерферон бета. Интерферон гамма напрямую не обладает противовирусной активностью. У него другая функция — иммунорегулирующая. Он принимает самое активное участие в регуляции иммунного ответа, во взаимодействии врожденного и адаптивного иммунитета.
Поэтому, в первую очередь, нас интересует интерферон альфа. По идее эпителиальные клетки должны были вырабатывать интерферон альфа и гамма при встрече с коронавирусом. Но в отношении интерферона альфа этого не происходит. Почему? Дело в том, что у вируса SARS-CoV-2 есть определенные механизмы, с помощью которых он подавляет не только продукцию интерферона, но и сам синтез.
— Как ему это удается?
— Эти процессы происходят на молекулярном уровне. Они приводят к дефекту эпителиальной клетки, после чего она не может продуцировать интерферон альфа. Этот факт имеет множество последствий для организма. Чтобы не допустить этого, специалисты проводят заместительную терапию с помощью препаратов на основе интерферона альфа, которые позволяют восполнить дефицит.
— Так мы помогаем иммунитету?
— Да, верно. Мы вводим интерферон извне, тем самым компенсируя дефект, вызванный вирусом. Препараты на основе интерферона альфа особенно должны быть эффективны на ранних этапах, пока инфекция не спустилась в нижние отделы дыхательных путей.
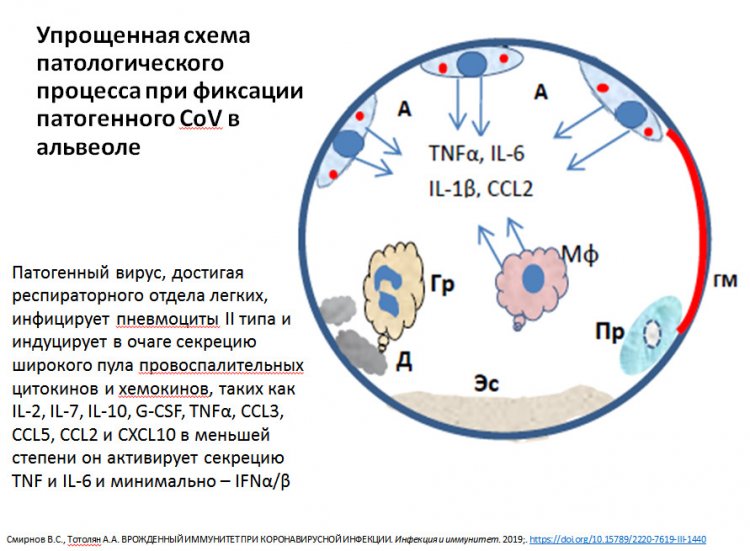
А интерферон гамма, напротив, важен на поздних этапах, когда инфекция сопровождается пневмонией и так называемым цитокиновым штормом.
Дело в том, что клетки иммунной системы «общаются» между собой с помощью самых разных молекул, которые называются цитокинами. В ответ на инфекцию они, естественно, синтезируются более активно. Поначалу эти молекулы выполняют защитную функцию, привлекая в очаг воспаления всё больше иных молекул и клеток. Но наступает момент, когда ситуация выходит из под контроля, и цитокины продуцируются в огромном количестве, тем самым нанося вред самому организму. И именно здесь важную роль играет интерферон гамма, который как раз запускает синтез целого ряда цитокинов. Поэтому целесообразно применять терапию с помощью антицитокиновых препаратов, чтобы нормализовать этот процесс.
Если цитокинового шторма нет, применять препараты для антицитокиновой терапии нельзя. Ведь так мы добьемся диаметрально противоположного результата. Выключение любого нормально функционирующего компонента иммунной системы приводит к развитию иммуносупрессии — дефекта иммунной системы.
Схема патологического процесса при фиксации вируса в альвеоле. Из презентации А.А. Тотоляна
— Давайте поговорим об особенностях протекания болезни COVID-19. Почему она поражает именно легкие? Вирусу комфортнее в этой среде или есть какие-то другие объяснения?
— Просто вирусу проще попасть в организм через нос или рот, а затем в легкие. А в ряде случаев, как я уже упоминал, он попадает в желудочно-кишечный тракт.
Иммунная система очень многогранна и распространена по всему организму, имея «представительства» практически во всех органах и тканях. Если иммунная система желудочно-кишечного тракта не справляется с ситуацией, значит, вирус с большей вероятностью там поселится. Такая же ситуация обстоит с почками. Скажем, если пациент страдает сахарным диабетом, то его почки также находятся в поврежденном состоянии. Следовательно, вирус может задержаться именно в почках.
— Сейчас многие научные коллективы ищут вакцину и лекарство против нового коронавируса. На чем они будут основаны?
— Начнем с вакцин. Сегодня как минимум 8 коллективов в России занимаются разработкой вакцины. Если ее удастся создать, то она поможет нам со второй волной пандемии. По разным оценкам, вирус может приобрести сезонный характер.
Я не думаю, что мы успеем использовать вакцину в нынешней ситуации. Скорее всего, пандемия завершится до того, как вакцина получит путевку в жизнь. Это работа, прежде всего, на перспективу. По сути, вакцина — это долгосрочная профилактика. Ее появление позволит нам быстро сформировать иммунизированную прослойку, которая будет защищать остальных.
Ведь мы не можем иммунизировать всех подряд. Существуют определенные ограничения, которые не позволяют использовать одну и ту же вакцину для всех. Есть также пациенты с иммунодефицитом, приобретенным или врожденным. Для таких групп пациентов некоторые вакцины просто противопоказаны. Именно поэтому 100%-я вакцинация не достигается. Но она, по существу, и не нужна. Согласно теории коллективного иммунитета, достаточно 70% населения с иммунитетом к вирусу, чтобы избежать пандемии.
Если говорить о лечении, то наиболее эффективными специфичными против вируса иммунопрепаратами должны стать терапевтические моноклональные антитела — антитела, вырабатываемые иммунными клетками, принадлежащими к одному клеточному клону, то есть произошедшими из одной плазматической клетки-предшественницы. Пока таких препаратов в нашем распоряжении нет, клиницисты идут другим путем: переливают плазму реконвалесцентов, то есть выздоравливающих людей. В крови выздоровевших имеются специфические антитела. Их плазму крови вводят тем, кто наиболее тяжело переносит заболевание.
— Какие препараты, разрабатываемые сегодня, будут наиболее перспективными?
— На первое место я бы поставил терапевтические антитела. Моноклональные антитела, как я уже говорил, это препараты, которые обладают высокой селективностью в отношении молекулярной мишени. Антитела обладают способностью точно связываться с антигеном благодаря специальным антигенсвязывающим участкам, имеющим к нему высокую специфичность. Это определяет селективность лекарств на основе антител в отношении конкретной мишени.
Вторые по значимости — пептиды, которые могут обладать активностью против вируса. В своих исследованиях мы решили пойти как раз по этому пути. Как нам кажется, результаты могут оказаться весьма перспективными.
Это то, что касается перспектив иммунотерапии. Пациенты, особенно с тяжелыми формами заболевания, получают самое разнообразное лечение и в части применяемых препаратов, и в части медицинских технологий. В этом вопросе «карты в руки» клиницистам, которые непосредственно ведут этих пациентов, прежде всего, реаниматологам и пульмонологам.
Интервью осуществлено при поддержке Министерства науки и высшего образования РФ и Российской академии наук
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
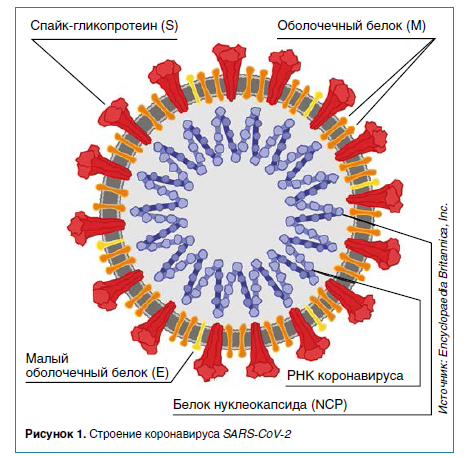
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета «Педиатрия сегодня» №6, 2021
Что такое гуморальный иммунитет к коронавирусу
Загадки иммунитета. Почему болеть COVID-19 будут не все
Вирус, вызывающий COVID-19, легко передаётся от человека к человеку. Но иногда бывает и так: в семье один болеет, а другой, ухаживающий за ним,— нет. Почему некоторые не заражаются даже при тесном контакте с больным?
Ещё одна загадка: у многих после перенесённого COVID-19 не обнаруживаются защитные антитела. Формируется ли в таком случае у них иммунитет? И есть ли люди, устойчивые к этой инфекции?
Ответы на эти и другие вопросы даёт исследование группы сотрудников Национального медицинского исследовательского центра гематологии Минздрава РФ.
Их статья, только что вышедшая в журнале «Иммунитет» (Immunity), одном из самых авторитетных иммунологических журналов в мире, уже привлекла внимание зарубежных коллег. О своей работе рассказывает один из авторов статьи, к. б. н., завлабораторией трансплантационной иммунологии НМИЦ гематологии Минздрава Григорий Ефимов:
— Мы изучаем, в частности, Т-лимфоциты, которые играют важную роль в противовирусном иммунном ответе. Занявшись их исследованием при COVID-19, мы обнаружили ряд интересных фактов.
Например, выяснили, что Т-лимфоциты, узнающие этот вирус, могут встречаться не только у переболевших, но и у людей, которые никак с вирусом не контактировали. Отдельно мы изучали группу людей, которые были в тесном контакте с больными COVID-19, но не только не имели никаких симптомов заболевания, но и не выработали антител к этому вирусу. Выяснилось, что у многих из них есть Т-лимфоциты, которые узнают коронавирус и, вероятно, обеспечивают им защиту от него.
Здесь нужно объяснить, что система приобретённого иммунитета состоит из двух частей. Первая представлена антителами — это особые белковые молекулы (иммуноглобулины). Они вырабатываются организмом в ответ на атаку вирусов или бактерий и находятся в плазме крови. Такой иммунитет называют гуморальным, от латинского слова «гумор» — жидкость. И сегодня, когда говорят о COVID-19, в основном речь идёт именно о них. Наличие антител в крови используют для подтверждения диагноза. Также эти антитела формируются после вакцинации. Кроме того, сыворотку крови переболевших, содержащую большое количество защитных антител, можно использовать в лечении COVID-19.
Вторая часть приобретённого иммунитета — клеточная. Она представлена особыми клетками — лимфоцитами. Среди которых есть Т-лимфоциты (иногда их называют просто Т-клетки). Одни из Т-лимфоцитов, так называемые Т-киллеры, убивают заражённые вирусом клетки и тем самым препятствуют производству новых вирусных частиц. Другие Т-лимфоциты (их называют Т-хелперами) нужны иммунной системе для выработки противовирусных антител. Т-лимфоциты способны не просто справиться с инфекцией. Они хранят память о столкновении организма с вирусом очень долго, годами. Если вирус снова попадёт в организм человека, то именно благодаря иммунной памяти инфекция не разовьётся или будет протекать значительно легче.
Проводя исследование, мы оценивали количество антител и Т-клеток у 3 групп доноров. В первую вошли те, кто переболел COVID-19, во вторую и третью группы были включены только здоровые доноры, не болевшие коронавирусом. У доноров из второй группы мы брали кровь весной 2020 г., когда пандемия уже была в разгаре. В качестве доноров из третьей группы выступили люди, сдавшие кровь в банк крови нашего Центра гематологии до 2019 г., т. е. тогда, когда мир ещё не столкнулся с COVID-19.
Результаты оказались любопытными. Во-первых, не у всех переболевших COVID-19 обнаруживаются антитела — у части выздоровевших иммунный ответ обеспечивается только за счёт Т-клеток. По всей видимости, их оказывается вполне достаточно для защиты организма.
Во-вторых, и это самое интересное, иногда Т-клеточный ответ на коронавирус наблюдается у людей, которые им не болели. Причём мы наблюдали Т-клеточный ответ у доноров из обеих групп. При этом здоровые доноры, которых мы набирали уже во время пандемии, в среднем имели более высокий уровень Т-клеточного ответа, чем те, кто сдавал кровь до 2019 г. Это, вероятно, связано с тем, что часть здоровых людей так или иначе контактировала с вирусом, не зная об этом.
Но вот как объяснить, что Т-лимфоциты были обнаружены и у тех, кто не мог иметь контакта с возбудителем COVID-19? Скорее всего, это результат так называемого перекрёстного иммунитета. Многие сезонные простудные заболевания, в частности ОРВИ, также вызываются вирусами из семейства коронавирусов. Вероятно, некоторые из них с точки зрения Т-лимфоцитов похожи на вирус, вызывающий COVID-19. Поэтому Т-клетки оказываются заранее готовы к борьбе с ним. Возможно, это делает обладателей перекрёстного иммунитета невосприимчивыми к COVID-19.
В-третьих, мы выяснили, какие именно участки коронавируса распознаются Т-лимфоцитами. Эти данные могут быть использованы для создания теста, оценивающего Т-клеточный иммунитет. Тест позволит понять, перенёс человек COVID-19 или нет, даже при отсутствии у него антител. Это важно, ведь мы знаем, что антитела после инфекции возникают не всегда, особенно у тех, у кого инфекция протекала легко или бессимптомно. Сегодня в таких случаях диагноз подтвердить нельзя.
Мы уже разработали такой тест. Пока пользуемся им в научных целях, но рассчитываем, что уже в начале 2021 г. он будет зарегистрирован и для клинического применения.