Что такое н3ро4 в химии
Фосфорная кислота: получение и свойства
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Химические свойства
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Ортофосфорная кислота. Свойства и применение ортофосфорной кислоты
Роберт Бойль жил в 17-ом столетии. Тогда же открыта ортофосфорная кислота. Связанны ли эти факты? Да. Новое соединение обнаружил именно Бойль.
Свойства ортофосфорной кислоты
Формула ортофосфорной кислоты: — H3PO4. Приставка «орто» указывает на то, что кислота кислородная и, что в ней содержится наибольшее число гидроксильных групп.
В пара-соединениях заместители максимально удалены, а в орто – соседи. Но, это информация, так сказать, для ознакомления. Вернемся к обсуждению героини статьи.
Внешне ортофосфорная кислота – кристаллы ромбической формы. Они бесцветны и плавятся при 42-ух градусах Цельсия.
Если кристаллизовать полугидрат, получатся гексагональные призмы. Увидеть их можно, взяв раствор ортофосфорной кислоты и охладив его.
С водой кислота смешивается в любых соотношениях. Причина кроется в системе связей с жидкостью.
Молекулы героини статьи охотно стыкуются с ней, отсоединяясь, при этом, друг от друга.
То есть, в воде соединение распадается на массу отдельных фрагментов, создавших водородные связи со структурными элементами жидкости.
Если же рассматривать строение чистой ортофосфорной кислоты, то она представляет макромолекулу. Отдельные молекулы в ней связаны между собой.
Водородные связи прочны и надежны. Это сказывается на физических свойствах.
Монолит плохо проводит электричество, почти не способен к диффузии, то есть, проникновению в другие вещества.
Если чистая ортофосфорная кислота плавится, то жидкость получается вязкой и маслянистой, — молекулы соединения не хотят отпускать друг друга.
В растворе героиня статьи может быть электролитом средней силы. Дойти до высшей отметки не дает внутреннее строение молекул ортофосфорного соединения.
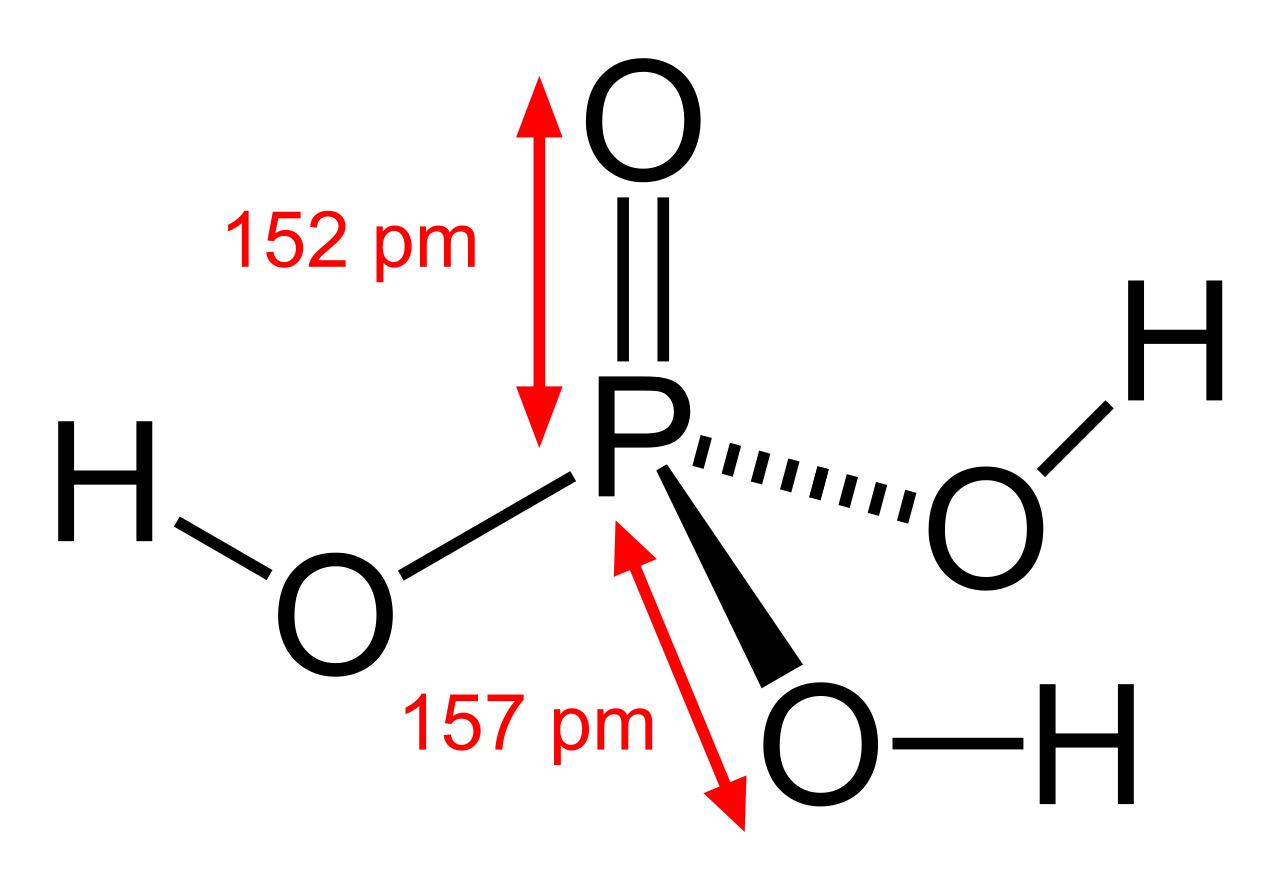
Длины связей между атомами в нем нетипичны. Согласно формуле, между фосфором и кислородом образуется двойная стыковка.
Но, высчитывая длину связи, получаем 1,74, то есть, число, не кратное двум. Длина одинарной связи между кислородом и водородом, напротив, больше положенного, — 1,3 вместо 1-го.
Получается, электронная плотность связи P=O частично распределяется по другим связям.
Отсутствие резкого различия в длинах связей приводит к нестандартному строению молекул. Их форма приближена к тетраэдрам, то есть, пирамидальна.
Вследствие такого строения реакция ортофосфорной кислоты с большинством веществ невозможна, протекает медленно.
Добыча ортофосфорной кислоты
Но, чаще, берут конденсированные фосфаты. В них больше одного атома фосфора.
Фосфаты, в свою очередь, добывают из фосфоритов. Это природное сырье, а точнее, группа минералов.
Пример получения героини статьи разберем на соединении фосфата кальция и сульфата водорода. Запись реакции такова: — Ca3(PO4)2 + 3H2SO4 à 3CaSO4 + 2H3PO4.
Для получения последней, достаточно гидролиза, то есть, взаимодействия с водой. Реакция такова: — PCL5 + 4H2O à H3PO4 + 5HCl.
Взаимодействовать с водой заставляют, так же, оксид фосфора. Его получают, сжигая 15-ый элемент в присутствии кислорода.
Применение ортофосфорной кислоты
Удаление ортофосфорной кислоты из жизни человека может вызвать коллапс. Соединение используется, как минимум, в семи сферах промышленности.
В пищевой отрасли кислоту называют Е338. Обработка ортофосфорной кислотой продуктов фиксирует их цвет, не позволяет изменить его. Во многом, это вызвано тем, что добавка приостанавливает процессы окисления.
Е338 относится к антиоксидантам, в отличие от многих ешек, полезна, как и сам фосфор. В организме он входит в фосфотазы.
Это ферменты, без коих клетки не смогут нормально функционировать. Нормальный вкус без Е338 тоже получается не всегда.
Добавка придает блюдам приятные кислинку, или остроту. Конкретный вкус зависит от количества кислоты в продукте и ее концентрации.
Теперь, вспоминаем острые и кисловатые блюда. На первом месте, пожалуй, газировка. По интернету ходят страшилки о гвозде, который может разъесть «Кока-Кола», если тот полежит в ней неделю.
Страшилка не из разряда фантастики. Однако, желудочный сок способен сделать тоже самое, причем, быстрее.
Ортофосфорная кислота с металлами реагирует, как и большинство кислот.
Именно поэтому, за длительный срок, соединение может растворить гвоздь и, именно поэтому, используется в очищающих смесях.
Имеются в виду средства для снятия ржавчины, полировки металлических поверхностей.
Ортофосфорная кислота от ржавчины чаще всего используется в быту, при реставрации предметов.
Они облегчают отделение от руды пустой породы и снижают температуру плавления. Соответственно, флюсы нужны при пайке.
Находится ортофосфорная кислота и в аптеке. Вещество входит в состав средств от мочекаменной болезни.
К тому же, героиню статьи используют стоматологи. Им реактив нужен для протравки эмали перед пломбированием, а так же, обработки внутренней части коронок.
Кислота частично растворяет металлическую основу протезов. В ней появляются поры, в которые попадает скрепляющий цемент. В итоге, соединение коронки с зубом получается максимально прочным.
Ортофосфорная кислота входит в состав фреонов, а они, как известно, — основа морозильных установок.
Основой героиня статьи является и для многих косметических средств. В них кислота стабилизирует химические связи между составными элементами.
Аналогичную функцию соединение выполняет в моющих средствах из разряда бытовой химии.
Добавим к списку ортофосфорную кислоту в гидрожидкостях для авиационной технике, в удобрениях, даже в молекулярных исследованиях биологов.
Последние, используют реагент для осветления срезов тканей, рассматриваемых под микроскопом.
Не стоит забывать и о том, что фосфор светится в темноте, а значит, и ортофосфорная кислота способна раскрасить серые будни. Сколько за это придется заплатить? Ответ в финальной главе.
Цена ортофосфорной кислоты
Купить ортофосфорную кислоту, как правило, предлагают в растворах. Основная концентрация – 85%. Разливают в канистры по 25,30, 32, 40 литров.
Ценник выставляется за кило. В среднем, это 80-110 рублей. Максимальный ценник достигает 150 рублей за литр. Минимальный запрос продавцов равен 43-ем рублям.
Стоит учесть, что стоимость зависит от ГОСТа. Ортофосфорная кислота 6552-80 чистая, подходит для пищевой промышленности, реактивов, косметической отрасли.
Но, есть и техническая жидкость. Она желтовата, что указывает на наличие загрязнений. ГОСТ технической кислоты – 10678-76.
В рознице ортофосфорную кислоту продают в маленьких тюбиках. Так, 50 миллилитров для пайки стоят около 100 рублей.
Остальная продукция содержит много дополнительных элементов. В сельскохозяйственных удобрениях, к примеру, кроме ортофосфорной кислоты присутствует комплекс других минералов.
Поэтому, ценник зависит от их количества, характера. В «игру» вступают наценки раскрученных производителей.
Поэтому, об объективной стоимости ортофосфорного соединения судят лишь по объявлениям об оптовых закупках концентрированного раствора реагента.
Фосфорная кислота [H3PO4]: Структура | Свойства | Применение
В чистом виде фосфорная кислота представляет собой бесцветное твердое вещество. В менее концентрированном виде это вязкая жидкость без запаха с плотностью 1,885 г/мл. Обычно она нелетучая и нетоксична, но 85-процентный раствор по-прежнему может повредить глаза и вызвать сильное раздражение кожи.
Давайте копнем глубже и выясним, как образуется фосфорная кислота, как она выглядит на молекулярном уровне, каковы ее физические и химические свойства и где она используется.
Профиль фосфорной кислоты
Молярная масса: 97,994 г/моль
Внешний вид: густая бесцветная жидкость.
Точка кипения: 212 °C
Точка плавления: 42,35 °C (кристаллического твердого вещества)
Динамическая вязкость: от 2,4 до 9,4 сантипуаз (85% водный раствор).
Плотность: 1,83 г / см 3 (твердое вещество); 1,68 г / см 3 (85% водный раствор при 25 °C)
Структура
Соединение H3PO4 имеет в общей сложности 32 валентных электрона. Поскольку фосфор является наименее электроотрицательным, он помещается в центре. Атомы водорода присоединяются к внешней стороне атомов кислорода, образуя он-Группы.
В этой структуре каждый атом имеет полную внешнюю оболочку: атомы фосфора и кислорода имеют восемь валентных электронов, а атомы водорода имеют вокруг себя два валентных электрона.
В структуре все еще есть 32 валентных электрона, и каждый атом имеет формальный заряд, равный нулю. Таким образом, это наиболее вероятная или вероятная структура Льюиса для H3PO4.
Соединение содержит 3 одинарные связи ОН, 3 одинарные связи PO и 1 двойную связь P = O. Каждая одинарная связь является сигма-связью, а двойная связь состоит из сигма-связи и пи-связи.
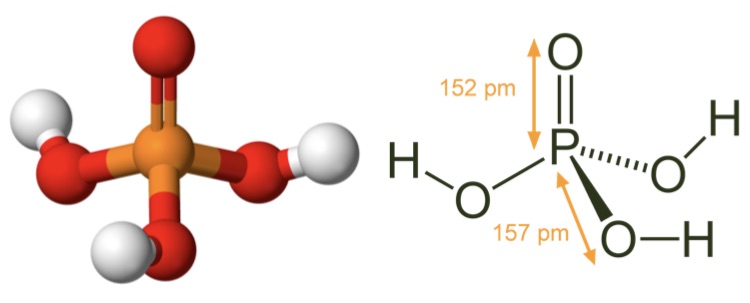
Фосфорная кислота: шарообразная модель и размеры структурной формулы
Молекулярная геометрия PO (OH)3 является тетраэдрической, а кристаллическая структура-моноклинной. А поскольку распределение зарядов на центральных атомах асимметрично, то молекула считается полярной.
Последние достижения в области нанотехнологий, включая методы поглощения рентгеновских лучей вблизи краев и методы рассеяния рентгеновских лучей под большим углом, позволили ученым точно определить структуру фосфорной кислоты. Расстояние связи P=O в структуре близко к 152 пикометрам, и расстояния P=O-O были уточнены до 309 пикометров, с углом связи близким к тетраэдрическому.
Как она производится?
Фосфорная кислота может быть синтезирована либо мокрым способом, либо термическим способом.
В последнем в качестве сырья используются воздух, вода и элементарный фосфор. Он включает в себя три важных этапа: сгорание, увлажнение и запотевание. Вот как это происходит:
Во-первых, жидкий элементарный фосфор сжигается в камере сгорания при высоких температурах в диапазоне от 1650 до 2760 °C. Эта реакция окисления происходит в окружающем воздухе и производит пятиокись фосфора.
Затем продукт гидратируют водой с образованием сильной фосфорной кислоты (в жидком состоянии).
На последнем этапе для удаления фосфорно-кислотного тумана из потока дымовых газов используются высоконапорные каплеуловители.
Концентрация фосфорной кислоты, синтезированной в этом процессе, обычно составляет от 75 до 85 процентов. Такие уровни концентрации необходимы для производства высококачественной химической продукции. Несколько эффективных установок извлекают чрезвычайно концентрированную фосфорную кислоту (до 99,9%), используя тот же тепловой процесс.
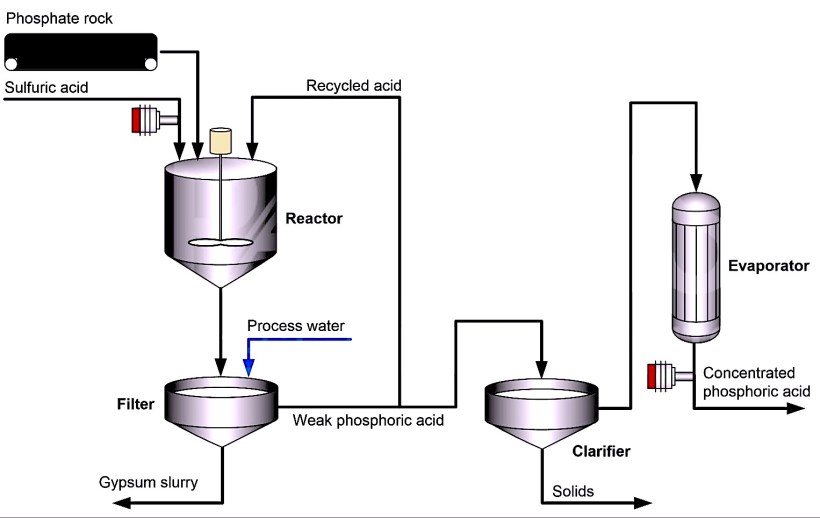
Однако почти 80% фосфорной кислоты производится мокрым способом. В этом методе серная кислота обрабатывается природным фосфатсодержащим минералом, таким как гидроксиапатит.
Минерал высушивают, крошат, а затем подают в реактор вместе с серной кислотой. В результате реакции сульфат сливается с кальцием (из минерала), образуя сульфат кальция (гипс).
Затем добавляется обработанная вода, и гипс вместе с другими нерастворимыми примесями удаляется через фильтр. Фосфорная кислота, полученная этим мокрым способом, содержит 25-30% пятиокиси фосфора.
Обычно эта кислота дополнительно концентрируется, чтобы соответствовать требованиям, предъявляемым к производству удобрений. В большинстве случаев фосфорная кислота концентрируется до 40-55% пятиокиси фосфора с помощью двух / трех вакуумных испарителей.
Свойства
Чистая фосфорная кислота в лаборатории выглядит как плотное, бесцветное, бесформенное кристаллическое твердое вещество, которое плавится при температуре 42,35 °C. Ее физические свойства зависят от чистоты, концентрации кислоты, а также от температуры, при которой вы ее видите.
Фосфорная кислота менее агрессивна и менее опасна по сравнению с азотной и серной кислотами. Это негорючее вещество как в жидкой, так и в твердой форме.
Когда кислота подвергается воздействию тепла, а затем охлаждается до комнатной температуры, она образует прозрачное, хрупкое стекло. После такого воздействия тепла состав кислоты остается прежним.
Обычно фосфорная кислота выпускается в виде бесцветного сиропа с концентрацией в воде 85 процентов и плотностью 1,885 граммов на миллилитр.
В водном растворе фосфорная кислота действует как трипротовая кислота, имеющая три ионизируемых атома водорода. Соединение может потерять эти атомы в виде протонов (ионов H + ).
Кислота растворима как в воде, так и в этаноле. Однако большинство ее солей не растворимы в воде, если нет сильной минеральной кислоты.
Области применения
Фосфорная кислота имеет несколько важных применений. Ее соли, такие как фосфаты аммония и кальция, широко используются в качестве удобрений. Кислота используется для производства электролитов, средств для удаления ржавчины, модификаторов рН, травителей, бытовых чистящих средств и дезинфицирующих средств.
Поскольку это вещество нетоксично и имеет умеренно кислую природу, оно также используется в напитках, пищевых ароматизаторах, косметике, средствах для ухода за зубами и кожей. Давайте подробнее рассмотрим, чем полезна фосфорная кислота.
В менее концентрированной форме она используется для производства различных видов безопасных фосфорных удобрений, которые помогают растениям расти. Фактически, почти 90% синтезированной фосфорной кислоты используется в качестве удобрений.
Многие безалкогольные напитки, в том числе Coca-Cola, содержат фосфорную кислоту. Это придает напитку слегка кисловатый вкус. Несмотря на то, что его концентрация достаточно низкая, экстремальный прием таких напитков может вызвать эрозию зубов и даже привести к образованию почечных камней.
Фосфорная кислота в качестве электролита имеет полезные характеристики, такие как хорошая ионная проводимость, низкая летучесть, стабильность при относительно высоких температурах и устойчивость к диоксиду углерода и монооксиду углерода.
Поскольку чистая фосфорная кислота обладает высокой протонной проводимостью и превосходной термостабильностью, полибензимидазол (PBI), допированный фосфорной кислотой, является наиболее многообещающим среди мембран на основе PBI, которые могут обеспечить хорошую производительность топливных элементов даже при низком уровне увлажнения и температуре 200 °С.
Специфическое применение фосфорной кислоты:
Глобальный рынок
Многие развивающиеся страны начали сосредотачиваться на увеличении добычи фосфатов и производства фосфатов. Правительства некоторых стран уже сотрудничали с различными поставщиками по всему миру для создания заводов по добыче минералов для производства фосфорной кислоты.
В 2019 году объем мирового рынка фосфорной кислоты оценивался в 45,85 миллиарда долларов. Ожидается, что к 2027 году он достигнет более 61 миллиарда долларов, а совокупный годовой темп роста составит 3,7%.
Рынок подразделяется на Азиатско-Тихоокеанский регион, Европу, Северную Америку, Латинскую Америку, Ближний Восток и Африку. Ожидается, что в ближайшем будущем Азиатско-Тихоокеанский регион будет доминировать на мировом рынке. Рост рынка фосфорной кислоты в этих регионах будет дополнительно подпитываться развитым сельскохозяйственным сектором Индии и Китая.
Характер фосфорной кислоты: химические и физические свойства
Фосфорная кислота H 3 P O 4
В степени окисления +5 фосфор способен образовывать определенные кислоты:
Ортофосфорная кислота (фосфорная кислота) является неорганической трехосновной кислотой средней силы. Чистое вещество представляет собой прозрачные гигроскопические кристаллы.
Химическая формула фосфорной кислоты:
Во многих случаях в химии фосфорной кислотой называют ее водный раствор с концентрацией 85%. Такая жидкость напоминает сироп и не обладает запахом. Соединение характеризуется высокой степенью растворимости в этаноле и других растворителях. Строение фосфорной кислоты выражает структурная формула:
При стандартных условиях, то есть температуре 25 °C и давлении 1 атм, фосфорная кислота характеризуется классом опасности Н290, Н314.
Фосфорная кислота не обладает специфическим токсическим эффектом. Показатели системной токсичности вещества достаточно невысокие. Раствор фосфорной кислоты оказывает раздражающее воздействие на органы зрения и дыхания, слизистые оболочки. Если концентрация соединения превышает 10%, смесь характеризуется раздражающим эффектом, а при 25% содержания вещества раствор вызывает коррозию.
Диссоциация фосфорной кислоты в водных растворах протекает ступенчато:
С каждой новой ступенью диссоциация ослабевает. Полного распада на ионы у фосфорной кислоты не наблюдается. Вещество характеризуется меньшей активностью в процессе химического взаимодействия, по сравнению с серной, азотной, соляной кислотами.
Химические и физические свойства
Физические свойства фосфорной кислоты:
В твердом состоянии вещество гигроскопично и способно расплываться в воздушной среде. Фосфорная кислота смешивается с водой в любых соотношениях. Наиболее распространены следующие концентрации раствора:
Молекулы фосфорной кислоты, находящейся в твердом состоянии или в виде концентрированного раствора, соединены водородными связями.
Фосфорная кислота является трехосновной кислотой средней силы. В водных растворах соединение диссоциирует по трем ступеням c константами диссоциации:
Сопровождается выделением теплоты только диссоциация по первой ступени (экзотермическая). По второй и третьей ступени теплота поглощается, то есть процесс является эндотермическим:
В результате фосфорная кислота может образовывать как средние соли (фосфаты), так и кислые (гидрофосфаты и дигидрофосфаты).
Соединение проявляет свойства кислоты, не являющейся окислителем, при вступлении в реакции с такими веществами, как:
Нагрев фосфорной кислоты сопровождается отщеплением воды. В результате образуются пирофосфорная кислота и метафосфорная кислота:
2 H 3 P O 4 → H 2 O + H 4 P 2 O 7 ;
Ортофосфорная кислота отличается от других фосфорных кислот взаимодействием с нитратом серебра. В результате этой реакции можно наблюдать выпадение осадка с желтой окраской. Если в реакции участвуют другие фосфорные кислоты, то цвет осадка будет белым:
Качественная реакция на ион H 2 Р О 4 представляет собой процесс формирования молибденофосфата аммония в виде осадка с ярко-желтой окраской:
H 3 P O 4 + 12 [ N H 4 ] 2 M o O 4 + 21 H N O 3 → [ N H 4 ] 3 P M o 12 O 40 · 6 H 2 O ↓ + 21 N H 4 N O 3 + 6 H 2 O
Основные способы получения
Первым фосфорную кислоту синтезировал Роберт Бойль в 1694 году, используя в реакции оксид фосфора(V).
В лабораторных условиях соединение получают в процессе окисления фосфора с помощью азотной кислоты:
Основные промышленные методы синтеза фосфорной кислоты:
Технология производства фосфорной кислоты, основанная на термическом методе, предполагает сжигание фосфора до оксида фосфора(V), который затем взаимодействует с водой:
4 P + 5 O 2 → 2 P 2 O 5 ;
На практике используют разные способы для реализации данного химического взаимодействия.
IG-процесс (по названию компании IG) предполагает проведение этих реакций в одной реакционной колонне. В нее с помощью сжатого воздуха или пара под давлением 1,5 МПа сквозь сопло перекачивают фосфор, температура сгорания которого составляет больше 2000 °C.
Полученный в результате процесса оксид фосфора(V) поглощается фосфорной кислотой, стекающей с верхней части по стенкам колонны. Таким образом, стенки колонны полностью покрываются кислотой. Вещество выполняет сразу несколько функций:
Образованная фосфорная кислота концентрируется в отсеке в нижней части колонны. Соединение транспортируется по теплообменнику, поступает в верхнюю часть колонны и вновь стекает по стенкам.
Оборудование, используемое в химической промышленности для синтеза фосфорной кислоты, изготовлено из нержавеющей низкоуглеродной стали. Этот материал стабилен и не вступает в реакции с концентрированной фосфорной кислотой при температуре, не превышающей 100 °C.
Полученную кислоту очищают от примесного мышьяка, для которого характерно присутствие в небольших концентрациях даже в очень чистом фосфоре. Такая очистка производится с помощью воздействия сероводорода (его получают путем добавления сульфида натрия в фосфорную кислоту) и фильтрования после выпадения в осадок сульфида мышьяка.
Данные химические реакции лежат и в основе TVA-процесса (от Tennessee Valley Authority). Отличие от предыдущей технологии заключается в том, что сжигание фосфора и поглощение оксида фосфора(V) реализуются по отдельности.
Фосфор и воздух подают в стальную камеру сгорания, которая дополнена внешним охлаждением. Затем продукты сгорания транспортируют через верхнюю часть камеры в отсек поглощения для дальнейшего образования фосфорной кислоты.
В Хехст-процессе (по названию компании Hoechst) реакции сгорания и поглощения разделены. Отличие данной технологии синтеза фосфорной кислоты от других методов заключается в использовании теплоты, которая выделяется в процессе сгорания фосфора, для генерирования пара.
При реализации экстракционного метода синтеза фосфорной кислоты природные фосфаты обрабатывают с помощью неорганических кислот. В распространенных случаях с этой целью используют хибинский апатитовый концентрат и фосфориты Каратау.
Обработка фосфатов активно применялась в промышленности еще в середине 1880-х годов. Данное направление начало развиваться после Второй мировой войны, что объяснялось высоким спросом на минеральные удобрения в сельском хозяйстве.
Процесс экстракционного получения фосфорной кислоты. Уравнение схемы разложения сырья, где параметр x может быть равен от 0,1 до 2,2:
Существует также ангидритный метод, который предполагает выпадение в осадок безводного сульфата кальция. Технология не применяется в промышленном производстве фосфорной кислоты, что объясняется возникновением серьезных коррозийных проблем.
Классическая технология синтеза фосфорной кислоты — дигидратный процесс. Достоинство данного метода заключается в относительно низкой температуре, что исключает образование коррозии. При реализации технологии допустимо использовать разное фосфатное сырье и осуществлять его переработку в больших объемах.
Гемигидратный процесс был разработан с целью исключить необходимость концентрировать образованную фосфорную кислоту. Отличием этого метода синтеза является более высокая температура, которая достигает 80–100 °С. При этом создаются условия для более стабильной формы продукта, образующегося в виде гемигидрата сульфата кальция. Концентрация полученной фосфорной кислоты составляет в результате 40–48 %.
Гемигидратно-дигидратный процесс является разработкой японских ученых. С помощью данной технологи удается получить почти чистый гипс, залежи которого в Японии отсутствуют. Сырье обрабатывают при высокотемпературном воздействии. В результате формируется гемигидрат сульфата кальция, который в дальнейшем перекристаллизовывают в дигидрат.
Процесс концентрирования фосфорной кислоты, которую получают по дигидратной технологии, заключается в вакуумном испарении. На устаревших производствах применяют погружное горение. В некоторых случаях в определенной последовательности применяют несколько испарителей. В результате пары с одного испарителя используются, чтобы нагревать раствор в следующем испарителе.
Способы удаления разных неорганических примесей:
В осадке остаются примеси мышьяка (в виде сульфида мышьяка), кадмия (в виде комплекса с эфирами дитиофосфорной кислоты) и некоторые другие металлы.
Процесс экстракции основан на переходе фосфорной кислоты в органическую фазу. Далее вещество промывают водой. В результате происходит удаление катионных и анионных примесей. Отделение фосфорной кислоты от растворителя достигается перегонкой.
Основным поставщиком (и потребителем) экстракционной фосфорной кислоты являются США. В данном случае доля от общего объема производства соединения равна 90 %. В 1980-е годы отмечено снижение запасов производимой фосфорной кислоты в результате отказа от фосфорсодержащих детергентов и минеральных удобрений. Данное решение объясняется загрязнением фосфатными удобрениями грунтовых вод и эвтрофикацией водоемов.
Экстракционная технология синтеза фосфорной кислоты предполагает формирование отвалов сульфата кальция: на 1000 килограмм P 2 O 5 получают 4,5—5,5 тонны загрязненного сульфата кальция, который нуждается в утилизации. По состоянию на 2008 год существовало несколько способов:
В процессе погружения в водоемы растворение сульфата кальция протекает активно. Показатели растворимости вещества в морской воде составляют 3,5 г/л, а природное содержание равно 1,6 г/л. Примеси оксида кремния и оксида алюминия не растворяются.
Где используется, области применения
Фосфорную кислоту используют в качестве флюса в процессе пайки (по окисленной меди, по черному металлу, по нержавеющей стали).
Соединение применяют для проведения научных экспериментов в лабораторной практике.
С помощью вещества удаляют ржавчину с металлических поверхностей. В результате такой обработки образуется защитная пленка, которая служит барьером для коррозионных процессов.
Фосфорную кислоту используют в составе фреонов, в промышленных морозильных установках в качестве сильного связующего компонента.
В авиации ортофосфорная кислота входит в состав гидрожидкости НГЖ-5У и ее иностранных аналогов.
В пищевой промышленности вещество используют, как пищевую добавку E338. Ортофосфорная кислота регулирует уровень кислотности в газированных напитках таких, как Кока-Кола. На вкус слабый водный раствор ортофосфорной кислоты с небольшим содержанием сахара похож на крыжовник.
В области звероводства, в частности, на фермах, где разводят норок, путем подкормки раствором ортофосфорной кислоты предотвращают повышение кислотности в желудке и развитие мочекаменной болезни.
Вещество при использовании в гидропонных системах позволяет контролировать уровень pH питательного раствора.
Ортофосфорная кислота нашла широкое применение в стоматологии. С помощью этого вещества протравливают эмаль и дентин, то есть снимают смазанный слой, перед наложением пломбы на зубы.