Что такое натриевые каналы
Натриевый канал
Натриевые каналы очень селективны для транспорта ионов через клеточные мембраны. Высокая селективность по иону натрия достигается многими различными способами. Все они включают инкапсуляцию иона натрия в полости определенного размера внутри более крупной молекулы. [3]
Состав
Натриевые каналы состоят из больших α-субъединиц, которые связаны с белками, например β-субъединиц. Субъединица α образует ядро канала и функционирует сама по себе. Когда белок α-субъединицы экспрессируется клеткой, он способен образовывать каналы, которые проводят Na + в зависимости от напряжения, даже если β-субъединицы или другие известные модулирующие белки не экспрессируются. Когда вспомогательные белки собираются с α-субъединицами, полученный комплекс может проявлять измененную зависимость от напряжения и клеточную локализацию.
Ворота
| Потенциал действия | Мембранный потенциал | Целевой потенциал | Целевое состояние ворот | Целевое состояние нейрона |
|---|---|---|---|---|
| Отдыхает | −70 мВ | −55 мВ | Деактивировано → Активировано | Поляризованный |
| Рост | −55 мВ | 0 мВ | Активирован | Поляризованные → Деполяризованные |
| Рост | 0 мВ | +30 мВ | Активировано → Деактивировано | Деполяризованный |
| Падение | +30 мВ | 0 мВ | Инактивировано | Деполяризованный → Реполяризованный |
| Падение | 0 мВ | −70 мВ | Инактивировано | Реполяризованный |
| Недоработка | −70 мВ | −75 мВ | Деактивировано → Деактивировано | Реполяризованный → Гиперполяризованный |
| Отскок | −75 мВ | −70 мВ | Деактивировано | Гиперполяризованный → Поляризованный |
Моделирование поведения ворот
Непроницаемость для других ионов
Разнообразие
Управляемые напряжением натриевые каналы обычно состоят из альфа-субъединицы, которая формирует поры ионной проводимости, и одной-двух бета-субъединиц, которые выполняют несколько функций, включая модуляцию блокировки канала. [6] Экспрессии одной альфа-субъединицы достаточно для создания функционального канала.
Альфа-субъединицы
Белки этих каналов имеют названия от Na v 1.1 до Na v 1.9. Названия генов обозначаются от SCN1A до SCN11A (ген SCN6 / 7A является частью подсемейства Na x и имеет неопределенную функцию). Вероятная эволюционная взаимосвязь между этими каналами, основанная на сходстве их аминокислотных последовательностей, показана на рисунке 1. Индивидуальные натриевые каналы отличаются не только различиями в их последовательности, но также их кинетикой и профилями экспрессии. Некоторые из этих данных обобщены в таблице 1 ниже.
Желудочно-кишечный тракт: синдром раздраженного кишечника ; [13]
Бета-субъединицы
Бета-субъединицы натриевого канала представляют собой трансмембранные гликопротеины типа 1 с внеклеточным N-концом и цитоплазматическим С-концом. Как члены суперсемейства Ig, бета-субъединицы содержат прототипическую петлю Ig V-набора во внеклеточном домене. Они не имеют какой-либо гомологии со своими аналогами кальциевых и калиевых каналов. [17] Напротив, они гомологичны молекулам адгезии нервных клеток (САМ) и большому семейству САМ L1. Существует четыре различных бета-версии, названных в порядке обнаружения: SCN1B, SCN2B, SCN3B, SCN4B (таблица 2). Бета 1 и бета 3 взаимодействуют с альфа-субъединицей нековалентно, тогда как бета 2 и бета 4 связываются с альфа через дисульфидную связь. [18] Натриевые каналы с большей вероятностью будут оставаться открытыми при подпороговом мембранном потенциале при взаимодействии с бета-токсинами, что, в свою очередь, вызывает немедленное ощущение боли. [19]
Роль бета-субъединиц как молекул клеточной адгезии
| Название протеина | Генная ссылка | Собирается с | Профиль выражения | Связанные человеческие каналопатии |
|---|---|---|---|---|
| Na v β1 | SCN1B | Na v 1.1 в Na v 1.7 | Центральные нейроны, периферические нейроны, скелетные мышцы, сердце, глия | эпилепсия (GEFS +), синдром Бругада [30] |
| Na v β2 | SCN2B | Na v 1,1, Na v 1,2, Na v 1,5 до Na v 1,7 | Центральные нейроны, периферические нейроны, сердце, глия | Синдром Бругада [30] |
| Na v β3 | SCN3B | Na v 1,1 до Na v 1,3, Na v 1,5 | центральные нейроны, надпочечники, почки, периферические нейроны | Синдром Бругада [30] |
| Na v β4 | SCN4B | Na v 1.1, Na v 1.2, Na v 1.5 | сердце, скелетные мышцы, центральные и периферические нейроны | никто не известен |
Управляемые лигандами натриевые каналы активируются связыванием лиганда вместо изменения мембранного потенциала.
С другой стороны, управляемые лигандами натриевые каналы создают изменение мембранного потенциала в первую очередь в ответ на связывание с ним лиганда.
Блокираторы
Активаторы
Следующие естественные вещества постоянно активируют (открывают) натриевые каналы:
Модификаторы стробирования
Следующие токсины изменяют закрытие натриевых каналов:
Изменения рН крови и тканей сопровождают физиологические и патофизиологические состояния, такие как физические упражнения, ишемия сердца, ишемический инсульт и прием кокаина. Известно, что эти состояния вызывают симптомы электрических заболеваний у пациентов с мутациями натриевых каналов. Протоны вызывают разнообразные изменения в стробировании натриевых каналов, которые обычно приводят к уменьшению амплитуды переходного натриевого тока и увеличению доли не инактивирующих каналов, по которым проходят постоянные токи. Эти эффекты характерны для болезнетворных мутантов в нейрональных, скелетных мышцах и сердечной ткани и могут сочетаться с мутантами, которые придают большую протонную чувствительность натриевым каналам, что предполагает роль протонов в запуске острых симптомов электрического заболевания. [33]
Молекулярные механизмы протонного блока
Одноканальные данные кардиомиоцитов показали, что протоны могут снижать проводимость отдельных натриевых каналов. [34] Фильтр селективности натриевого канала состоит из одного остатка в каждой из четырех петель пор четырех функциональных доменов. Эти четыре остатка известны как мотив DEKA. [35] Скорость проникновения натрия через натриевые каналы определяется четырьмя карбоксилатными остатками, мотивом EEDD, которые составляют внешнее заряженное кольцо. [35] Протонирование этих карбоксилатов является одним из основных факторов, влияющих на блокировку протонов в натриевых каналах, хотя есть и другие остатки, которые также влияют на чувствительность к pH. [36] Одним из таких остатков является C373 в сердечном натриевом канале, что делает его наиболее чувствительным к pH натриевым каналом среди натриевых каналов, изученных на сегодняшний день. [37]
Модуляция pH стробирования натриевого канала
Так как натриевой канал сердца является наиболее чувствительным к pH натриевым каналом, большая часть известных данных основана на этом канале. Было показано, что снижение внеклеточного pH деполяризует зависимость активации и инактивации от напряжения до более положительных потенциалов. Это указывает на то, что во время действий, снижающих pH крови, таких как упражнения, вероятность активации и деактивации каналов выше, чем положительные мембранные потенциалы, что может привести к потенциальным побочным эффектам. [38] Натриевые каналы, экспрессируемые в волокнах скелетных мышц, превратились в каналы, относительно нечувствительные к pH. Было высказано предположение, что это защитный механизм против потенциальной чрезмерной или недостаточной возбудимости в скелетных мышцах, поскольку уровни pH крови очень чувствительны к изменению во время движения. [39] [40] Недавно было показано, что мутация смешанного синдрома, которая вызывает периодический паралич и миотонию в скелетном натриевом канале, придает этому каналу чувствительность к pH, что делает его закрытие подобным таковому у сердечного подтипа. [41]
Модуляция pH среди изученных на данный момент подтипов
О чем не знал Гальвани: пространственная структура натриевого канала
Автор
Редакторы
Рисунок 1. Описание Гальвани своего опыта: «Я разрезал и препарировал лягушку. и, имея в виду совершенно другое, поместил ее на стол, на котором находилась электрическая машина. при полном разобщении от кондуктора последней и на довольно большом расстоянии от него. Когда один из моих помощников острием скальпеля случайно очень легко коснулся внутренних бедренных нервов этой лягушки, то немедленно все мышцы конечностей начали так сокращаться, что казались впавшими в сильнейшие тонические судороги. Другой же из них, который помогал нам в опытах по электричеству, заметил, как ему казалось, что это удается тогда, когда из кондуктора машины извлекается искра. Удивленный новым явлением, он тотчас же обратил на него мое внимание, хотя я замышлял совсем другое и был поглощен своими мыслями. Тогда я зажегся невероятным усердием и страстным желанием исследовать это явление и вынести на свет то, что было в нем скрытого».
«Электрические сигналы от потенциал-чувствительных натриевых каналов кодируют информацию в мозгу и передают ее в нервной системе, заставляют мышцы сокращаться, а также стимулируют выработку инсулина в поджелудочной железе», — поясняет Каттеролл важность выбранного им для изучения объекта. — «Если вам выполнили спинальную блокаду или дантист сделал вам инъекцию лидокаина, — натриевые каналы в зоне укола временно перестают работать и не сообщают мозгу о том, что происходит что-то не то» [2].
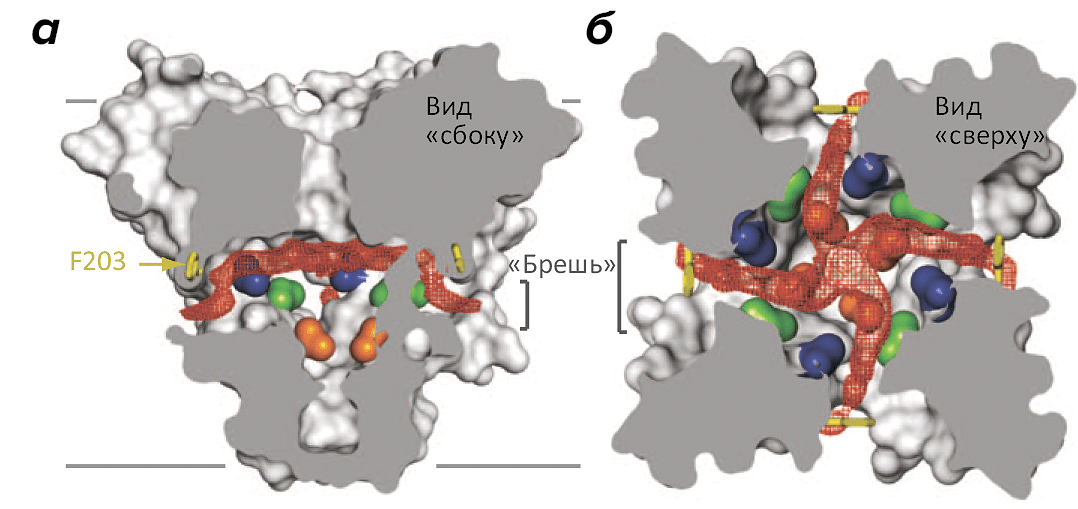
Пóра, образованная четырьмя поровыми доменами каждого из мономеров NavAb (или каждым из четырех доменов натриевых каналов животных), «настроена» на селективное пропускание ионов Na + через мембрану, когда канал открыт; при этом энергетический барьер прохода на другую сторону мембраны снижается настолько, что натрий проходит через канал практически со скоростью свободной диффузии. Открытие поры (образована трансмембранными сегментами S5 и S6) регулируется потенциал-чувствительными доменами (ПЧД, сегменты S1–S4), образующими «лепестки» канала (см. заглавный рисунок). Трансмембранный сегмент S4 этого домена несет большой положительный заряд: каждый третий аминокислотный остаток здесь — аргинин или лизин, выстроенные точно в линию по одной из сторон α- (точнее, 310) спирали S4. Вообще-то, наличие заряженных остатков весьма нетипично для гидрофобной среды мембраны, однако именно такое устройство позволяет ПЧД крайне чувствительно реагировать на изменение потенциала и, «выезжая» из мембраны под действием меняющегося электрического поля, заодно открывать и пору, раздвигая образующие ее α-спирали.
Дело в том, что в настоящее время сымитировать электрический потенциал на мембране в процессе определения пространственной структуры белка нет никакой возможности, потому что мембраноподобное окружение создается в этом случае за счет мицелл или других детергентных сред, где просто нет непрерывной границы, которая могла бы разделять области с разным потенциалом.
Рисунок 2. «Бреши» в боковых поверхностях натриевого канала NavAb. Бактериальный натриевый канал образован четырьмя идентичными мономерами, «сплетенными» между собой наподобие лепестков диафрагмы (поровый домен одного мономера тесно взаимодействует с потенциал-чувствительным доменом соседнего мономера). а — Боковое сечение канала, на котором видны «бреши», открывающие доступ из гидрофобной среды мембраны во внутренний резервуар поры (пустое пространство показано красным контуром). Границы мембраны показаны серыми линиями. б — Сечение в виде «сверху» показывает размер внутреннего резервуара поры NavAb в закрытом состоянии.
«Учитывая такое интересное строение натриевых каналов, открывается широкий простор для дизайна новых лекарственных веществ, действующих на эти каналы, — подытоживает Каттеролл. — Ученые надеются разработать новые лекарства, действующие на натриевые каналы „изнутри“. В частности, очень хотелось бы увидеть новые анестетики без побочных эффектов, а также лекарства, которые помогли бы против эпилепсии и расстройства сердечного ритма, приводящего иногда к внезапной сердечной смерти» [2]. Но это, конечно, не у бактерий — а значит, еще предстоит большая работа по выяснению того, как устроены натриевые каналы у животных и в особенности — у млекопитающих.
Написано с использованием материалов Nature News [9].
Что такое натриевые каналы
• Семейство эпителиальных Nа+-каналов/дегенеринов отличается разнообразием
• Транспорт ионов Na+-через эпителиальные клетки происходит при участии эпителиальных Nа+-каналов и Nа+/К+-АТФазы
• По строению селективный фильтр ENaC близок к селективному фильтру К+-канала
Эпителиальные Nа+-каналы (ENaCs) представляют собой основной тип каналов, по которым в клетки поступают ионы Na+. В отличие от электрических функций потенциал-зависимых каналов, эпителиальные Nа+-каналы обеспечивают потоки ионов Na+ и контролируют транспорт воды через слой клеток. Как и для многих других белков, транспортирующих ионы Na+, функционирование ENaCs зависит от градиента Na+, формирующегося под действием Nа+/К+-АТФазы.
В отличие от других Nа+-каналов, ENaCs менее зависимы от величины потенциала и не подвержены быстрой инактивации, однако им присуща сложная система долговременной гормональной регуляции. Впервые ENaCs были обнаружены в клетках эпителия, однако они также находятся в нейронах и в других клетках. Аминокислотная последовательность белков ENaCs близка к последовательности дегенеринов С. elegans, участвующих в формировании тактильных ощущений.
ENaCs выполняют разнообразные функции, например регулируют кровяное давление, размножение, пищеварительные процессы, а также координацию движений. Например, ENaCs клеток почек и желудочно-кишечного тракта участвуют в поддержании необходимой концентрации К+ и Na+ в плазме крови, а также в моче и фекалиях. Транспорт ионов Na+ через каналы клеток легкого и слюнных желез поддерживает ионный состав легочного сурфактанта и слюны. В настоящем разделе мы рассмотрим роль ENaCs в поглощении и транспорте ионов Na+ через мембрану клеток почечного эпителия.
Основная функция почек состоит в очистке плазмы крови путем фильтрации из нее метаболических шлаков, например мочевины, в мочу. При этом почки участвуют в поддержании гомеостаза за счет регуляции количества жидкости в организме и концентрации растворенных в ней веществ, которые, в свою очередь, влияют на кровяное давление. В ходе сложных процессов фильтрации, реабсорбции и секреции ионы, сахара, аминокислоты и небольшие белки проходят через почечные канальцы, содержащие ультрафильтрат плазмы. Почечные канальцы и трубочки выстланы поляризованными эпителиальными клетками.
Со стороны люмена, заполненного фильтратом, расположена апикальная мембрана, а со стороны полости кровеносного сосуда находится базолатеральная мембрана. Эти специализированные эпителиальные клетки реабсорбируют многие компоненты фильтрата, например соли и воду, перенося их назад, в плазму. Тем самым сохраняется постоянство объема крови и поддерживается необходимая концентрация этих компонентов.
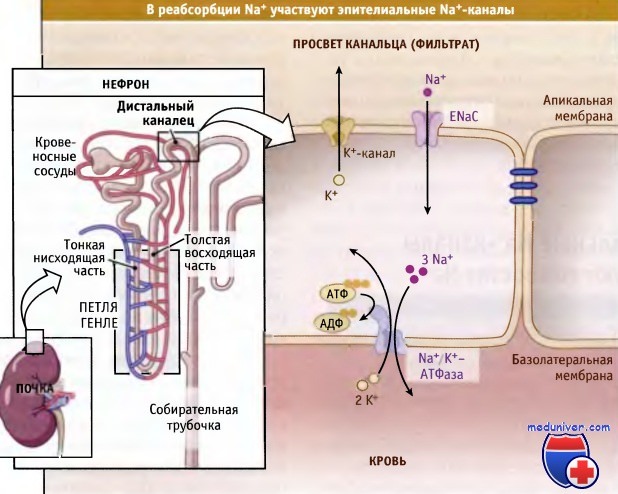
выстилающих почечные канальцы, происходит реабсорбция ионов Na+ из клубочкового фильтрата
ENaCs расположены в апикальной мембране специализированных клеток эпителия дистальных канальцев и собирательных трубочек почки. Они расположены на пути в клетку ионов Na+, поступающих из фильтрата плазмы (предшественника мочи). Ионы Na+ проходят через ENACs в направлении электрохимического градиента (вне клетки их концентрация выше, чем внутри клетки). Транспорт ионов Na+ через ENACs, расположенные на апикальной мембране, сопряжен с их транспортом через базолатеральную мембрану, который происходит с участием Na+/К+-АТФаз и приводит к переносу натрия в кровь через стенки капилляров.
За счет транспорта Na+ из цитозоля Na+/К+-АТФазы создают значительный электрохимический градиент Na+, необходимый для функционирования ENACs. В результате совместного действия ENaCs и Na+/К+-АТФаз ионы натрия транспортируются через эпителиальные клетки из фильтрата плазмы в просвет канальца и в конце концов попадают назад в плазму крови. Na+/К+-АТФаза является электрогенератором: на каждые три атома Na+, выходящие из клетки, она закачивает два атома К+. В результате транспорта Na+ через ENaCs также генерируются электрические заряды: сторона апикальной мембраны, обращенная к просвету канальца, получает больше отрицательных зарядов, чем расположенная со стороны цитоплазмы. За счет этого в просвете создается отрицательное электроокружение, что способствует секреции К+ в фильтрат через апикальные К+-каналы.
Таким образом, транспорт ионов Na+ через клетки эпителия играет важную роль в поддержании состава и объема жидкости, находящейся с апикальной и базолатеральной сторон слоя эпителиальных клеток. За счет функционирования ENaC клеток дистальных канальцев и собирательных трубочек почек реабсорбируется примерно 7% отфильтрованных ионов Na+ и Сl-, а также секретируются различные количества К+.
Процесс реабсорбции Na+ из фильтрата почек, происходящий через ENaCs, регулируется гормонами — альдостероном и вазопрессином. Эти гормоны высвобождаются соответственно из надпочечников и гипофиза при дегидратации или солевой недостаточности и связываются с рецепторами почечных клеток. При этом происходит экспрессия ENaCs на плазматической мембране и увеличивается реабсорбция Na+ из фильтрата, а также его транспорт в плазму крови. За счет гормональной регуляции, при экстремальных условиях концентрация Na+ и баланс жидкости поддерживаются на оптимальном уровне.
ENaC состоит из трех гомологичных субъединиц, а, b и у, образующих мультимерный канальный комплекс. Атомарные структуры ENaCs пока не получены. Однако на основании данных секвенирования белков и реконструкции in vitro предполагается, что каждый комплекс ENaC состоит из четырех субъединиц (двух а, одной b и одной у), и каждая субъединица участвует в образовании центральной поры канала.
Топологически каждая субъединица состоит из двух трансмембранных сегментов с N- и С-терминальными цитоплазматическими доменами. В образовании поры участвует второй трансмембранный сегмент каждой субъединицы тетрамерного канала.
Селективный фильтр ENaC обеспечивает возможность избирательного транспорта ионов Na+. Фильтр содержит сигнатурную последовательность Gly-X-Ser (X — одна из нескольких аминокислот), которая примыкает к второму трансмембранному сегменту со стороны наиболее узкой части поры. Мутация в любом из трех аминокислотных остатков коренным образом меняет проводимость канала, что определяется с помощью электрофизиологических экспериментов. Предполагается, что карбонильные атомы кислорода Gly-X-Ser остатков выстилают селективный фильтр и оказывают стабилизирующее действие на частично дегидратированные ионы определенного диаметра. Такое устройство напоминает селективный фильтр некоторых К+-каналов, однако последние не содержат последовательностей гомологичных ENaC.
Диуретик амилорид блокирует реабсорбцию Na+ с участием ENaC, которая происходит через апикальные мембраны дистальных канальцев и собирательных трубочек. (Таким образом, в электрофизиологи-ческих экспериментах функция ENaC характеризуется как обеспечивающая поток ионов Na+, чувствительный к амилориду.) Амилорид конкурирует с ионами Na+ за связывание с наружной частью ENaC, расположенной вблизи от селективного фильтра. Влияние амилорида на реабсорбцию Na+ в дистальном отделе нефрона является основой клинического использования этого препарата в качестве диуретика и в лечении гипертонии.
Поскольку лечение амилоридом приводит к снижению реабсорбции из фильтрата Na+, эти ионы (и вода) попадают в мочу в повышенных количествах. Снижение уровня реабсорбции Na+ в эпителиальные клетки уменьшает его содержание в крови, что приводит к понижению или к нормализации кровяного давления.
Мутации в генах, кодирующих синтез белков ENaC, вызывают тяжелые расстройства регуляции кровяного давления. При редкой наследственной форме гипертонии, называемой синдромом Лиддла, обнаружены изменения белков ENaC, которые вызывают гиперреактивность каналов и аномально высокий уровень реабсорбции Na+ в дистальной части почечных канальцев. В результате увеличивается объем плазмы крови, возникает артериальная гипертония, и в плазме снижается уровень К+. Мутации, приводящие к развитию синдрома Лиддла, локализованы в генах, кодирующих b- или у-субъединицу канала. Напротив, мутации, ответственные за снижение функционирования ENaC при псевдогипоальдостеронизме типа I, вызывают развитие гипотонии (снижение кровяного давления).
При этом содержание Na+ в плазме крови снижается, а содержание К+ увеличивается. Изучение этих генетических заболеваний в существенной мере способствовало пониманию сложных механизмов влияния альдостерона на функции эпителиальных Na+-каналов, а также выяснению их роли в регуляции кровяного давления и гомеостаза плазмы.
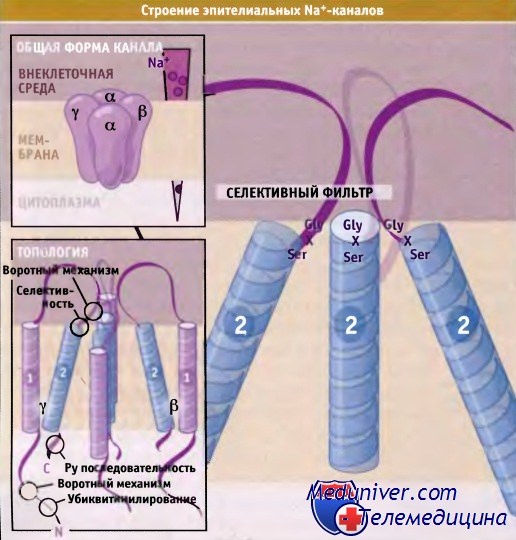
Предполагается, что каждая субъединица состоит из двух трансмембранных сегментов, петли,
расположенной вне мембраны, и содержит N- и С-концевые участки, находящиеся в пределах клетки.
Последовательность Gly-X-Ser каждой субъединицы входит в состав селективного фильтра.
Модификация ENaCs под действием убиквитина является одним из механизмов, регулирующих интернализацию каналов и транспорт ионов Na+.
Еще один механизм включает фосфорилирование внутриклеточных последовательностей, происходящее под действием альдостерона. 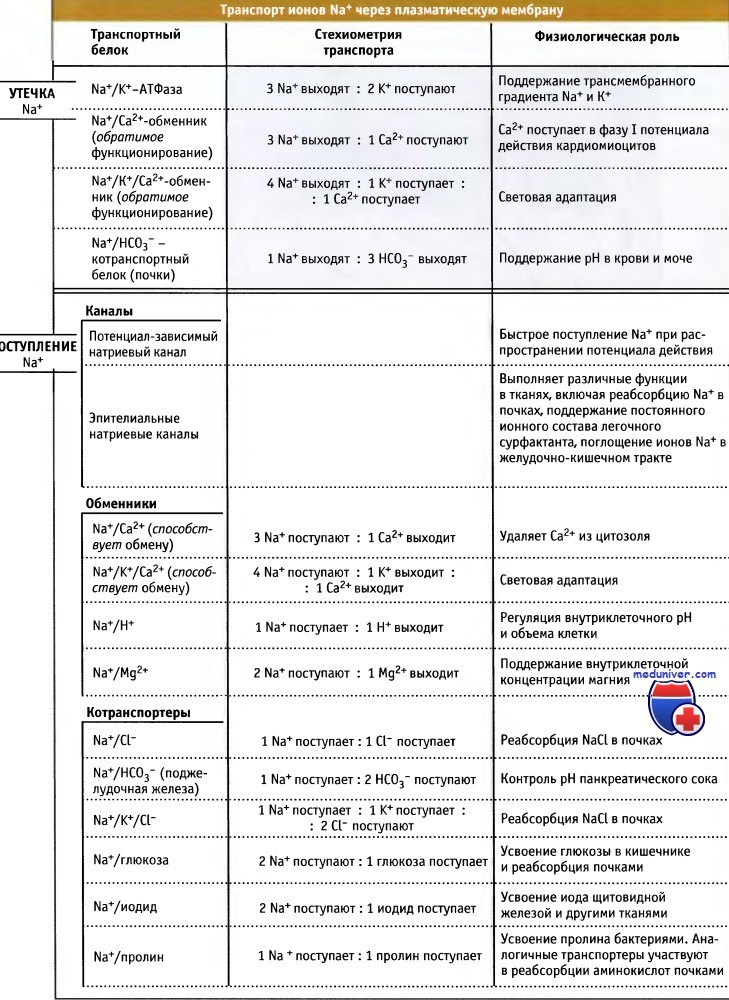
Транспорт ионов в клетку в направлении градиента обеспечивается Na+-каналами.
Некоторые переносчики используют высвобождающуюся при этом энергию для транспорта других метаболитов против градиента концентрации.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте
Натриевый канал
Резюме
Различные типы натриевых каналов
Центральная нервная система
Эти каналы представляют собой гетеротримеры αβ1β2. Только субъединица α важна для электрической активности, но субъединицы β стабилизируют канал.
Канал представлен в трех формах: открытом, закрытом и инактивированном:
Инактивация осуществляется путем введения инактивирующего сегмента, который блокирует устье канала.
Этот канал имеет 8 сайтов связывания лекарств:
Регулирование натриевых каналов сигнальными путями клетки
Регулирование натриевых каналов может осуществляться с помощью посттрансляционных модификаций, таких как протеинкиназы, которые действуют путем фосфорилирования натриевых каналов:
Терапевтические мишени
Натриевые каналы являются терапевтическими мишенями первого выбора. Они являются мишенью для многих антиаритмических, противоэпилептических, а также некоторых местных анестетиков. В некоторых инсектицидах также используются блокаторы натриевых каналов.
Инсектициды
Хризантема
Местные анестетики
В основном лидокаин, который блокирует приток ионов, удерживая каналы в инактивированном состоянии. Таким образом, нервный импульс больше не возможен.
Антиаритмические средства
Они делятся на 3 класса:
Противоэпилептические средства
Стабилизируйте мембраны нейрона, который стал гипервозбудимым, блокируя поток натрия. Эти молекулы преимущественно связываются с неактивной формой натриевых каналов.