Что такое натрий 2 so4
Сульфат натрия
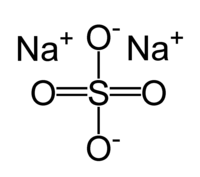
| Сульфат натрия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | сульфат натрия, натрий сернокислый |
| Химическая формула | Na2SO4 |
| Физические свойства | |
| Состояние (ст. усл.) | белые гигроскопичные кристаллы |
| Отн. молек. масса | 142,04 а. е. м. |
| Молярная масса | 142,04 г/моль |
| Плотность | 2,68 г/см³ |
| Термические свойства | |
| Температура плавления | 884 °C |
| Энтальпия образования (ст. усл.) | −1387,9 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 19,2 (20 °C), 42,3 (100 °C) |
| Классификация | |
| Рег. номер CAS | 7757-82-6 |
Содержание
Свойства
Бесцветные кристаллы. Безводный Na2SO4 устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10H2O.
Нахождение в природе
В природе безводный сульфат натрия встречается в виде минерала тенардита. Кристаллогидрат Na2SO4·10H2O образует минерал мирабилит (глауберову соль). Встречаются также двойные соли сульфата натрия с другими сульфатами, например астраханит Na2SO4·MgSO4·4H2O, глауберит Na2SO4·CaSO4. Значительные количества сульфата натрия содержатся в рапе и донных отложениях солёных озёр хлорид-сульфатного типа и заливе Кара-Богаз-Гол. В них при понижении температуры идёт реакция:
В России крупнейшим производителем природного сульфата натрия является компания ОАО «Кучуксульфат» — 600 тыс. тонн в год.
Получение
Промышленный способ получения сульфата натрия — взаимодействие NaCl с H2SO4 в специальных «сульфатных» печах при 500—550 °C; одновременно получается соляная кислота.
В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы природного сырья. Также сульфат натрия получается как отход (не имеющий запаха) в производстве хромпика.
Применение
В мире большое количество сульфата натрия использовались ранее при производстве синтетических моющих средств, однако во многих странах в последние годы произошёл переход на концентрированные (компактные) стиральные порошки, в которых сульфат либо не используется, либо используется в небольших количествах.
Второе по количеству применение сульфата натрия — стекольное производство. Также это вещество используют для получении сульфатной целлюлозы, в текстильной, кожевенной промышленности и в цветной металлургии.
В медицине и ветеринарии ранее широко использовался в качестве солевого слабительного средства, применяется также как компонент в средствах для промывания носа.
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: дешево и легко отфильтровывать.
Зарегистрирован в качестве пищевой добавки E514.
Сульфат натрия: способы получения и химические свойства
Сульфат натрия — соль щелочного металла натрия и серной кислоты. Белый. Плавится и кипит без разложения. Хорошо растворяется в воде (гидролиз не идет).
Относительная молекулярная масса Mr = 142,04; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 884º C; tкип = 1430º C.
Способ получения
1. В результате взаимодействия разбавленной серной кислоты и гидроксида натрия образуется сульфат натрия и вода:
2. При температуре 450–800º C гидросульфат натрия реагирует с хлоридом натрия. В результате реакции образуется сульфат натрия и хлороводородная кислота:
NaHSO4 + NaCl = Na2SO4 + HCl
3. В состоянии кипения в результате реакции между твердым хлоридом натрия и концентрированной серной кислотой происходит образование сульфата натрия и газа хлороводорода:
4. Твердый сульфид натрия и кислород взаимодействуют при температуре выше 400º C с образованием сульфата натрия:
5. При взаимодействии концентрированного раствора пероксида водорода и сульфида натрия образуется сульфат натрия и вода:
Качественная реакция
Химические свойства
1. Сульфат натрия может реагировать с простыми веществами :
1.1. Сульфат натрия реагирует со фтором при температуре 100–150º C. При этом образуются фторид натрия, сульфурилфторид и кислород:
1.2. С водородом сульфат натрия реагирует при температуре 550–600º C, в присутствии катализатора Fe2O3 с образованием сульфида натрия и воды:
2. Сульфат натрия вступает в реакцию со многими сложными веществами :
2.1. Сульфат натрия реагирует с гидроксидом бария с образованием гидроксида натрия и сульфата бария:
2.2. При взаимодействии с концентрированной серной кислотой твердый сульфат натрия образует гидросульфат натрия:
Сульфат натрия, характеристика, свойства и получение, химические реакции
Сульфат натрия, характеристика, свойства и получение, химические реакции.
Сульфат натрия – неорганическое вещество, имеет химическую формулу Na2SO4.
Краткая характеристика сульфата натрия:
Сульфат натрия – неорганическое вещество белого цвета.
Химическая формула сульфата натрия Na2SO4.
Сульфат натрия – неорганическое химическое соединение, соль серной кислоты и натрия.
Сульфат натрия не токсичен, пожаро- и взрывобезопасен. Пылевоздушная смесь сульфата натрия не взрывоопасна.
В земной коре сульфат натрия находится в свободном чистом состоянии, в форме кристаллогидратов, а также в составе двойных солей.
Сульфат натрия в чистом состоянии широко распространён в природе в виде минерала тенардит.
Сульфат натрия образует с водой кристаллогидраты. Их формула Na2SO4·nH2O, где n может быть 1, 7 или 10. Кристаллогидрат Na2SO4·10H2O известен как минерал мирабилит (глауберова соль). Данный десятиводный кристаллогидрат сульфата натрия впервые обнаружен химиком И. Р. Глаубером в составе минеральных вод.
В пищевой промышленности используется 2 типа сульфата натрия:
– добавка Е514(i) – сульфат натрия (Sodium sulphate) с химической формулой Na2SO4;
– добавка Е514(ii) – гидросульфат натрия (Sodium hydrogen sulphate) с химической формулой NaHSO4.
Физические свойства сульфата натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na2SO4 |
| Синонимы и названия иностранном языке | sodium sulfate (англ.) |
натрий сернокислый (рус.)
тенардит (рус.)
Получение сульфата натрия:
Промышленный способ получения сульфата натрия заключается в разработке его месторождений в природе.
В лаборатории сульфат натрия получается в результате следующих химических реакция:
Сульфат Натрия
Химическое название
Сернокислый натрий, натрия сульфат.
Химические свойства
Сульфат Натрия, что это? Данное химическое соединение – это натриевая соль серной кислоты. Формула Сульфат Натрия: Na2SO4. Это бесцветные кристаллы, устойчивые в безводной форме при температуре от 33 градусов Цельсия. При температуре ниже средство образует кристаллогидраты, формула Na2SO4•10H2O. Соленый на вкус кристаллический порошок имеет молярную массу 142 грамма на моль. В естественной среде вещество содержится в минерале тенардит, кристаллогидрат образует соединение мирабилит (глауберова соль). Вещество можно обнаружить в различных формах в рапе, на дне соленых озер.
Химические свойства. Что такое Сульфат Натрия? Формула Сульфат Натрия: Na2SO4. Соединение проявляет свойства средней соли, так как образовано сильной серной к-ой и гидроксидом натрия (слабое основание). Вещество не подвергается гидролизу, так как не имеет в составе «слабого иона». Смесь гидросульфата и Сульфата Натрия может вступить в реакцию с раствором гидроксида натрия.
При электролизе раствора (водного) Натрия Сульфата на катоде выделяется водород, а на аноде кислород (из воды), в результате в катодном пространстве происходит обогащение ионами натрия, в анодном – ионами SO42- и водорода.
Вещество можно получить в промышленных масштабах при взаимодействии хлорида натрия с серной кислотой в специализированных печах, при высокой температуре от 500 до 550 градусов, побочных продуктом реакции является хлороводород. Но в связи с наличием больших запасов природного сырья, этот метод не применяют.
Сульфат Натрия можно использовать на производстве синтетических чистящих и моющих средств; при производстве стекла и целлюлозы; средство используют в текстильной промышленности, цветной металлургии, в кожевельной промышленности. Применяется в виде обезвоживающего средства в хим. лабораториях, в связи с тем, что оно дешево стоит и легко отфильтровывается. В медицине лекарство используют в качестве солевого слабительного и добавляют в состав растворов для промывания носа. Средство используют в виде пищевой добавки под кодом E514.
Фармакологическое действие
Фармакодинамика и фармакокинетика
Вещество постепенно всасывается в кишечнике, повышается осмотическое давление, начинает накапливаться жидкость, происходит раздражение рецепторов кишечной слизистой и усиление перистальтики ЖКТ. Каловые массы разжижаются и быстро эвакуируются. Происходит полное очищение кишечника по всей длине.
Эффект от приема солевого слабительного проявляется в течение 4-6 иногда 14 часов. Вещество также обладает желчегонными свойствами, его можно применять для ликвидации отечности.
Показания к применению
Натрия сульфат используют:
Для чего внутривенно назначают тиосульфат натрия? Для лечения аллергии, невралгии, артрита.
Противопоказания
Побочные действия
Сульфат Натрия, инструкция по применению (Способ и дозировка)
Раствор применяют в соответствии с рекомендациями врача. Назначают от 15 до 30 грамм вещества в р-ре за один прием. Для детей дозировку корректируют. Рекомендуется принимать лекарство на пустой желудок.
Передозировка
Нет данных о передозировке.
Взаимодействие
Диарея, возникающая после приема лек. средства может повлиять на процесс абсорбции других препаратов. Принимать лекарства рекомендуется не позднее, чем за час до начала эвакуации кала.
Условия продажи
Особые указания
Во время лечения рекомендуется пить достаточное количестве воды и другой жидкости.
Следует соблюдать осторожность при назначении препарата пациентам с сердечно-сосудистыми заболеваниями.
При проявлении вздутия живота, метеоризма, сильных болей в области пищеварительной системы рекомендуется прервать лечение и обратится к врачу.
При беременности и лактации
Лекарство, как правило, не назначают во время беременности и при кормлении грудью.
Сульфат натрия (Na2SO4): строение, свойства, применение, производство
Содержание:
Декагидрат сульфата натрия, Na2ЮЗ410H2Или он был обнаружен в 1625 году Глобером в родниковой воде, который назвал его sal mirabilis (чудодейственная соль) из-за ее лечебных свойств.
Сульфат натрия находит широкое применение в текстильной и бумажной промышленности, а также в производстве стекла. Его использование распространяется на тепловые приложения, которые включают подачу тепла окружающей среды и охлаждение ноутбуков.
Состав
Безводная соль
Формула Na2ЮЗ4 сразу указывает на то, что в кристаллах соли ионы Na + Так что4 2- они находятся в соотношении 1: 2; то есть на каждые два катиона Na + есть анион SO4 2- взаимодействуя с ними посредством электростатического притяжения (верхнее изображение).
Конечно, это относится к Na2ЮЗ4 безводный, без молекул воды, скоординированных с натрием внутри кристаллов.
Несмотря на то, что соль является на вид простой, ее описание структурно сложное. Затем2ЮЗ4 Он представляет собой полиморфизм, содержащий до пяти кристаллических фаз: I, II, III, IV и V, температуры перехода которых составляют 180, 200, 228, 235 и 883 ºC соответственно.
Обезвоженная соль
Однако его температура плавления (32,38 ºC) намного ниже, чем у безводной соли (884 ºC), показывает, как молекулы воды и их водородные связи ослабляют более сильные ионные взаимодействия в Na2ЮЗ4.
Свойства
Имена
-Сульфат натрия (ИЮПАК)
-Глауберова соль (декагидрат)
-Чудесная соль (декагидрат)
Молярная масса
142,04 г / моль (безводный)
322,20 г / моль (декагидрат)
Внешность
Белое гигроскопичное кристаллическое твердое вещество
Запах
Вкус
Плотность
2664 г / см 3 (безводный)
1464 г / см 3 (декагидрат)
Обратите внимание, как молекулы воды внутри кристаллов заставляют их расширяться и, следовательно, уменьшать их плотность.
Температура плавления
32,38 ºC (декагидрат)
Точка кипения
Растворимость воды
4,76 г / 100 мл (0 ºC)
13,9 г / 100 мл (20 ° С)
42,7 г / 100 мл (100 ° C)
Все значения растворимости соответствуют безводной соли, которая хорошо растворяется в воде при всех температурах.
Растворимость резко возрастает между 0 ° C и 38,34 ° C, при этом в этом диапазоне температур растворимость увеличивается более чем в 10 раз. Однако начиная с 32,38ºC растворимость не зависит от температуры.
Бывает, что при температуре 32,8 ºC декагидрат сульфата натрия растворяется в собственной кристаллической воде. Таким образом достигается равновесие между декагидратной солью, безводной солью и насыщенным раствором сульфата натрия.
Пока поддерживается трехфазное состояние, температура остается постоянной, что позволяет калибровать температуру термометров.
С другой стороны, растворимость гептагидрированной соли:
19,5 г / 100 мл (0 ºC)
44,0 г / 100 мл (20 ° С)
Обратите внимание, что при 20 ° C гептагидратная соль в три раза более растворима, чем безводная.
Показатель преломления
Стабильность
Стабилен при соблюдении рекомендуемых условий хранения. Несовместим с сильными кислотами и основаниями, алюминием и магнием.
Разложение
При нагревании до разложения выделяет токсичный дым оксида серы и оксида натрия.
pH
5% водный раствор имеет pH 7.
Реактивность
Сульфат натрия превращается в сульфид натрия в результате реакции с углем при повышенных температурах:
Глауберова соль, NaSO4.10H2Или он реагирует с карбонатом калия с образованием карбоната натрия.
Приложения
Бумажная промышленность
Сульфат натрия используется при производстве бумажной массы. Используется при производстве крафт-бумаги, которая не содержит лигнин или подвергается процессу отбеливания, что придает ей большую стойкость. Кроме того, его используют при изготовлении картона.
Моющие средства
Он используется в качестве наполнителя для синтетических бытовых моющих средств, добавляется к моющему средству для снижения поверхностного натяжения.
Очки
Он используется в производстве стекла для уменьшения или устранения мелких пузырьков воздуха в расплавленном стекле. Кроме того, он исключает образование шлака в процессе рафинирования стекломассы.
Текстильная промышленность
Сульфат натрия используется как протрава, так как он облегчает взаимодействие красителей с волокнами тканей. Декагидрат сульфата натрия используется в тесте на окрашивание.
Кроме того, сульфат натрия используется в качестве разбавителя красителя и вспомогательного агента для печати на красителях; такие как прямые красители, серные красители и другие вещества, способствующие окрашиванию хлопка. Он также используется в качестве замедлителя прямого окрашивания шелка.
Лекарство
Декагидрат сульфата натрия используется как слабительное, так как он плохо всасывается в кишечнике и поэтому остается в просвете кишечника, вызывая увеличение объема. Это стимулирует усиление перистальтических сокращений, которые вызывают изгнание кишечного содержимого.
Кроме того, он используется для пополнения дефицита электролитов, присутствующих в изоосмотических растворах.
Осушитель
Сульфат натрия, являясь инертным реагентом, используется для удаления воды из растворов органических соединений.
Сырье
Сульфат натрия используется в качестве сырья для производства многих веществ, в том числе сульфида натрия, карбоната натрия и сульфата аммония.
Получение
Сульфат натрия получают добычей полезных ископаемых и химическими реакциями.
Горная добыча
Есть три руды или минерала, которые эксплуатируются с промышленным выходом: тенардит (Na2ЮЗ4), мирабилит (Na2ЮЗ410H2O) и глаубарит (Na2ЮЗ4·Случай4).
В Испании месторождения тенардита и мирабилита разрабатываются путем подземной разработки галерей и столбов. Между тем, глауберит добывается в открытом грунте с использованием больших плотов, устанавливаемых на месторождение полезных ископаемых.
Земля подготовлена с помощью взрывных работ малой интенсивности для получения пористости, которая позволяет выщелачивать сульфат натрия. Фаза производства происходит при орошении дождеванием пресной водой глауберита, выщелачивание которого распространяется вниз.
Солевой раствор сульфата натрия собирают, оставляя остаток сульфата кальция в качестве наполнителя.
Химическое производство
Сульфат натрия получают при производстве соляной кислоты двумя способами: процессом Мангейма и процессом Хардгривса.
Мангеймский процесс
Его проводят в больших сталеплавильных печах и на стальной реакционной платформе длиной 6 м. Реакция происходит между хлоридом натрия и серной кислотой:
Процесс Hardgreaves
Он включает реакцию хлорида натрия, оксида серы, кислорода и воды:
Другие
Сульфат натрия образуется в реакции нейтрализации гидроксида натрия и серной кислоты:
Сульфат натрия является побочным продуктом производства множества соединений. Его извлекают из жидких отходов, сбрасываемых при производстве вискозы и целлофана. Также в производстве дихромата натрия, фенолов, борной кислоты и карбамата лития.
Риски
Сульфат натрия считается соединением с низкой токсичностью. Однако это может причинить вред человеку, который использует его ненадлежащим образом.
Например, контакт может вызвать раздражение глаз, покраснение и боль. На коже у некоторых людей он может вызывать раздражение и аллергию. Проглатывание может вызвать раздражение пищеварительного тракта с тошнотой, рвотой и диареей. И, наконец, его вдыхание вызывает раздражение дыхательных путей.
Ссылки
В чем разница между Великобританией, Соединенным Королевством и Англией?










