Что такое недостаток кислорода
Признаки недостатка кислорода
Дефицит кислорода в организме может стать серьезной проблемой, поскольку его наличие жизненно необходимо для работы всех систем и органов. Если в крови мало кислорода, страдают все ткани и нарушаются процессы обмена веществ. Человек чувствует усталость и подавленность, вялость и слабость, а при продолжительной гипоксии могут развиваться серьезные заболевания. Рассмотрим основные признаки недостатка кислорода и способы нормализации его уровня в крови.
Признаки недостатка кислорода
Гипоксия бывает разной интенсивности и степени выраженности. По этим признакам ее делят на:
Молниеносная гипоксия возникает в результате механического удушья, аллергического отека и других факторов. Острая гипоксия протекает чуть менее интенсивно и тоже может развиться из-за частичного перекрытия дыхательных путей, например при бронхите с обструкцией. Хроническая же гипоксия может длиться годами, и часто человек даже не догадывается о наличии проблем с концентрацией кислорода в крови. Тем не менее это очень опасное состояние, которое прямо или косвенно влияет на все системы организма и провоцирует многие серьезные заболевания.
Наиболее характерные признаки кислородного голодания у взрослых следующие:
Совсем не обязательно будут присутствовать сразу все симптомы кислородного голодания у взрослых: гипоксия коварна тем, что проявления могут быть смазанными и иметь разную периодичность и интенсивность. Тем не менее наличие нескольких признаков из этого списка — весомый повод обратить внимание на свое здоровье и проверить уровень кислорода в крови. Вполне возможно, что вы страдаете хронической гипоксией.
Причины кислородного голодания
Кислородное голодание легких может развиться по целому ряду причин. Чаще всего с подобными проблемами сталкиваются люди:
Также среди причин кислородного голодания — перенесенные болезни органов дыхания и сердечно-сосудистой системы. Развивается хроническая гипоксия и при аллергических реакциях или астме. Возникнуть подобные проблемы также могут при аденоидах.
Гипоксия плода
Необходимо упомянуть о такой проблеме, как гипоксия плода. Это опасное состояние, при котором плод недополучает кислород. Последствия кислородного голодания для малыша катастрофические: нарушается формирование тканей и органов, возникают повреждения мозга и центральной нервной системы. Опасность гипоксии зависит от ее степени, а также от того срока, на котором находится плод. В любом случае беременным женщинам стоит внимательнее следить за своим самочувствием и признаками гипоксии, чтобы не допустить опасных осложнений.
Последствия кислородного голодания
Недостаточность кислорода в легких ведет к негативным изменениям в работе всех систем. И если не устранить причину гипоксии, то эти изменения станут необратимыми. На фоне длительной нехватки кислорода повышается риск инфарктов и инсультов, развития деменции, появления отеков и судорог. В целом из-за этого патологического состояния ухудшается качество сна, сильно страдает нервная система. Поэтому очень важно вовремя определить кислородную недостаточность, устранить ее причину и начать лечение.
Способы борьбы с гипоксией
Разобравшись с тем, как определить кислородное голодание, можно перейти к тому, как с ним бороться. В этом помогут следующие меры:
Один из самых эффективных и действенных способов того, как лечить кислородное голодание, заключается в использовании кислородных баллончиков. Они наполнены подготовленной для дыхания смесью с высоким содержанием кислорода.
Вдыхать кислород можно прямо из баллончика. Если же нужно получить кислород в большем объеме, стоит использовать специальную маску. Также лечиться можно при помощи употребления кислородных коктейлей. Для их приготовления используется тот же баллончик, которым вспенивают белковую смесь в густую и пышную пену. Съев вкусную пенку, вы насытите организм кислородом в легко усвояемой форме и быстро восполните его недостаток.
Использовать кислородное дыхание для устранения гипоксии можно как курсами, так и по необходимости — все зависит от причины и интенсивности проблемы. Например, чтобы взбодриться, обрести тонус, снять усталость и даже устранить признаки похмелья, достаточно сделать 3-5 вдохов. Для избавления от хронической гипоксии, к примеру, вызванной малоподвижным образом жизни, длительным нахождением в помещениях, работой в тяжелых условиях, стоит пройти курсы кислородного дыхания. Конкретную схему лечения нужно согласовать с врачом.
Кислородные баллоны Prana для борьбы с гипоксией
Кислородные баллончики Prana имеют оптимальный состав: 80 % кислорода и 20 % азота. Они не сушат дыхательные пути и практически сразу же снимают симптомы гипоксии, насыщая кровь кислородом. Наша продукция пользуется спросом как у людей, которым нужен медицинский кислород для лечения или восстановления после респираторных заболеваний, так и у тех, кто проводит профилактику гипоксии, синдрома хронической усталости, подавленности, физической и эмоциональной истощенности. Широкая целевая аудитория позволяет реализовывать кислородные баллончики в аптеках, медицинских центрах, розничных магазинах.
Мы осуществляем поставки продукции до склада по всей России. Действует прогрессивная система скидок, зависящая от объема. Есть возможность заказа с отсрочкой платежа. Вся продукция лицензирована и может продаваться в аптечных сетях и медицинских центрах.
Кислородное голодание
Кислородное голодание может возникнуть как при недостаточном содержании кислорода в окружающей атмосфере, так и при некоторых патологических состояниях.
Гипоксия головного мозга наблюдается при нарушениях мозгового кровообращения, шоковых состояниях, острой сердечно-сосудистой недостаточности, полной поперечной блокаде сердца, отравлении окисью углерода и при асфиксии различного происхождения. Гипоксия головного мозга может возникать как осложнение при операциях на сердце и магистральных сосудах, а также в раннем послеоперационном периоде. При этом развиваются разнообразные неврологические синдромы и психические сдвиги, причем преобладают общемозговые симптомы, диффузное расстройство функций ЦНС.
Патогенез (что происходит?) во время Кислородного голодания:
Микроскопически может наблюдаться отек головного мозга. Ранним признаком гипоксии является нарушение микроциркуляторного русла – стазы, плазматическое пропитывание и некробиотические изменения сосудистых стенок с нарушением их проницаемости, выходом плазмы в перикапиллярное пространство. При тяжелой форме острой гипоксии рано выявляются различной степени поражения нейроцитов вплоть до необратимых. В клетках головного мозга обнаруживают вакуолизацию, хроматолиз, гиперхроматоз, кристаллические включения, пикноз, острое набухание, ишемическое и гомогенизирующее состояние нейронов, клетки-тени. Отмечаются грубые нарушения ультраструктуры ядра, его мембраны, деструкция митохондрий, осмиофилия части нервных клеток.
Выраженность изменений клеток зависит от тяжести гипоксии. В случаях тяжелой гипоксии может происходить углубление патологии клетки после устранения причины, вызвавшей гипоксию; в клетках, не имеющих признаков серьезных повреждений в течение нескольких часов, спустя 1-3 сут и позже можно обнаружить структурные изменения различной тяжести. В дальнейшем такие клетки подвергаются распаду и фагоцитозу, что приводит к образованию очагов размягчения; однако возможно и постепенное восстановление нормальной структуры клеток.
При хронической гипоксии морфологические изменения нервных клеток обычно менее выражены; глиальные клетки ЦНС при хронической гипоксии активизируются и усиленно пролиферируют.
Симптомы Кислородного голодания:
При возникновении острой кислородной недостаточности часто развивается возбуждение нервной системы, сменяющееся торможением и нарастающим угнетением ее функций. Возбуждение сопровождается двигательным беспокойством, эйфорией, учащением сердцебиения и дыхания, бледностью кожных покровов, появлением холодного пота на лице и конечностях. Вслед за более или менее длительным периодом возбуждения (а нередко и без него) развиваются явления угнетения с возникновением потемнения в глазах (после предшествовавшего «мелькания» перед глазами), головокружения, сонливости, общей заторможенности, оглушенности, с постепенным угнетением сознания.
Растормаживание и индукционное усиление деятельности подкорковых образований сопровождаются беспорядочной двигательной активностью, судорожными сокращениями мышц, общими тоническими и клоническими судорогами. Этот период обычно бывает кратковременным. Дальнейшее распространение торможения сопровождается изменением безусловных рефлексов: выпадают сначала кожные рефлексы (брюшные, подошвенные, кремастерные), затем надкостничные (запястно-лучевые, надбровные) и, наконец, сухожильные, которые вначале резко усиливаются, а потом угасают, обычно сначала на верхних, а затем на нижних конечностях. Далее выпадают зрачковые и корнеальные рефлексы. Однако последовательность исчезновения рефлексов не всегда бывает одинаковой; отмечаются случаи длительного сохранения отдельных рефлексов при отсутствии остальных. Двигательные расстройства характеризуются развитием спастического паралича с повышением тонуса мышц, рефлексов, появлением патологических и защитных рефлексов, а затем тонус мышц снижается, рефлексы угасают. При быстром развитии глубокого кислородного голодания уже через несколько десятков секунд происходит потеря сознания, а спустя 1-2 мин развивается кома. Вследствие гипоксии мозга могут развиваться следующие неврологические синдромы.
• Коматозные состояния (в зависимости от распространенности угнетения функций мозга
и уровня регуляции сохранившихся функций):
а) состояние декортикации (подкорковая кома); б) переднестволовая (диэнцефально-мезэнцефальная), или «гиперактивная», кома;
в) заднестволовая, или «вялая», кома; г) терминальная (запредельная) кома.
• Состояния частичного нарушения сознания: а) сопор; б) оглушение; в) сомноленция.
• Синдромы диффузного органического поражения: а) тяжелая постгипоксическая
энцефалопатия (с мнестическими, зрительными, мозжечковыми, стриарными расстройствами);
б) умеренно выраженная постгипоксическая энцефалопатия.
• Астенические состояния (постгипоксическая астения с явлениями гипо- и гиперстении).
Перечисленные синдромы могут быть фазами проявления последствий гипоксии мозга.
В основе наиболее тяжелой степени коматозного состояния (запредельная кома) лежит угнетение функций центральной нервной системы, клинически проявляющееся арефлексией, гипотонией мышц, отсутствием электрической активности мозга («молчание»), расстройствами дыхания. Сохраняются деятельность сердца, автоматическая деятельность других органов за счет периферической вегетативной регуляции.
С частичным восстановлением функций подкорковых узлов связаны особенности подкорковой комы, или состояния декортикации. Клиническая картина ее характеризуется выраженными симптомами орального автоматизма (иногда сосательными и жевательными движениями), усилением деятельности подкорковых рефлекторных уровней – стволовых, спинальных, периферических, вегетативных. Сухожильные рефлексы повышены, кожные – угнетены, вызываются стопные и кистев ые патологические рефлексы. Явления раздражения проявляются хореиформными и атетоидными гиперкинезами, миоклоническими подергиваниями в отдельных мышечных группах. На ЭЭГ определяются диффузные медленные волны.
По мере восстановления сознания у больных возникает состояние оглушения. Более глубокое оглушение определяется как сопор, легкие степени оглушения постепенно сменяются сомноленцией, что соответствует восстановлению функций коры головного мозга. При этом признаки восстановления сочетаются с симптомами выпадения и раздражения. Особенности клиники в большей степени определяются состоянием лимбико-ретикулярного комплекса.
При сопорозных состояниях имеются лишь самые элементарные реакции на внешние раздражения. На ЭЭГ обычно доминируют медленные волны. Оглушение сопровождается затруднением понимания больным сложных фраз, ограничением способности произвольных движений, затруднением запоминания. Больные обычно лежат неподвижно. На фоне оглушения иногда возникают сноподобные (онейроидные) состояния. При сомнолентных состояниях больных можно легко вывести из дремотного состояния, они адекватно отвечают на вопросы, но крайне быстро устают. На фоне состояния оглушения выявляются мнестические, гностические, праксические нарушения, симптомы поражения мозжечка и экстрапирамидной системы, а также другие органические симптомы. Такие нарушения определяются как постгипоксическая энцефалопатия, которая характериз уется преи мущественно выраженными расстройствами сознания, памяти, агнозиями, апраксиями, речевыми нарушениями (в форме афазий, дизартрии или мутизма), мозжечковыми симптомами, стриарными гиперкинезами, диффузными очаговыми органическими симптомами. В дальнейшем при восстановлении функций (иногда далеко не полном) долго сохраняются неврастеноподобные симптомы, характерные для постгипоксической астении. В основе этих состояний лежит ослабление тормозного процесса с развитием раздражительной слабости, повышенной возбудимости, бессонницы, снижением внимания и памяти (гиперстеническая форма) либо ослабление и тормозного, и возбудительного процессов, сопровождающееся вялостью, сонливостью, обшей заторможенностью (гипостеническая форма).
Лечение Кислородного голодания:
Противогипоксические средства весьма перспективны, но пока применяются главным образом в эксперименте. Большого внимания заслуживают попытки создания новых хинонов (на основе ортобензохинона). Защитными свойствами обладают препараты типа гутимина, оксибутирата натрия, а также средства из группы ноотропов.
К каким докторам следует обращаться если у Вас Кислородное голодание:
Кислородная недостаточность: последствия для организма
То, что человеческий организм не в состоянии существовать без кислорода, известно всем. Однако последствия его дефицита часто недооценивают, так как многие из них могут проявляться не сразу. Науке известно, что кислородная недостаточность ведёт к очень серьёзным, а в тяжелых случаях – необратимым патологическим изменениям. Страдать от недостаточного поступления О2 в ткани различных органов и систем могут не только больные, но и практически здоровые люди, находящиеся в неблагоприятных условиях. В подобных случаях особую роль играет использование таких средств как, например, кислородный концентратор, позволяющий увеличить количество этого газа в помещении, получая его из обычного воздуха атмосферы. Если же организм уже пострадал от нехватки кислорода, ему необходимо срочное лечение, которое подбирается в зависимости от причин возникновения дефицита.
Все причины возникновения гипоксии можно разделить на две большие группы:
Соответственно, приобретённые в её результате патологические изменения, а также степень их тяжести также будут различны, в зависимости от причин возникновения и состояния на этот момент самого организма.
Почему кислород необходим человеку, и что происходит при его недостатке?
Кислород является незаменимым элементом в процессе обмена веществ, в ходе которого поступающие в живой организм питательные вещества превращаются в своеобразное «топливо», обеспечивающее работу всех его систем. Это происходит благодаря процессам окисления, при которых О2 вступает в реакцию с самыми разными элементами, образуя новые соединения. В целом количество кислорода в человеческом теле в составе подобных соединений может достигать 2/3 от его общего веса. Такие процессы идут во всех тканях организма, куда О2 доставляется посредством развитой системы кровообращения, охватывающей практически все органы человеческого тела. Кровь же постоянно обогащается им в лёгких, куда он поступает при дыхании. Процессы дыхания и кровообращения идут непрерывно на протяжении всей жизни живого существа. Если прервать любой из них, существо погибнет.
Особенно чувствителен к нехватке кислорода мозг, который при гипоксии гибнет, как правило, первым. Именно поэтому при клинической смерти так важно в кратчайшие сроки возобновить поставку кислорода к этому органу, так как даже при возобновлении работы сердца, мозг, лишенный дыхания дольше определённого срока, претерпевает необратимые изменения, и восстановить его невозможно. Кроме мозга наиболее подвержены патологическим изменениям при нехватке О2 сердце, печень, почки, центральная нервная система.
Последствия гипоксии
Кислородную недостаточность различают также по степени и характеру протекания. Последствия её в каждом случае будут разными. Все их также можно разделить на:
Как уже упоминалось, мгновенная гипоксия приводит к необратимым изменениям и в итоге – к летальному исходу. Такая картина наблюдается при отравлении некоторыми веществами (например, после приёма цианидов). Острая и хроническая кислородная недостаточность может иметь множество самых разнообразных последствий практически для всех органов и систем:
Даже незначительная хроническая кислородная недостаточность крайне негативно влияет на здоровье человека в целом и с течением времени может привести к серьёзным проблемам. Так, здоровый изначально человек, помещённый в условия хронической нехватки кислорода (например, обитатель современного мегаполиса с сильно загрязненной выхлопными газами и промышленными выбросами атмосферой) сталкивается с её последствиями в виде:
Именно поэтому в больших городах сегодня почти обязательным стало кондиционирование воздуха в жилых и общественных помещениях, всё большую популярность приобретают процедуры оксигенотерапии, применение кислородных коктейлей. У современного городского жителя даже со средним достатком есть возможность купить кислородный концентратор для индивидуального использования. Улучшить качество потребляемого воздуха в настоящее время по силам практически любому человеку, однако постановку точного диагноза и назначение медикаментозной терапии в случаях выраженного кислородного голодания должен осуществлять врач.
Гипоксия, негипоксическая гипоксия и иммунитет
Автор
Редактор
Статья на конкурс «био/мол/текст»: За миллионы лет с момента появления кислорода на Земле Природа-матушка наэволюционировала весьма сложный и красивый механизм чувствительности к сниженному содержанию кислорода — гипоксии. Механизм этот регулировал массу разнообразных процессов, и было бы очень жаль (а может быть и лень) упускать возможность сделать его не только кислород-чувствительным. Так появилась так называемая негипоксическая гипоксия или гипоксия без гипоксии, проявления которой ученые в настоящее время находят в самых разнообразных органах и тканях. Не обделена была и иммунная система, для которой функционирование кислород-чувствительных систем является зачастую очень критичным моментом. В статье предпринята попытка осветить некоторые современные аспекты этой области и рассмотреть наиболее интригующие механизмы.
Обратите внимание!
Эта работа опубликована в номинации «лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
«Опять гипоксия! Слышали уже много раз!» — возразит читатель, который, должно быть, уже приготовился услышать томный пересказ глав учебника по патофизиологии про то, что гипоксия бывает экзогенной, респираторной, гемической и много еще какой; возможно, читатель приготовился к рассказам об альпинистах или жизни людей в барокамерах. Позвольте рассказать о другом. О негипоксической гипоксии, например. Как не слышали? Тогда приятного чтения!
История открытия
Рисунок 1. Первооткрыватель HIF, профессор Грегг Семенза.
Как и многие истории, всё началось с пивных баров и, увы, весьма печально. В середине 1960-х годах по США, Бельгии и ряду других стран среди отчаянных любителей пива прокатилась необычная хворь — кардиомиопатия, имеющая по всем характеристикам признаки токсической, обусловленной накоплением неизвестного тяжелого металла. Довольно быстро виновник был найден: им оказался хлорид кобальта (II) — популярный среди ряда крупных пивоварен эффективный пеногаситель. Интересно, что помимо кардиомиопатии у бедняг-пьяниц наблюдался высокий уровень гемоглобина, который коррелировал с высоким уровнем эритропоэтина [1]. Да-да, именно того самого эритропоэтина, на выработку которого так уповают спортсмены, тренируясь в условиях высокогорной гипоксии. Означало ли это, что гипоксию можно заменить приемом двухвалентого пива кобальта? Похоже, что так!
Успокою взволнованных любителей пива и замечу, что чтобы получить кобальтовую кардиомиопатию, потреблять пива необходимо было неимоверно много — около 4 литров в сутки, а всем остальным, возможно, пиво дарило даже некоторое «окрыление» на фоне повышенного гемоглобина. Так или иначе, добавку запретили, разрешив ее ограниченно применять в скотоводстве.
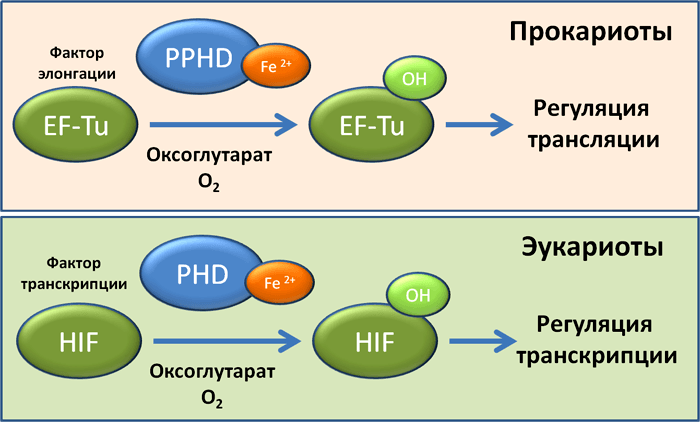
Неизвестно, был ли знаком с этой историей молодой врач-педиатр Грегг Семенза из госпиталя Джонса Хопксинса (рис. 1). Задача постдока Грегга состояла в поиске фактора, регулирующего активность промотора гена эритропоэтина в условиях гипоксии. Постепенно, шаг за шагом, в 1992 году был найден фактор, в 1995 году стало ясно, что фактор представляет собой гетеродимер, в котором одна из субъединиц является кислород-зависимой, в 2001 году был определен механизм, благодаря которому происходит регуляция стабильности кислород-зависимой субъединицы — гидроксилирование с помощью пролилгидроксилаз. Фактору дали красноречивое название — hypoxia-induced factor, или, сокращенно, HIF [2].
Следует отметить, что во всех клеточных экспериментах Семензы гипоксия могла быть заменена добавлением хлорида двухвалентного кобальта. И это уже не просто совпадение, это научный факт.
Некоторые современные сведения о факторах HIF
Далее дорогой читатель будет вынужден простить мне несколько справочный раздел, суммирующий часть современных сведений о факторе HIF.
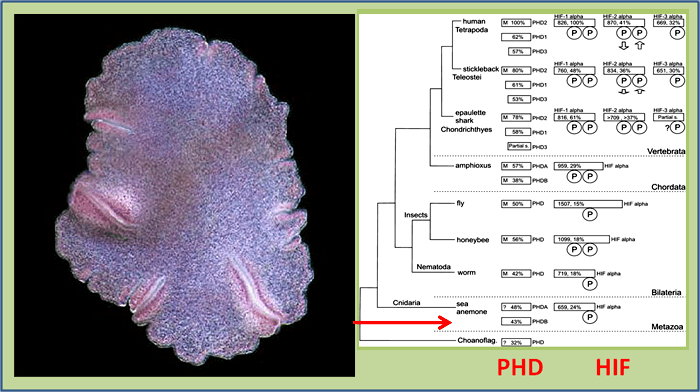
Рисунок 3. Простейшее многоклеточное животное Trichoplax adhaerens (слева) и его положение в истории эволюции PHD-HIF системы у животных (справа). Фото трихоплакса с сайта geneticarchaeology.com.
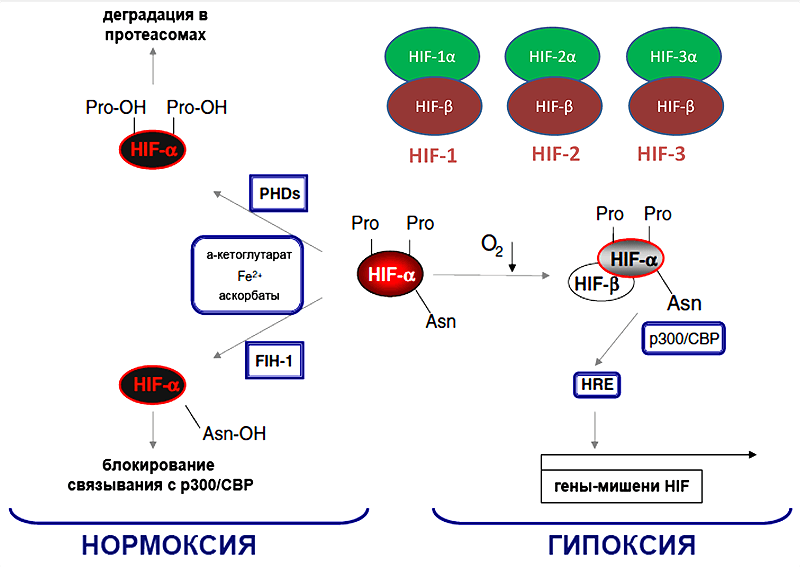
Рисунок 4. Факторы транскрипции HIF 1-3 и классический кислород-зависимый путь регуляции их активности.
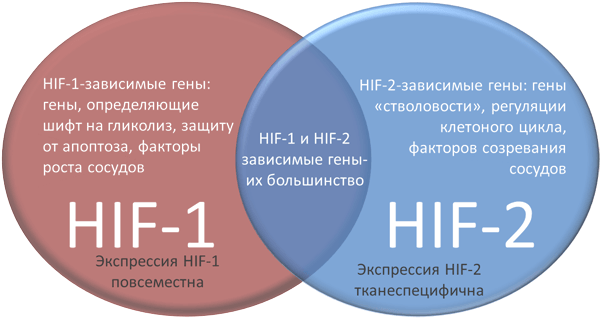
Рисунок 5. Различия HIF-1 и HIF-2.
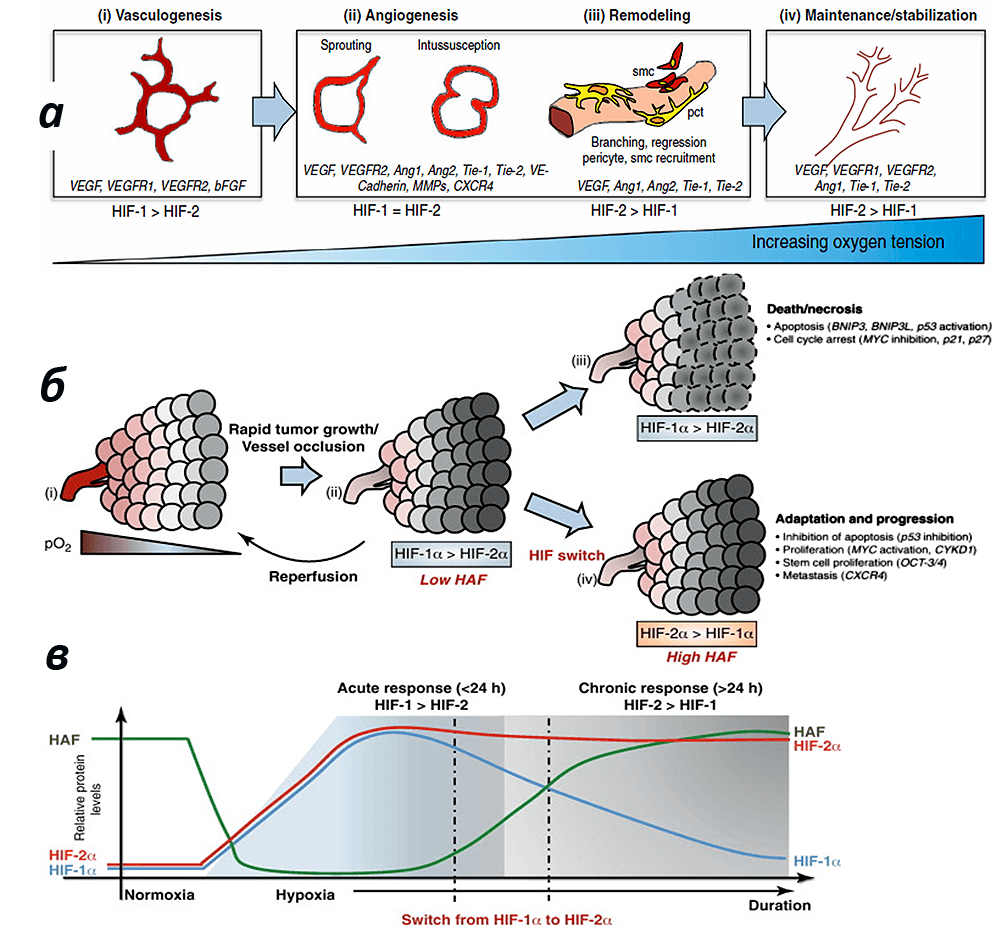
Рисунок 6. Понятие переключения изоформ HIF-1 → HIF-2. По мере роста сосуда (а) опухолевой ткани (б) в след за изменением степени гипоксии от острой до умеренной происходит переключение с HIF-1 изоформы на HIF-2 (в) c экспрессией различного спектра факторов. Рисунок из [12] с изменениями.
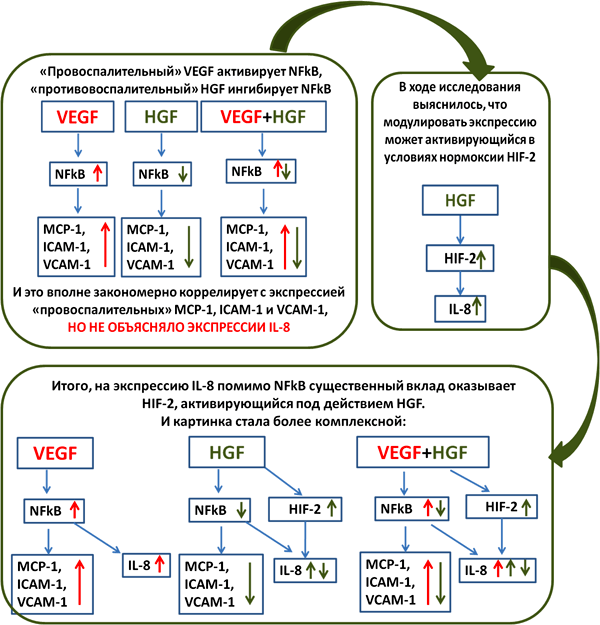
Рисунок 7. Этапы моей дипломной работы, иллюстрирующие то, как негипоксическая активация HIF-2 может вносить свои коррективы в экспрессию хемокинов.
Итак, дорогой читатель, я надеюсь, что вы не сильно утомились ознакомлением первой части рассказа. Скорее перейдем к его иммунологическому разделу!
Роль факторов HIFs в иммунных клетках
И для начала несколько соображений общего характера [16, 17]:
Тема неимоверно интересная и обширная, поэтому я ограничусь парой историй.
История 1: Treg-лимфоциты vs. Th17-лимфоциты
Наивные CD4+ T клетки в зависимости от микроокружения способны дифференцироваться в различные субпопуляции с весьма отличающимися друг от друга функциями: Th1, Th2, Tfh, Th17 и iTreg. Огромное внимание в вопросах аутоиммунных заболеваний и противоопухолевого иммунитета обращено к двум не так давно открытым популяциям T лимфоцитов — Th17 и iTreg [17].
Th17-клетки дифференцируются из наивных CD4+ лимфоцитов под действием TGF-β и IL-6; критичным является активация транскрипционных факторов STAT3 и RORgt. Th17-лимфоциты обладают мощным бактерицидным и фунгицидным действием за счет секреции IL-17 и IL-22. Однако вследствие своего избыточного воспалительного потенциала, Th17 печально известны как участники многих аутоиммунных заболеваний.
Индуцированные iTreg дифференцируются из наивных CD4+ лимфоцитов под действием TGF-β и IL-2; критичным является активация транскрипционного фактора Foxp3. Treg вырабатывают IL-10, TGFβ, экспрессируют на своей поверхности много интересных молекул (типа рецептора к IL-2 СD25, ингибиторного корецептора CTLA-4), за счет которых проявляют свои иммуносупрессивные свойства.
Итого, мы имеем две субпопуляции лимфоцитов, обладающих диаметрально противоположными свойствами, не способными перепрограммироваться друг в друга и происходящие из единого предшественника — наивных CD4+ лимфоцитов. Часто говорят о балансе Treg и Th17, сдвиге баланса либо в иммуносупрессивную, либо в провоспалительную сторону при разных заболеваниях, и подчеркивают первостепенную важность механизмов, определяющих дифференцировку по одному из двух путей. Кратко рассмотрим механизмы и попытаемся понять, в чем соль.
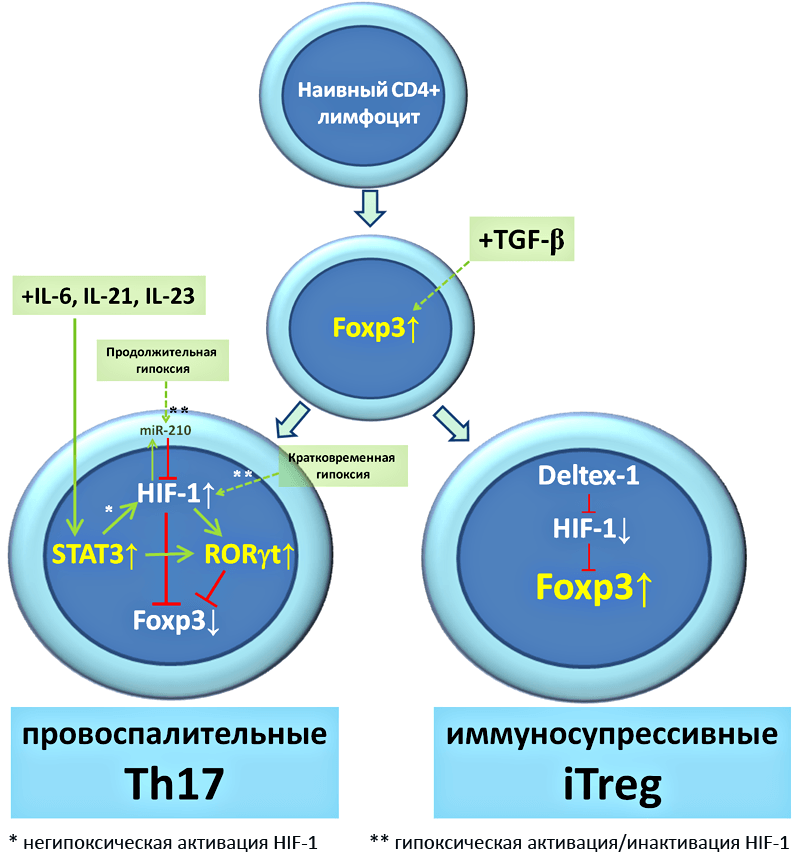
Первое, на что внимательный читатель обратит внимание, это общий для двух субпопуляций индуктор TGFβ. Известно, что сами по себе высокие концентрации TGFβ способны поддерживать активацию Foxp3 и коммитировать образование iTreg. Однако для Th17 также характерна активация Foxp3, которая в обязательном порядке должна быть подавлена. Подавляется она за счет активации фактора STAT3 (под действием IL-6, IL-21 или IL-23), что, в свою очередь, активирует RORgt, который активно подавляет активность Foxp3 и определяет экспрессию Th17-специфичных хемокинов.
Теперь о роли HIF-1. Для немиелоидных клеток показано, что активация STAT3 может приводить к негипоксической активации HIF-1. HIF-1, в свою очередь, способен ингибировать Foxp3, причем, вероятно, за счет механизма активации полиубиквитинирования с последующей протеасомной деградацией, т.е. механизма по которому HIF-1 разрушается сам. Ингибируя Foxp3, HIF-1 способствует дифференцировке CD4+ наивных лимфоцитов в Th17 направлении. Что интересно, данную STAT3-зависимую негипоксическую активацию HIF-1 с последующим ингибированием Foxp3 можно заменить циклами периодической гипоксии-нормоксии, которая приводит к стабилизации и накоплению HIF-1 (рис. 8).
Рисунок 8. Роль HIF-1 в дифференцировке CD4+ наивных лимфоцитов в Treg и Th17.
Любопытно, что то же самое не случается в условиях длительной гипоксии. И виной здесь отрицательная обратная связь — длительная гипоксия повышает экспрессию HIF-зависимой микроРНК-210, которая способна подавлять трансляцию HIF-1α.
Приведенную выше концепцию особой роли HIF-1 в активации фактора RORgt (критичного для Th17) и ингибирования Foxp3 (критичного для Treg) подтверждает недавняя замечательная статья о роли фактора Deltex1 в поддержании стабильности Foxp3 за счет ингибирования его негативного регулятора HIF-1 [18].
Не так давно была открыта новая субпопуляция лимфоцитов — Tr1, обладающих иммуносупрессивными свойствами, при этом не экспрессирующих Foxp3 (маркер регуляторных T-лимфоцитов). Tr1 играют особую роль в супрессии воспаления в нервной системы и кишечнике [19].
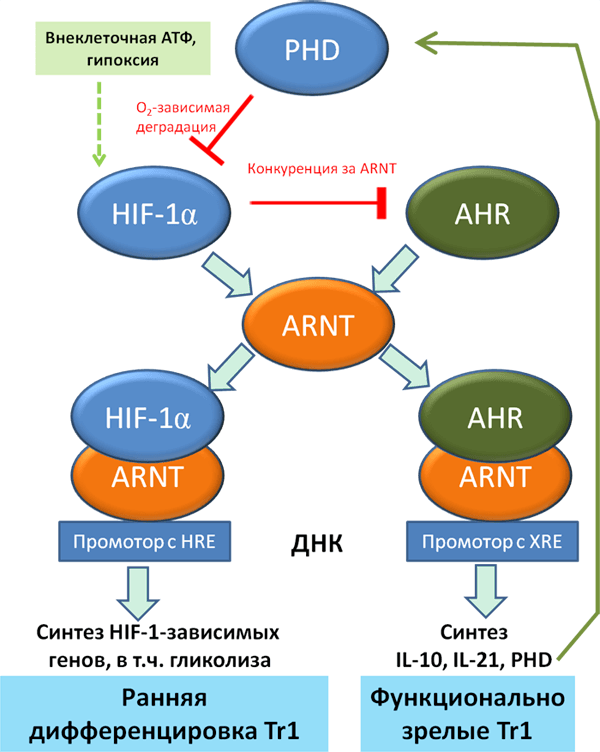
Интересно, что гипоксия и повышенная концентрация внеклеточного АТФ — частые атрибуты воспаления — способны угнетать дифференцировку Tr1-лимфоцитов. Весьма красивым оказался механизм: критичным фактором для дифференцировки в Tr1 лимфоциты является фактор AHR, который при взаимодействии со своим ядерным переносчиком ARNT, переносится в ядро и активирует экспрессию IL-10, IL-21 и прочих факторов, определяющих иммуносупрессивные свойства Tr1-лимфоцитов. Однако ARNT хорошо известен нам как HIF-1β, кислород независимая субъединица, с которой димеризуется HIF-1α. Между HIF-1α и AHR в указанных условиях происходит конкуренция за ARNT и HIF-1α в этой конкуренции побеждает. Впрочем, если условия позволяют, и в схватке побеждает ARNT, ему есть чем ответить — активируясь, он способствует деградации HIF-1α, предположительно за счет повышения экспрессии пролилгидроксилаз PHDs по кислород-зависимому механизму (рис. 9).
Рисунок 9. Роль HIF-1 в дифференцировке иммуносупрессивных Tr1-лимфоцитов.
Хочется отметить также, что угнетающая роль HIF-1α на дифференцировку Tr1-лимфоцитов оказалась не столь уж однозначной — исследователи отмечают то, что активность HIF-1α важна на ранних стадиях дифференцировки, главным образом, за счет своей способности переключать метаболизм на гликолитический тип.
История 2: Врожденный иммунитет и макрофаги
В марте 2015 года в Кембридже прошла любопытнейшая конференция по теме, которая может показаться на первый взгляд очень провокационной — формированию парадигмы памяти врожденного иммунитета. Но не пугайтесь громкого названия; ознакомившись с материалами конференции [20], очень скоро понимаешь, что главной темой было понятие «тренированного» (trained) иммунитета, ставшее уже своего рода классикой.
Суть явления проста: моноцит (или неполяризованный макрофаг М0) после встречи с антигеном через активацию рецепторов врожденного иммунитета (dectin-1, TLRs и др.) способен программироваться метаболически (переходя на гликолитический тип метаболизма) и эпигенетически, становясь таким образом «тренированным» и обеспечивая при повторной инфекции активный ответ. Несложно заметить, что «тренированные» макрофаги есть ни что иное как «классически активируемые» макрофаги, или M1 макрофаги (рис. 10).
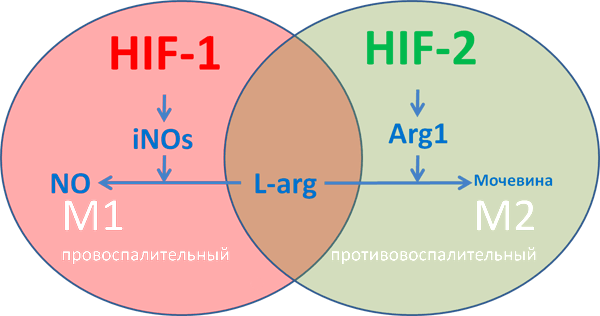
Рисунок 10. М1-макрофаги характеризуются «провоспалительным» фенотипом, преимущественно гликолитическим типом метаболизма, синтезом провоспалительных хемокинов типа IL-1β, экспрессией индуцибельной NO-синтазы iNOs. М2 макрофаги характеризуются «противовоспалительным» фенотипом, преимущественно окислительным фосфорилированием, синтезом аргиназы ARG1 и противовоспалительных хемокинов типа IL-10. У iNOs и ARG1 имеется единый субстрат — L-аргинин, содержание которого в межклеточной среде ограничено.
Про макрофаги, в том числе роль их в противоопухолевом иммунитете, очень здорово и находчиво написано в статье «Одураченные макрофаги, или несколько слов о том, как злокачественные опухоли обманывают иммунитет» [21]. Добавлю — сейчас не вызывает сомнений факт, что важнейшим условием для поляризации в М1-макрофаги является активация HIF-1, а поляризации в M2-макрофаги — активация HIF-2. Активируясь, HIF-1 и HIF-2 контролируют экспрессию соотвествующих генов.
Как в случае с провоспалительными Th17 и супрессорными Treg, между провоспалительными M1 и противоспалительными M2 в тканях наблюдается баланс, нарушение которого может приводить к различным заболеваниям. Так, например, сдвиг в сторону M1-макрофагов в жировой ткани патогенетически связан с развитием метаболического синдрома за счет постоянного хронического воспаления в жировой ткани, ее инсулинрезистентностью, секрецией в кровь провоспалительных хемокинов и адипокинов [22].
Вместо заключения
В настоящее время разработаны/разрабатываются методы селективного ингибирования HIF-1 и HIF-2; селективного ингибирования различных изоформ пролилгидроксилаз PHDs, за счет чего возможно активировать HIF-1 и HIF-2, причем также селективно; можно ингибировать фермент FIH-1и прочие участники пути регуляции кислород-зависимого пути деградации. При желании и достаточной фантазии можно пробовать воздействовать на кислород-независимые пути.
Все это, несомненно, должно найти и, я уверен, найдет применение в практической медицине. Но это потребует крайней обдуманности, многостадийного контроля и досконального изучения. Чем далеко ходить, лучше приведу пример.
Не так давно, в начале-середине 2000-х годов, наблюдался некоторый бум: для многих типов онкологических заболеваний была показана сверхэкспрессия HIF-1α, что вполне соответствовало понятиям об опухолевой биологии: быстрорастущая опухолевая масса в условиях жесткой гипоксии переходит на гликолитический анаэробный тип метаболизма [23], при этом активно секретируя вокруг себя многочисленные факторы роста сосудов, факторы инвазии и т.д. Что делать? Подавим экспрессию HIF-1α и дело в шляпе! Не тут-то было — реальность оказалась сложнее и запутанней.
Так, например, при применении siRNA против HIF-1α на культуре пигментного эпителия сетчатки и эндотелия сосудов, наблюдалось вполне закономерное снижение секреции таких ангиогенных факторов как VEGF, TGF-β (это очень хорошо), но росла секреция IL-8, мощного хемокина с ярко выраженными ангиогенными свойствами (это очень плохо) [24]. Позднее, группой профессора Лобода был раскрыт механизм — дело в том, что HIF-1 подавляет экспрессию IL-8, а HIF-2 — активирует. Подавляя HIF-1 в клетках, исследователи добивались реципрокной активации HIF-2 и экспрессии IL-8 [25]. Такая неоднозначная выходила терапия.
Также нужно быть аккуратными с иммунной системой. Системное подавление HIF-1 при аутоиммунных заболеваниях, возможно, и приведет к снижению популяции Th17 и росту числа Treg, что теоретически способно облегчить течение заболевания, но также способно привести к искусственному комбинированному иммунодефициту за счет дисфункции M1-макрофагов, нейтрофилов, Th1, Th2, Th17 и СD8+ T лимфоцитов.