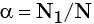Что такое неэлектролиты в химии определение
Электролиты и неэлектролиты
Электролитами называют вещества, водные растворы или расплавы которых проводят электрический ток. Электролитической диссоциацией называют распад электролитов в растворах или расплавах на ионы.
Степенью диссоциации называют отношение числа распавшихся на ионы молекул N1 к общему числу растворенных молекул N. Её обозначают символом α, определяют экспериментально и выражают в долях единицы или в процентах:
Степень диссоциации электролитов в общем случае зависит от природы электролита и растворителя, от концентрации и температуры раствора. С понижением концентрации уменьшается взаимодействие ионов в растворе, приводящее к образованию молекул, и степень диссоциации возрастает. Как правило, степень диссоциации возрастает при повышении температуры.
По степени диссоциации электролиты делят на сильные, слабые и электролиты средней силы.
К сильным электролитам относят вещества, которые практически полностью диссоциируют на ионы: HCl, HNO3, H2SO4, HI, KOH, NaOH и многие растворимые в воде соли (NaCl, K2SO4). Степень диссоциации таких электролитов > 0,3.
К слабым электролитам относят вещества, диссоциирующие на ионы в незначительной степени, например H3BO3, CH3COOH, HCN, H2S. Степень диссоциации таких электролитов
Электролиты и неэлектролиты. Катионы и анионы.
Неэлектролиты – это вещества, неспособные проводить электрический ток ни в расплавах, ни в растворах. Это в основном органические вещества: спирты, кетоны, эфиры, сахара и т.п.
Электролиты – это вещества, расплавы и растворы которых проводят электрический ток. Эти вещества имеют либо ионное строение, либо сильно полярные ковалентные связи. Это, прежде всего, соли, кислоты, щёлочи.
КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ ПО СИЛЕ
ПРОЦЕСС ДИССОЦИАЦИИ ОБРАТИМ
ПРОЦЕСС ДИССОЦИАЦИИ НЕОБРАТИМ
(α → 100 %)
основания (за исключением щелочей); некоторые соли;
практически все органические кислоты (CH3COOH, CH3CH2COOH и другие);
водный раствор аммиака: NH3 ∙ H2O (NH4OH); вода H2O.
средние растворимые соли;
некоторые неорганические кислоты (H2SO4, HNO3, HCl, HBr, HI, HClO4 и т.п.).
Чтобы определить силу кислородсодержащей кислоты, надо: из числа атомов кислорода вычесть число атомов водорода, если это число больше или равно 2, то кислота сильная.
Малорастворимые соли, основания и другие соединения с ионным типом связи являются сильными электролитами. Например, Ca(OH)2
Теория электролитической диссоциации
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
NaCl = Na + + Cl –
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
Электролит, понятие, свойства и виды
Электролит, понятие, свойства и виды.
Электролит – вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или вследствие движения ионов в кристаллических решётках твёрдых электролитов.
Электролит (определение и понятие):
Электролит – вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или вследствие движения ионов в кристаллических решётках твёрдых электролитов.
Электролиты – вещества, расплавы или растворы которых проводят электрический ток.
Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения ионов. Таким образом, движение электрического тока в электролитах обусловлено ионной проводимостью.
Электролиты – это проводники второго рода, вещества, электропроводность которых обусловлена подвижностью положительно или отрицательно заряженных ионов.
К электролитам относятся вещества с ионной или сильнополярной ковалентной связью. К электролитам относятся растворы солей, оснований и кислот, а также вода. Кроме того, некоторые газы ведут себя как электролиты в условиях высокой температуры или низкого давления. Некоторые кристаллы (например, иодид серебра, диоксид циркония) также являются твердыми электролитами.
Соответственно неэлектролиты – вещества, расплавы и водные растворы которых не проводят электрический ток. К неэлектролитам относятся вещества с неполярной и малополярной ковалентной связью. К неэлектролитам относятся газы (двухатомные газы, благородные газы и др.), твердые вещества и органические вещества (спирты, эфиры, бензол, бензин, сахарозу и пр.).
Способность растворов или расплавов электролитов проводить электрический ток объясняется тем, что молекулы электролитов при растворении в воде или других растворителях (например, этаноле, жидком аммиаке, жидком сернистом ангидриде) либо при расплавлении распадаются на электрически положительно и отрицательно заряженные частицы — ионы. Величина заряда иона численно равна валентности атома или группы атомов, образующих ион.
Электролитическая диссоциация (ионизация):
Процесс распада молекул в растворе или расплаве электролита на ионы называется электролитической диссоциацией (или ионизацией). Процесс диссоциации носит обратимый характер. Одновременно с процессами диссоциации в растворах или расплавах электролита протекают и процессы ассоциации ионов в молекулы. При неизменных внешних условиях (температура, концентрация и др.) устанавливается динамическое равновесие между диссоциациями (распадами) и ассоциациями. Это означает, что определенное количество молекул электролита распадается на ионы и такое же количество молекул образуется вновь из ионов. Поэтому в растворах или расплавах электролита всегда диссоциирована определённая доля молекул вещества.
Уравнение диссоциации молекулы электролита (КA) на катион (К + ) и анион (А — ) в общем виде записывается так:
Для конкретных химических соединений уравнение диссоциации выглядит следующим образом:
Число положительных и отрицательных ионов электролита в растворе или расплаве может быть разным, но суммарный заряд катионов всегда равен суммарному заряду анионов, поэтому раствор (или расплав) в целом электрически нейтрален.
Процесс диссоциации электролитов в воде легче всего происходит у соединений с ионной связью (солей, щелочей), которые при растворении образуют гидратированные ионы. Как правило, соединения с ионной связью (соли и щелочи) диссоциируют полностью. Соединения с сильнополярной ковалентной связью диссоциируют частично. При растворении вещества с сильнополярной ковалентной связью (например, хлороводород HCl) диполи воды ориентируются у соответствующих полюсов растворяемой молекулы, поляризую связь и превращая ее в ионную с последующей гидратацией ионов.
Гидратированные ионы устойчивы. Они беспорядочно передвигаются в растворе. Однако под действием электрического тока их движение приобретает направленный характер.
Растворы электролитов обладают способностью проводить электрический ток вследствие движения ионов. Если в раствор или расплав электролита опустить электроды и на электроды подать электрический ток, то под действием электрического тока ионы приобретут направленное движение: положительно заряженные ионы (катионы) будут двигаться к катоду (отрицательному электроду), отрицательно заряженные (анионы) – к аноду (положительному электроду). Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами. Направленное движение катионов и анионов в растворе или расплаве электролита в противоположных направлениях равносильно электрическому току.
Для измерения количественной характеристики электролитической диссоциации введено понятие степень диссоциации.
Степень диссоциации (α) — это отношение числа молекул, диссоциировавших на ионы (n), к общему числу молекул (N) в растворе электролита.
Степень диссоциации выражается в долях или процентах.
Степень диссоциации (т.е. полнота диссоциации) электролита зависит от многих факторов: от природы электролита, температуры, концентрации и вида растворителя. Так, один и тот же электролит при разной температуре или при одинаковой температуре, но в разных растворителях, будет диссоциирован в разной степени. Так, диссоциация происходит только в полярном растворителе, в частности, в воде. Соли и щелочи диссоциируются полностью. С увеличением концентрации ионизация электролита идет труднее, и наоборот. Повышение температуры способствует повышению степени диссоциации, и наоборот.
Мерой способности электролитов распадаться на ионы в растворах может служить константа электролитической диссоциации (константа ионизации) (Кд).
Константа диссоциации (Кд) – это отношение произведения концентрации диссоциированных ионов к концентрации недиссоциированных молекул электролита.
Константу диссоциации можно выразить уравнением:
KA – концентрация недиссоциированного соединения в растворе;
K + – концентрация катионов в растворе;
A − – концентрация анионов в растворе.
Константа диссоциации (Кд) показывает во сколько раз скорость диссоциации больше скорости ассоциации. Чем больше константа диссоциации, тем сильнее электролит. Константа диссоциации зависит от природы электролита и растворителя, температуры и не зависит от концентрации раствора.
Виды электролитов: сильные и слабые электролиты, солевые, кислотные и щелочные электролиты и пр.:
Исходя из степени диссоциации все электролиты делятся на две группы: сильные электролиты и слабые электролиты.
Сильные электролиты – электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как HCl, HBr, HI, HNO3, H2SO4).
Слабые электролиты – электролиты, степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты, такие как HF, HNO2, HCO3, HPO4, почти все органические кислоты), основания p-, d- и f-элементов, почти все малорастворимые в воде соли.
Необходимо иметь в виду, что между двумя указанными группами не существует чёткой границы: одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом – слабого.
В зависимости от вида ионов, на которые распадается вещество при растворении в воде, различаются:
– электролиты без ионов Н + и ОН — (солевые электролиты),
– электролиты с обилием ионов Н + (кислотные электролиты),
– и электролиты с преобладанием ионов ОН — (щелочные электролиты).
В зависимости от вида растворителя электролиты делятся на водные электролиты и неводные электролиты. Отдельно выделяется особый вид электролитов – полиэлектролиты.
В зависимости от того, какое количество ионов образуется при диссоциации молекул электролита, электролиты подразделяются на:
– симметричные электролиты. Симметричные электролиты – электролиты, при диссоциации молекул которого образуется равное число положительных и отрицательных ионов. Симметричными электролитами являются NaCl – 1,1-валентный электролит, HCl – 1,1-валентный электролит и CaSO4 – 2,2-валентный электролит;
– несимметричные электролиты. Несимметричные электролиты – электролиты при диссоциации молекул которого образуется неравное число положительных и отрицательных ионов. Несимметричным электролитом является, например, H2SO4 – 1,2-валентный электролит.
В зависимости от природы электролита выделяются:
– соли. Соли, как электролиты, диссоциируют в водном растворе с образованием иона металла в качестве катиона и иона кислотного остатка в качестве аниона. Соли диссоциируют полностью.
– кислоты. Кислоты, как электролиты, диссоциируют в водном растворе с образованием иона водорода H + в качестве катиона и иона кислотного остатка в качестве аниона. Многоосновные кислоты диссоциируют ступенчато. Причем каждая последующая ступень диссоциирует сложнее, т.к. образующиеся ионы кислотных остатков являются более слабыми электролитами.
Например, фосфорная кислота диссоциирует в три ступени, потому, что имеет 3 атома водорода:
Общая формула диссоциация для фосфорной кислоты будет выглядеть так:
– основания. Основания, как электролиты, диссоциируют в водном растворе с образованием гидроксид-иона ОН — в качестве аниона и иона металла в качестве катиона.
Разница между электролитами и неэлектролитами
Главное отличие
Основное различие между электролитами и неэлектролитами заключается в том, что электролиты — это химические соединения, которые обладают способностью ионизации в растворе, тогда как неэлектролиты — это химические соединения, которые не обладают способностью ионизации в растворе.
Электролиты против неэлектролитов
Электролиты — это соединения, которые полностью ионизируются до ионов в водных растворителях, тогда как неэлектролиты — это соединения, которые не ионизируются до ионов в водных растворителях. В растворе электролита возможно проведение электричества; с другой стороны, в растворе неэлектролита проведение электричества невозможно. Электролиты — это соединения, состоящие из слабых связей, а неэлектролиты — это соединения, состоящие из сильных связей.
Электровалентная связь присутствует в химическом составе электролита; с другой стороны, ковалентная связь присутствует в неэлектролитных химических соединениях. Электролиты обычно включают в электровалентные соединения; с другой стороны, неэлектролиты включают в состав ковалентных соединений. Основание, кислота и соли называются электролитами; С другой стороны, углеводы, жиры, липиды, сахара и органические соединения, называемые неэлектролитами.
Электролиты далее делятся на два типа, в то время как неэлектролиты далее на типы не делятся. Полярные соединения известны как электролиты; с другой стороны, неполярные соединения, известные как неэлектролиты.
Расплавленная форма электролитов ионизируется; с другой стороны, расплавленная форма неэлектролитов неионизируется. Электролиты, используемые для определения стандартного электродного потенциала; с другой стороны, неэлектролиты не используются для определения стандартного электродного потенциала. Электропроводность электролитов увеличивается с повышением температуры в электролитических ячейках; с другой стороны, проводимость электрического тока неэлектролитами не зависит от температуры.
Связь в электролитах очень слабая, поэтому она может легко разорваться при прохождении электрического тока; с другой стороны, связь в электролитах — это очень прочная связь, которая не может разорваться при проведении электрического тока. Электролиты обладают способностью полностью растворяться в растворе; с другой стороны; неэлектролиты не обладают способностью полностью растворяться в растворе.
Электролиты распадаются на положительные и отрицательные ионы; С другой стороны, неэлектролиты не распадаются на положительные и отрицательные ионы. Электролиты не включают чистую воду; напротив, неэлектролиты также включают чистую воду. Электропроводности электролитов увеличиваются по мере увеличения количества менее сильного электролита в растворе электролита, тогда как неэлектролиты не влияют на концентрацию, поскольку они не связаны с проводимостью.
Сравнительная таблица
| Электролиты | Неэлектролиты |
| Электролиты — это соединения, которые полностью ионизируются до ионов в водных растворителях. | Неэлектролиты — это соединения, которые не ионизируются в свои ионы в водных растворителях. |
| Электрическая проводимость | |
| Обладает способностью проводить электрический ток. | Не имеет способности проводить электрический ток. |
| Химическая связь | |
| Электровалентная связь | Ковалентная связь |
| Типы соединений | |
| Это ионные соединения | Это ковалентные соединения |
| Типы | |
| Имеет два типа сильного и слабого электролита. | Не делится на другие типы |
| Чистая вода | |
| Не включать в электролит | Не включать в неэлектролит |
| Прочность сцепления | |
| У него слабая сила | У него более сильная сила |
| Пример | |
| Кислоты, основания и соли | Углеводы, липиды, белки, сахар и т. Д. |
| Расплавленная форма | |
| Эта форма ионизируется | Эта форма не ионизируется |
| Стандартный электродный потенциал | |
| Он используется для определения стандартных значений электродов. | Он не используется при идентификации стандартных значений электродов. |
| Приложения | |
| Используется при производстве щелочных металлов, в электролитических ячейках. | Не используется в производстве металлов и не используется в электролитических ячейках. |
| Температура | |
| Зависит от температуры | Это не зависит от температуры |
| Катионы и анионы | |
| Он распадается на положительные и отрицательные ионы. | Не распадается на положительные и отрицательные ионы. |
Что такое электролиты?
Электролиты — это химические соединения, которые полностью диссоциируют в водном растворе и отдают в раствор положительные и отрицательные ионы. Эти ионы также могут проводить электрический ток в электролитических ячейках. Электропроводность увеличивается с увеличением температуры раствора или ячейки. Это прямо противоположно проводимости электрического тока металлами или проводниками.
Он может образовывать как катионы, так и анионы в твердой или расплавленной форме. Химические соединения-электролиты обычно состоят из очень слабых химических связей, таких как электровалентная связь или ионная связь. Вот почему эти соединения включены в классификацию ионных соединений. Электролиты также называют полярными соединениями.
Но чистая вода или дистиллированная вода не входят в состав электролитов, поскольку они не могут образовывать ионы в растворах. Ионы электролитов обладают способностью перемещаться в электролитической ванне, делая несколько изменений в растворах. Его типы — сильные электролиты и слабые электролиты.
Примерами хороших электролитов являются серная кислота, раствор сульфата меди, гидроксид калия, этанол, раствор сульфата цинка и т. Д.
Приложения
Что такое неэлектролиты?
Неэлектролиты — это химические соединения, которые не полностью диссоциируют в водном растворе, давая раствору положительные и отрицательные ионы. Эти соединения также не обладают способностью проводить электрический ток в электролитических ячейках. На раствор неэлектролита температура не влияет, поскольку они не связаны с электролитической проводимостью или с металлической проводимостью.
Он не образует ионы, такие как катионы или анионы, как в твердой, так и в расплавленной форме. Химические соединения неэлектролитов обычно состоят из очень прочных химических связей, таких как ковалентные связи, которым требуется очень большое количество силы для разрушения соединений на ионы. Вот почему эти соединения включены в классификацию ковалентных соединений.
Неэлектролиты также известны как неполярные соединения. Чистая вода или дистиллированная вода входят в состав неэлектролитов, поскольку они не могут образовывать ионы в растворах. Примерами неэлектролитов являются сахар, липиды, жиры, углеводы, глюкоза, углеродсодержащие соединения и т. Д.
Ключевые отличия
Заключение
Из приведенного выше обсуждения делается вывод, что как электролиты, так и неэлектролиты являются химическими соединениями. Электролиты — это химические соединения, которые диссоциируют в водном растворе с образованием положительных и отрицательных ионов, тогда как неэлектролиты — это химические соединения, которые не диссоциируют в водном растворе с образованием положительных и отрицательных ионов.