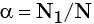Что такое неэлектролиты в химии
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Неэлектролиты и электролиты: характеристика и свойства
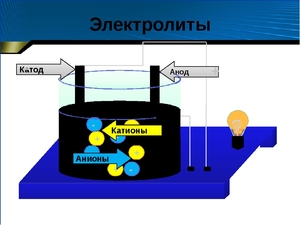
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать с помощью простого прибора. Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
Неэлектролиты
Неэлектролиты находятся в растворе в виде неполярных или малополярных молекул.
Электролиты
Электролиты распадаются в растворе или расплаве на ионы, и именно наличие ионов способствует прохождению электрического тока. Процесс этот — распада на ионы — называют диссоциацией, а теория, описывающая данные процессы — теорией электролитической диссоциации. В растворе распад на ионы происходит по причине разрыва связей вещества, что является результатом взаимодействия с молекулами воды (то есть происходит гидратация электролита).
Ионы (атомы или их группы, обладающие отрицательным или положительным зарядом) под действием электрического тока начинают двигаться по направлению к одному из электродов, что и обуславливает электропроводимость.
Молекула электролита, способная диссоциировать на большее, чем два, количество ионов, будет диссоциировать постадийно. Примером может служить диссоциация многоосновной кислоты.
Подробнее познакомиться с теорией электролитической диссоциацией вы сможете, посмотрев это видео.
Степень диссоциации
Понятие, количественно характеризующее, насколько полно произошёл распад электролита на ионы, называют степенью диссоциации. Этот показатель рассчитывается как отношение количества продиссоциировавших молекул к общему числу молекул вещества в растворе и фактически показывает долю (процент) распавшихся на ионы молекул в общем количестве.
Следующие факторы могут влиять на степень электролитической диссоциации:
Температура
Зависимость от температуры достаточно сложна. Если распад на ионы экзотермический, то повышение температуры степень диссоциации будет уменьшать, а если эндотермический, повышение температуры приведёт к увеличению степени диссоциации. В целом же для каждого электролита есть определённые температурные условия, в которых он в максимальной степени будет распадаться на ионы.
Изменение показателя константы диссоциации (характеризует способность распадаться на ионы) для уксусной кислоты при изменении температуры можно привести в качестве примера:
максимальная ионизация раствора, как видно, наступает при 25 °C, а при температурах выше и ниже этого значения диссоциация происходит в меньшей степени.
Что такое степень диссоциации? Подробный ответ вы найдете в этом видео.
Природа растворителя и электролита
Стадия процесса диссоциации
Если молекула распадается на ионы постадийно, то каждая следующая стадия имеет примерно в 1000−10 000 раз меньший эффект, чем предыдущая.
Экспериментально определить степень диссоциации можно по электропроводности растворов, т. к. она прямо зависит от концентрации движущихся ионов. Истинное значение при этом получить нельзя, такое значение называют кажущимся. Оно меньше истинного, так как при движении к электродам ионы могут сталкиваться, что частично уменьшает их подвижность. При высокой концентрации может возникать притяжение между ионами, обусловленное электростатическими силами, они чаще сталкиваются, теряя свою подвижность, что влияет на показания электропроводности.
Например, в растворе соляной кислоты (1 моль/л) измерения покажут степень распада на ионы равной 0,78 (78%), но фактически раствор не будет содержать 22% недиссоциированных молекул, так как практически все молекулы диссоциированы.
Сильные и слабые проводники
По величине показателя степени диссоциации, выделяют электролиты сильные и слабые. К сильным условно относят вещества, значение степени диссоциации у которых больше 30%, если данный показатель ниже 5%, то к слабым, остальные считаются электролитами средней силы.
Сильные электролиты:
Видео
Из этого видео вы узнаете о свойствах электролитов.
Что такое неэлектролиты в химии
Данный урок посвящен изучению темы «Электролитическая диссоциация». В процессе изучения этой темы Вы поймете суть некоторых удивительных фактов: почему растворы кислот, солей и щелочей проводят электрический ток; почему температура кипения раствора электролита выше по сравнению с раствором неэлектролита.
I. Понятие электролитическая диссоциация
Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются толькопереносчиками зарядов в растворе и существуют в нем независимо от того, проходит черезраствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которою часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
Процесс распада вещества на свободные ионы при его растворении или расплавлении называют электролитической диссоциацией.
Рис. 1. Схема распада на ионы хлорида натрия
Пронаблюдайте за следующим экспериментом: “Изучение электрической проводимости веществ”
II. Сущность процесса электролитической диссоциации. Теория ЭД
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи.
Современные положения теории электролитической диссоциации
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы.
2. В растворах и расплавах электролиты проводят электрический ток.
Электролиты – это вещества, водные растворы или расплавы которых проводят электрический ток
Неэлектролиты – это вещества, водные растворы или расплавы которых не проводят электрический ток
Вещества с ионной химической связью или ковалентной сильнополярной химической связью – кислоты, соли, основания
Вещества с ковалентной неполярной химической связью или ковалентной слабополярной химической связью
В растворах и расплавах образуются ионы
В растворах и расплавах не образуются ионы
III. Процесс растворения электролитов в воде
В целом молекула воды не заряжена. Но внутри молекулы Н2О атомы водорода и кислорода располагаются так, что положительные и отрицательные заряды находятся в противоположных концах молекулы (рис. 1). Поэтому молекула воды представляет собой диполь.
Рис. 1. Молекула воды полярна и представляет собой диполь
Растворение в воде веществ с ионной химической связью
(на примере хлорида натрия – поваренной соли)
Механизм электролитической диссоциации NaCl при растворении поваренной соли в воде (рис. 2) состоит в последовательном отщеплении ионов натрия и хлора полярными молекулами воды. Вслед за переходом ионов Na + и Сl – из кристалла в раствор происходит образование гидратов этих ионов.
Рис. 2. Механизм растворения хлорида натрия в воде:
а – ориентация молекул воды на поверхности кристалла NaCl и отрыв иона Na + ; б – гидратация (окружение молекулами воды) ионов Na + и Сl –
Растворение в воде веществ с ковалентной сильнополярной химической связью
(на примере соляной кислоты)
При растворении в воде соляной кислоты (в молекулах HCl cвязь между атомами ковалентная сильнополярная) происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Образовавшиеся ионы остаются связанными с молекулами воды – гидратированными. Если растворитель неводный, то ионы называют сольватированными (рис.3).
Рис. 3. Диссоциация молекул HCl на ионы в водном растворе
Основные положения:
Электролитическая диссоциация – это процесс распада электролита на ионы при растворении его в воде или расплавлении.
Электролиты – это вещества, которые при растворении в воде или в расплавленном состоянии распадаются на ионы.
Ионы – это атомы или группы атомов, обладающие положительным ( катионы ) или отрицательным ( анионы ) зарядом.
Ионы отличаются от атомов как по строению, так и по свойствам
Пример 1. Сравним свойства молекулярного водорода (состоит из двух нейтральных атомов водорода) со свойствами иона.
Пример 2. Сравним свойства атомарного и молекулярного хлора со свойствами иона.
+17Cl 0 1s 2 2s 2 2p 6 3s 2 3p 5
Атомы хлора имеют незавершённый внешний уровень, поэтому они химически очень активны, принимают электроны и восстанавливаются.
Именно поэтому газообразный хлор ядовит, при вдыхании его наступает отравление организма.
Ионы хлора имеют завершённый внешний уровень, поэтому они химически неактивны, находятся в устойчивом электронном состоянии.
Ионы хлора входят в состав поваренной соли, употребление в пищу которой не вызывает отравления организма.
1. Ионы отличаются от атомов и молекул по строению и свойствам;
2. Общий и характерный признак ионов – наличие электрических зарядов;
3. Растворы и расплавы электролитов проводят электрический ток из-за наличия в них ионов.
IV. Тренажеры
ЦОРы
Памятка (электролиты и неэлектролиты)
Теория электролитической диссоциации
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
NaCl = Na + + Cl –
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
Электролиты и неэлектролиты
Электролитами называют вещества, водные растворы или расплавы которых проводят электрический ток. Электролитической диссоциацией называют распад электролитов в растворах или расплавах на ионы.
Степенью диссоциации называют отношение числа распавшихся на ионы молекул N1 к общему числу растворенных молекул N. Её обозначают символом α, определяют экспериментально и выражают в долях единицы или в процентах:
Степень диссоциации электролитов в общем случае зависит от природы электролита и растворителя, от концентрации и температуры раствора. С понижением концентрации уменьшается взаимодействие ионов в растворе, приводящее к образованию молекул, и степень диссоциации возрастает. Как правило, степень диссоциации возрастает при повышении температуры.
По степени диссоциации электролиты делят на сильные, слабые и электролиты средней силы.
К сильным электролитам относят вещества, которые практически полностью диссоциируют на ионы: HCl, HNO3, H2SO4, HI, KOH, NaOH и многие растворимые в воде соли (NaCl, K2SO4). Степень диссоциации таких электролитов > 0,3.
К слабым электролитам относят вещества, диссоциирующие на ионы в незначительной степени, например H3BO3, CH3COOH, HCN, H2S. Степень диссоциации таких электролитов