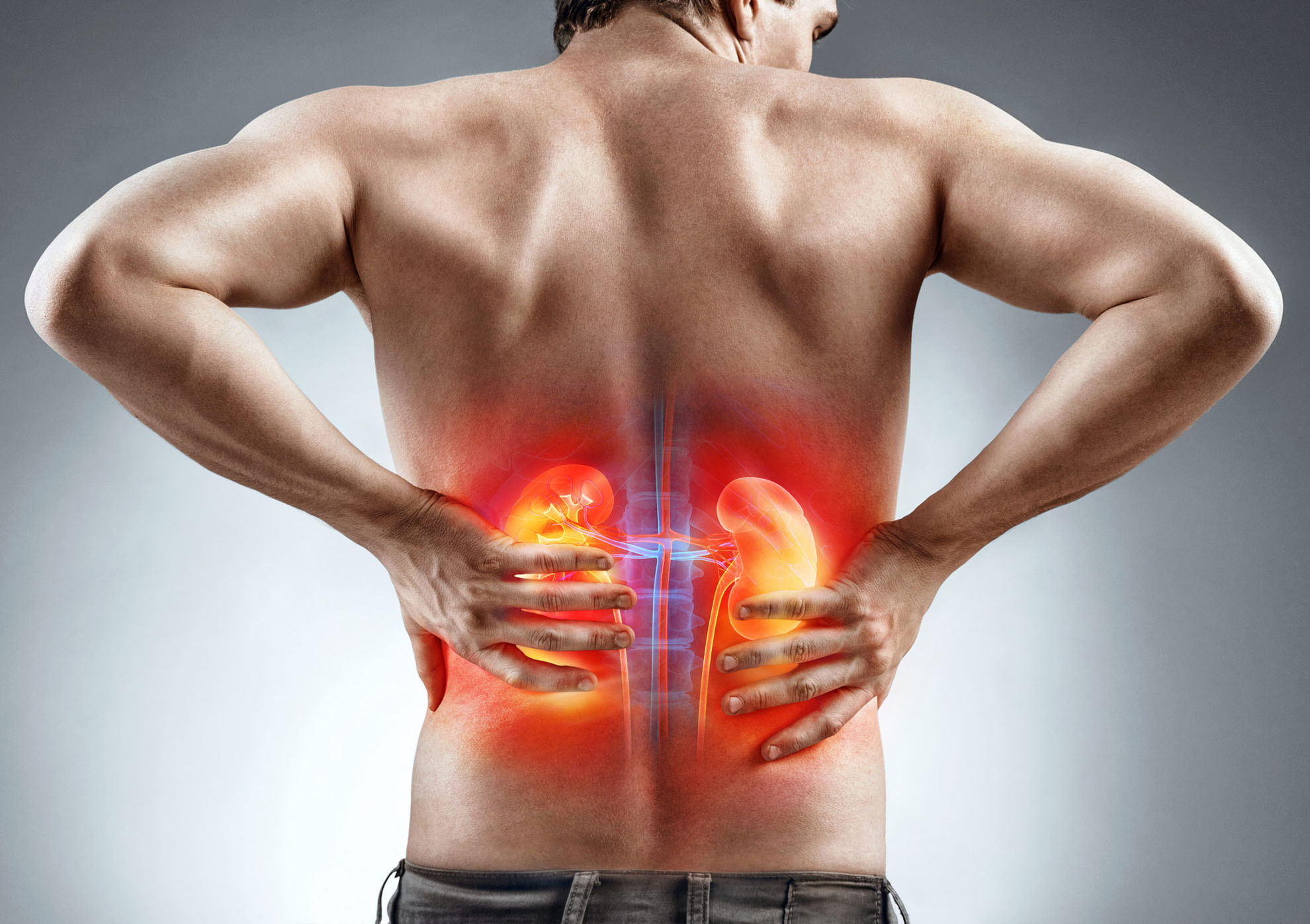
Что такое нефропатия ног
Диабетическая нефропатия

Патогенез диабетической нефропатии
Поскольку нарушения диагностируются и в сосудах почек, и в самом клубочковом аппарате, диабетическую нефропатию подразделяют на:
Хотя негативное воздействие на морфологию и функциональность почек начинается с момента диагностики у больного сахарного диабета, диабетическая нефропатия развивается очень медленно. Биохимические показатели крови и мочи находятся в пределах нормы. Это опасно тем, что к моменту появления явных симптомов и жалоб пациента, специалист диагностирует у больного хроническую почечную недостаточность, которая ведет к инвалидности, регулярному подключению к аппарату искусственной почки или трансплантации донорского органа.
Симптомы диабетической нефропатии
Клинические признаки осложнения проявляются на последних стадиях развития нефропатии, сходны с симптомами почечной недостаточности. Наиболее значимыми из них считаются:
На терминальных стадиях возможно выделения крови с мочой, гипертонические кризы, резкое снижение веса, постоянный зуд.
Для своевременной диагностики и успешного лечения диабетической нефропатии необходимо с момента постановки диагноза «сахарный диабет» обращаться к нефрологу для назначения дополнительных анализов и составления схемы лечения и/или профилактики поражения почек.
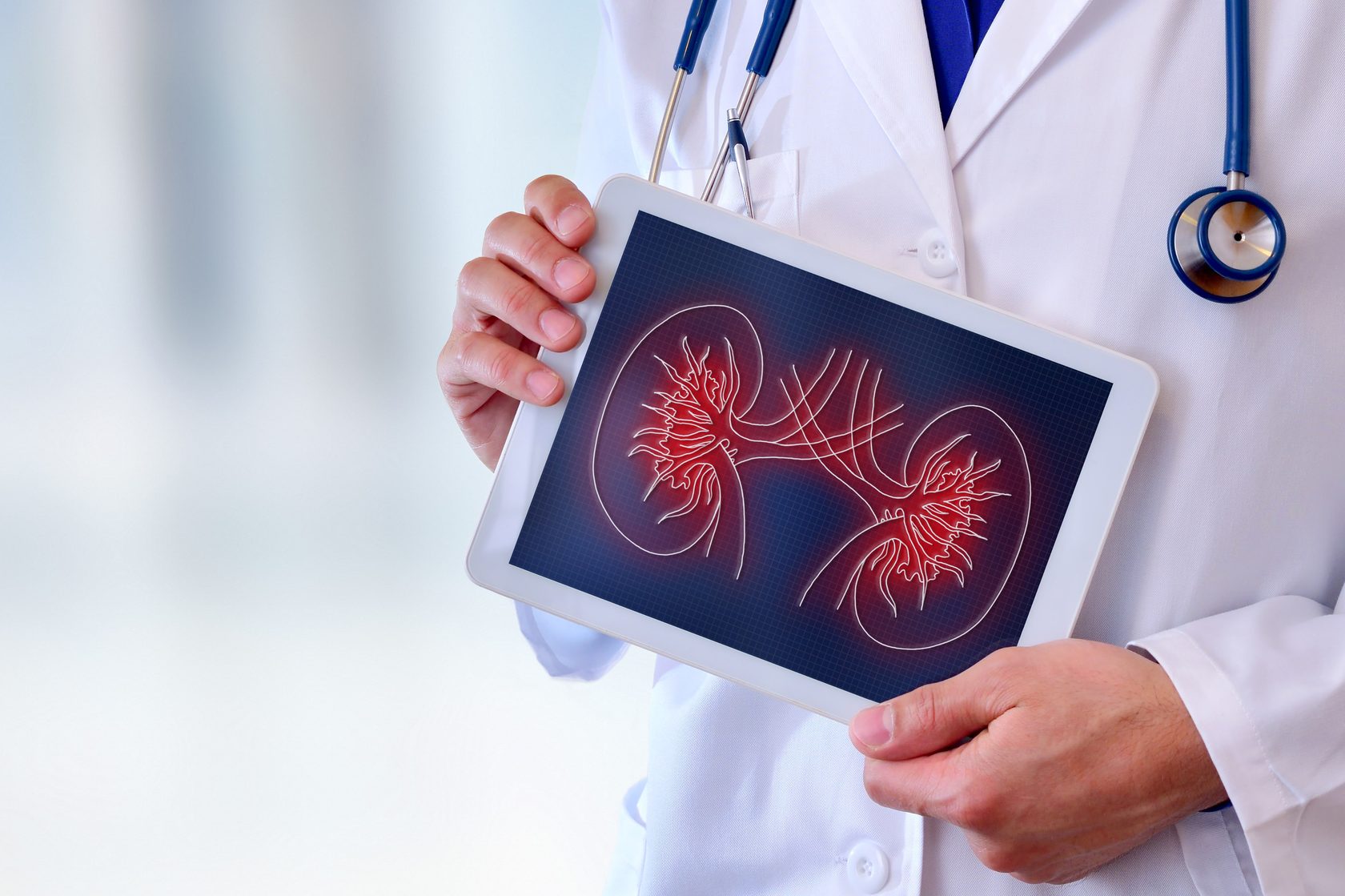
Диагностика и лечение диабетической нефропатии
Диагностика патологии проста, включает в себя общие анализы крови и мочи, биохимические анализы этих же жидкостей. Для исключения пиелонефрита, гломерулонефрита и других патологий, этиология которых может быть не связана с прогрессированием сахарного диабета, назначают УЗИ почек. В особо сложных случаях проводят биопсию тканей почки.
Для постановки диагноза важны такие показатели, как скорость клубочковой фильтрации, наличие или отсутствие протеина в моче, уровень содержания креатинина и мочевины в крови.
Лечение включает в себя как прием препаратов, так и следование бессолевой диете с низким содержанием животных жиров. Основными лекарственными средствами, используемыми для терапии диабетической нефропатии, являются ингибиторы АПФ (эналаприл) или антагонисты ангиотензиновых рецепторов (валсартан). Эти препараты помогают нормализовать уровень артериального давления, предотвратить появление инфарктов и инсультов. Следующими необходимыми лекарственными средствами являются препараты из группы статинов, нормализующие уровень холестерина и триглицеридов в крови.
На последних стадиях заболевания назначают перитонеальный диализ и гемодиализ. Пациента ставят на очередь по трансплантации почек.
Прогноз по лечению заболевания относительно благоприятный, при вовремя начатой терапии возможно отсрочить прогрессирование патологии на долгие годы. Однако полного излечения не происходит за счет прогрессирования основного заболевания.
Как определить, что отеки вызваны болезнью почек
Отеки почечного происхождения появляются при заболеваниях мочевыделительной системы вследствие нарушения механизмов регуляции водно-солевого баланса. Не всегда отечность появляется на ранних стадиях патологий, потому появление такого признака – повод обратиться к врачу. Чем быстрее будет проведена правильная интерпретация состояния, тем легче будет начать лечение.
Патогенез почечных отеков
Механизм образования почечных отеков связан с такими явлениями у пациентов нефрологического профиля:
У больных обнаруживают высокое соотношение натрия и калия в моче, что свидетельствует о нарушении водно-электролитного баланса.
Механизм появления такого симптома все еще до конца не изучен, но характерная картина указывает врачу на пиелонефрит, гломерулонефрит. Фильтрация и выведение мочи нарушаются и при кистах почек, доброкачественных или злокачественных новообразованиях.
Характеристика отеков почечного происхождения
Заболевания мочевыделительной системы сопровождаются отеками с такими особенностями:
Отеки почечного происхождения появляются сначала на лице утром, но при острых патологиях и запущенных хронических стадиях пациент может страдать отечностью круглосуточно.
Как отличить сердечные отеки от почечных
Отечность при заболеваниях сердца и сосудов развивается медленно – от нескольких недель до 2–3 месяцев. Особенно заметна вечером. Вначале появляется на ногах и внизу живота, следующий этап – отек брюшной полости и увеличение печени, заметное при пальпации живота.
Для почечных отеков характерна локализация на лице, с течением болезни распространяются и на конечности. Контур лица обвисает и смещается, кожа становится рыхлой, а под глазами – синюшной. Печень не увеличена. Достоверную дифференциальную диагностику может провести только квалифицированный врач на осмотре.
Сопутствующие симптомы
Диагностика почечных отеков начинается с оценки клинической картины. Для урологического профиля болезни она включает следующие жалобы:
Результаты лабораторной диагностики указывают на протеинурию, изменение содержания натрия и калия. Суточные пробы показывают сниженный объем диуреза.
Методы диагностики
При обнаружении характерных отеков обратитесь за консультацией к урологу – чем раньше будет поставлен диагноз, тем меньше осложнений ждет пациента в будущем. Не занимайтесь самолечением и не откладывайте визит к врачу!
Специалист подберет подходящие методы диагностики:
По результатам исследований уролог назначит медикаментозную терапию в стационаре или амбулаторно. Если есть показания к оперативному вмешательству, врач предложит малоинвазивные методики с коротким периодом реабилитации.
Клиника урологии имени Р. М. Фронштейна Первого Московского Государственного Медицинского Университета имени И.М. Сеченова проводит качественную диагностику при почечных отеках и предлагает самые современные методики лечения в урологии. Прием ведут врачи высшей категории, доктора медицинских наук.
Диабетическая нефропатия. Причины и лечение диабетической нефропатии.
1. Что такое диабетическая нефропатия?
Нефропатия – это заболевание почек. Диабетическая нефропатия означает, что проблемы с почками возникают из-за диабета. В тяжелых случаях диабетическая нефропатия может привести к почечной недостаточности.
В почках находится множество крошечных кровеносных сосудов, которые фильтруют кровь. Высокое содержание сахара в крови из-за диабета может разрушить эти кровеносные сосуды. Со временем почки не справляются со своей работой, а иногда и перестают работать полностью. Тогда возникает почечная недостаточность. Стоит знать, что диабетическая нефропатия развивается далеко не у всех людей с сахарным диабетом. Почему так – точно до сих пор не известно.
Некоторые факторы увеличивают вероятность появления диабетической нефропатии. Если у вас высокое давление, высокий уровень холестерина или вы курите, риск повышается.
2. Симптомы болезни
Диабетическая нефропатия на ранней стадии практически никак не проявляется. Поэтому людям с диабетом очень важно регулярно делать анализ мочи, чтобы обнаружить повреждение почек на ранней стадии. В этом случае есть шанс справиться с проблемой.
3. Диагностика и лечение заболевания
Диабетическая нефропатия на ранней стадии практически никак не проявляется. Поэтому людям с диабетом очень важно регулярно делать анализ мочи, чтобы обнаружить повреждение почек на ранней стадии. В этом случае есть шанс справиться с проблемой.
Диабетическая нефропатия диагностируется с помощью простого анализа мочи, который при наличии болезни покажет присутствие белка альбумина. Обычно моча не содержит белка. Но на ранних стадиях заболевания почек, еще до того, как появятся симптомы, белок можно обнаружить в моче, потому что почки не могут отфильтровать его должным образом. Такая ранняя диагностика и лечение могут предотвратить прогрессирование диабетической нефропатии.
Лечение диабетической нефропатии направлено на снижение давления и предотвращение или замедление повреждения почек. Лекарства, которые назначаются в этих целях – ингибиторы ангиозин-превращающего фермента (ингибиторы АПФ) и блокаторы рецепторов ангиотензина II.
При прогрессировании заболевания почек повышается и артериальное давление. Уровень холестерина и триглицеридов тоже становится слишком высоким. Возможно, для лечения этих осложнений диабетической нефропатии понадобятся специальные препараты.
Есть и другие меры, которые можно предпринять для лечения диабетической нефропатии:
Лучший способ предотвратить повреждение почек при начинающейся диабетической нефропатии – это контролировать уровень сахара в крови и артериальное давление. Все это достигается при регулярном здоровом питании, физических нагрузках, контроля веса и приема лекарств, если их рекомендовал врач. Помимо здорового образа жизни в лечении диабетической нефропатии используются и лекарства. Врач может выписать Вам препараты, которые понижают давление и защищают почки при первых признаках наличия белка в моче.
4. Что если диабетическая нефропатия прогрессирует?
По мере прогрессирования диабетической нефропатии артериальное давление обычно повышается, а значит, нужно больше лекарств, чтобы его контролировать.
Возможно, врач рекомендует вам одно из следующих лекарств или их комбинацию:
При диабетической нефропатии важно избегать лекарств, которые могут повредить почкам (особенно нестероидных противовоспалительных средств). И даже если вы проходите курс лечения, важно контролировать уровень сахара в крови и вести здоровый образ жизни, о правилах которого мы говорили выше.
Заболевания 
Жалобы и симптомы 
Диагностика 
Наши цены 
Мы стараемся оперативно обновлять данные по ценам, но, во избежание недоразумений, просьба уточнять цены в клинике.
Данный прайс-лист не является офертой. Медицинские услуги предоставляются на основании договора.
Что такое нефропатия ног
Диабетическая нефропатия
Диабетическая нефропатия, – одно из типичных осложнений сахарного диабета на поздних стадиях. Основными проявлениями являются нарушения липидно-углеводного обмена и склероз (уплотнение, перерождение рабочей ткани в соединительную) почечных кровеносных сосудов, клубочков, канальцев. Как следствие, развивается почечная недостаточность в той или иной степени. Осложнение относится к числу тяжелых, во многих случаях приводит к инвалидности и существенному сокращению продолжительности жизни (летальность при диабете 1 типа уступает лишь сердечно-сосудистым осложнениям).
Нефропатией страдают до 75% больных сахарным диабетом, независимо от его типа. Как правило, клинически значимая почечная недостаточность отмечается через 15-20 лет от начала основного заболевания. Диабетическая нефропатия чаще диагностируется у мужчин, заболевших диабетом в допубертатный период
Сахарный диабет любого типа характеризуется устойчивым повышением глюкозы в организме. Именно этот фактор выступает главной причиной постепенно прогрессирующей несостоятельности почек: избыток сахара оказывает патогенетическое влияние на сосудистые стенки. Развитию диабетической нефропатии способствует также хроническая артериальная гипертензия.
Медленное и зачастую практически бессимптомное развитие диабетической нефропатии осложняет раннюю диагностику. Во многих случаях диагноз устанавливается уже на терминальной стадии, при симптоматике острой интоксикации. Таким образом, больному сахарным диабетом следует обращать внимание даже на незначительные изменения в самочувствии и внешнем виде:
На более поздних стадиях доминирует симптоматика выраженной почечной недостаточности.
Как правило, диагностика диабетической нефропатии требует применения специфических методов исследования: определение уровня мочевого альбумина, оценка скорости клубочковой фильтрации и пр.
На клинической стадии болезни в моче наблюдается повышенное содержание белка, стойкая артериальная гипертензия, скорость клубочковой фильтрации ежемесячно снижается примерно на 1 мл/мин.
Ключевым моментом является профилактика, т.е. контроль уровня глюкозы в крови и предотвращение постоянной гипергликемии.
Собственно терапия диабетической нефропатии включает несколько этапов. При выявлении микроальбурии к основному лечению диабета добавляют гипотензивные препараты. С появлением лабораторных признаков протеинурии (повышение уровня белка в моче) главной задачей становится поддержание функционального статуса почек на удовлетворительном уровне, предупреждение развития острой почечной недостаточности. С этой целью вводится жесткое ограничение потребляемого с пищей белка, назначается заместительный прием необходимых для организма аминокислот.
При скорости фильтрации в почечных клубочках до 10мл/мин и ниже больному показан гемодиализ (внепочечное аппаратное очищение крови) или трансплантация донорской почки.
Эффективная терапия диабетической нефропатии возможна лишь на стадии микроальбурии. На этапе протеинурии возможно лишь в какой-то степени контролировать и ингибировать (подавлять, замедлять) патологический процесс. Терминальная стадия нефропатии прогностически неблагоприятна и зачастую результирует несовместимым с жизнью состоянием.
Для получения подробной информации и записи на прием обращайтесь к нам по телефону контакт-центра: (495) 925-02-02 (круглосуточно)
Нарушения пуринового обмена и подагрическая нефропатия
Понятие «подагрическая нефропатия» включает различные формы поражения почек, вызванные нарушениями пуринового обмена и другими метаболическими и сосудистыми изменениями, свойственными подагре. Подагрой страдает 1–2% населения, преимущественно мужчины [1]
Понятие «подагрическая нефропатия» включает различные формы поражения почек, вызванные нарушениями пуринового обмена и другими метаболическими и сосудистыми изменениями, свойственными подагре. Подагрой страдает 1–2% населения, преимущественно мужчины [1]. Если ранние бессимптомные нарушения пуринового обмена потенциально обратимы при условии своевременной диагностики и коррекции, то на стадии тофусной подагры с поражением сосудов и органов-мишеней (сердца, мозга, почек) прогноз заболевания неблагоприятен. Поражение почек развивается у 30–50% больных подагрой. При стойком повышении уровня мочевой кислоты крови > 8 мг/дл риск последующего развития хронической почечной недостаточности (ХПН) возрастает в 3–10 раз. У каждого 4-го больного подагрой развивается ХПН [2].
В развитии подагры играют роль как приобретенные, так и наследственные факторы. Особенно велика роль неправильного питания в сочетании с гиподинамией. За последние 20 лет в Европе и США наблюдается многократный рост заболеваемости подагрой параллельно с эпидемией морбидного ожирения, нефролитиаза и инсулиннезависимого сахарного диабета [1, 3]. Особенно часто развивается подагра в странах с высоким потреблением мясных продуктов на душу населения.
Cвойственные подагре метаболический синдром с резистентностью к инсулину, а также гиперфосфатемия способствуют образованию тяжелого атеросклероза почечных и коронарных артерий с развитием ишемической болезни сердца, реноваскулярной гипертонии, присоединению к уратному кальциевого нефролитиаза.
Ведущие патогенетические механизмы подагрической нефропатии связаны с повышением синтеза мочевой кислоты в организме, а также с развитием дисбаланса между процессами канальцевой секреции и реабсорбции уратов. Гиперпродукция мочевой кислоты вызвана дефицитом гипоксантин-гуанинфосфорибозилтрансферазы (ГГФТ). ГГФТ контролируется генами, локализованными в Х-хромосоме. Этим объясняется тот факт, что подагрой заболевают почти исключительно лица мужского пола. Полный дефицит ГГФТ приводит к синдрому Леша–Найхена, характеризующемуся ранним и особенно тяжелым течением подагры. Среди других вариантов ювенильной наследственной подагры — формы, вызванные мутацией канальцевого белка Тамма–Хорсфолла, нуклеарного печеночного фактора — RCAD (renal cyst and diabetes)-синдром (сочетание подагры с кистозной дисплазией почек и инсулиннезависимым сахарным диабетом) [4]. К гиперурикемии приводит также усиленное внутриклеточное разрушение аденозинтрифосфата (АТФ): дефект, свойственный гликогенозу (I, III, V типа), врожденной непереносимости фруктозы, хроническому алкоголизму [1]. В то же время у большинства больных первичной подагрой выявляются нарушения тубулярной функции почек: снижение секреции, усиление различных фаз реабсорбции. Важную роль в патогенезе играет cпособствующий кристаллизации уратов в моче дефект канальцевого ацидогенеза [2]. Дефект проявляется образованием при подагре мочи со стойко кислой реакцией (рН 7 мг/дл), гиперурикозурии (> 1100 мг/сут ), стойко кислой рН мочи, протеинурии (микроальбуминурии), гематурии, кристаллурии. Инструментальная диагностика включает ультразвуковое исследование (идентификация рентгенонегативных уратных конкрементов), а также (в сложных случаях) биопсию пораженного сустава, тофуса. При этом информативно обнаружение внутриклеточных кристаллов мочевой кислоты в синовиальной жидкости и в содержимом тофусов (методом поляризационной микроскопии). Ультразвуковая допплерография проводится при трудноконтролируемой гипертонии у больных подагрой с целью исключения атеросклеротического стеноза почечных артерий.
Вторым этапом диагностики является разграничение подагры и вторичных гиперурикемий. Среди заболеваний, часто сопровождающихся нарушениями пуринового обмена, известны: хроническая свинцовая интоксикация (свинцовая нефропатия), хроническое злоупотребление алкоголем, анальгетическая нефропатия, распространенный псориаз, саркоидоз, бериллиоз, гипотиреоз, миелопролиферативные заболевания, поликистозная болезнь, цистиноз. Гиперурикемия при алкоголизме, как правило, протекает бессимптомно и характеризуется эксцессзависимостью [6]. Следует подчеркнуть неблагоприятное прогностическое значение гиперурикемии при нефропатии беременных [7], при иммуноглобулин А (IgA)-нефропатии [8] и при алкоголизме [6]. Большую опасность представляет синдром лизиса опухоли: острая мочекислая нефропатия, осложняющая химиотерапию онкологических заболеваний. Для хронического тубулоинтерстициального нефрита характерны гипертония, ранняя анемия, остеопороз. Нередок исход в ХПН. Диагностика основывается на обнаружении повышенной концентрации свинца в крови и моче после пробы с комплексонами (ЕДТА — от англ. этилендиаминтетрауксусная кислота) [9]. Индуцированную лекарствами вторичную гиперурикемию также необходимо дифференцировать с первичной подагрой. К лекарственным средствам, вызывающим гиперурикемию, относятся: тиазидные и (в меньшей степени) петлевые диуретики, салицилаты, нестероидные противовоспалительные препараты, никотиновая кислота, этамбутол, циклоспорин, противоопухолевые цитостатики и антибиотики, рибавирин. Особенно важна диагностика ХПН (подагрической «маски» уремии), резко нарушающей почечную элиминацию мочевой кислоты [2].
Течение и прогноз подагрической нефропатии
Подагрическая нефропатия обычно возникает на одном из этапов многолетнего течения хронической «тофусной» подагры с атаками подагрического артрита. В то же время в 30–40% случаев нефропатия является первым проявлением — почечной «маской» — подагры или развивается на фоне атипичного для подагры суставного синдрома (поражение крупных суставов, полиартрит, артралгии).
О далеко зашедшей подагре с риском поражения органов-мишеней свидетельствуют гипертония с нарушением циркадного ритма, формирование метаболического синдрома, микроальбуминурия, значительное повышение липидов (холестерин липопротеинов низкой плотности > 130 мг% ), C-реактивного белка. Cреди ранних признаков поражения органов-мишеней при подагре: стойкая протеинурия, умеренное снижение клубочковой фильтрации (до 60–80 мл/мин), гипертрофия левого желудочка, присоединение сахарного диабета. Для подагрической нефропатии типично латентное или рецидивирующее течение с двусторонними почечными коликами (уратный нефролитиаз), повторными эпизодами обратимой ренальной ОПН (острая мочекислая нефропатия). От клинической манифестации подагрической нефропатии до появления ХПН в среднем проходит 12 лет.
К факторам риска развития ХПН при подагре относятся — стойкая артериальная гипертония, протеинурия > 1 г/л, присоединение хронического пиелонефрита, сахарный диабет, старческий возраст больного подагрой, ювенильные формы подагры, хронический алкоголизм.
Лечение подагрической нефропатии
Лечение острой мочекислой нефропатии проводится в соответствии с принципами лечения ОПН, вызванной острой внутриканальцевой обструкцией. При отсутствии анурии, признаков обструкции мочеточников уратами (постренальной ОПН ) или двустороннего атеросклеротического стеноза почечных артерий (ишемической болезни почек) применяется консервативное лечение. Используется непрерывная интенсивная инфузионная терапия ( 400–600 мл/ч) с применением изотонического раствора хлорида натрия, 4% раствора гидрокарбоната натрия и 5% глюкозы, 10% раствора маннитола (3–5 мл/кг/ч), фуросемида (до 1,5–2 г/сут, дробными дозами). При этом диурез должен поддерживаться на уровне 100–200 мл/ч, а рН мочи достигать значения 6,5, что обеспечивает растворение уратов и выведение мочевой кислоты. Одновременно назначается аллопуринол в дозе 8 мг/кг/сут или уратоксидаза (0,2 мг/кг/сут, внутривенно). При отсутствии эффекта от указанной терапии в течение 60 ч больного переводят на острый гемодиализ. В том случае, если острая мочекислая нефропатия развилась как осложнение химиотерапии опухоли (гемобластоза) в рамках вторичной гиперурикемии — при синдроме лизиса опухоли, cразу показан экстренный гемодиализ (гемодиафильтрация) вместе с аллопуринолом в виду низкой эффективности консервативной инфузионной терапии.
Лечение хронических форм подагрической нефропатии должно быть комплексным и предусматривать решение следующих задач:
Диета должна быть малопуриновой, низкокалорийной и сочетаться с обильным щелочным питьем (2–3 л/сут). Суточная квота белков не должна превышать 1 г/кг, жиров — 1 г/кг. Длительное соблюдение такой диеты снижает уровень мочевой кислоты крови на 10% (урикозурию — на 200–400 мг/сут), способствует нормализации массы тела, липидов и фосфатов крови, а также уменьшению метаболического ацидоза. Целесообразно обогащение диеты цитратом калия или бикарбонатом калия, а также рыбьим жиром. Эйкозапентаеновая кислота — действующее начало рыбьего жира — за счет высокого содержания полиненасыщенных жирных кислот оказывает при подагре нефропротективное и кардиопротективное действие. Ее длительное применение уменьшает объем жировой ткани, протеинурию, инсулинорезистентность, дислипидемию, гипертонию. При подагрической нефропатии в стадии ХПН должна использоваться малобелковая диета (0,6–0,8 г/кг).
Перечислим препараты, влияющие на пуриновый обмен.
К препаратам, контролирующим гипертонию при подагре, относятся:
Аллопуринол (милурит) cнижает продукцию и уровень мочевой кислоты крови, ингибируя фермент кcантиноксидазу. Способствует растворению уратов. Гипоурикемическое действие аллопуринола коррелирует с его нефропротективным эффектом, связанным со снижением протеинурии, продукции ренина, свободных радикалов, а также с замедлением гломерулосклероза и нефроангиосклероза. Показания к применению аллопуринола: бессимптомная гиперурикемия в сочетании с гиперурикозурией > 1100 мг/сут, подагрический хронический тубулоинтерстициальный нефрит, уратный нефролитиаз, профилактика острой мочекислой нефропатии у онкологических больных и ее лечение.
Суточная доза аллопуринола (от 200 до 600 мг/сут) зависит от выраженности гиперурикемии. В виду возможности обострения подагрического артрита целесообразно начинать лечение аллопуринолом в стационаре и в течение 7–10 дней комбинировать препарат с нестероидными противовоспалительными препаратами или колхицином (1,5 мг/сут). В первые недели лечения уратного нефролитиаза аллопуринолом желательно cочетать его с препаратами, повышающими растворимость уратов в моче (магурлит, уралит, бикарбонат калия, диакарб). При хроническом тубуло-интерстициальном нефрите дозу аллопуринола уменьшают по мере снижения клубочковой фильтрации, а при выраженной ХПН (креатинин сыворотки > 500 мкмоль/л) он противопоказан. Аллопуринол усиливает эффект непрямых антикоагулянтов и усугубляет токсическое действие азатиоприна на костный мозг. При обнаружении гиперурикемии (подагры) у реципиента после трансплантации необходимо снижение дозы циклоспорина и салуретиков. При отсутствии эффекта заменяют азатиоприн на микофенолат мофетил и только после этого присоединяют аллопуринол [10].
Урикозурические препараты корригируют гиперурикемию путем увеличения экскреции мочевой кислоты с мочой. Применяются при бессимптомной гиперурикемии, подагрическом хроническом тубулоинтерстициальном нефрите. Противопоказаны при гиперурикозурии, при уратном нефролитиазе, при ХПН. Чаще применяются пробенецид (начальная доза 0,5 г/сут), cульфинпиразон (0,1 г/сут), бензобромарон (0,1 г/сут). Возможна комбинация аллопуринола с бензобромароном или сульфинпиразоном. Урикозурическим эффектом обладает также лозартан и другие блокаторы рецепторов-II.
Цитратные смеси (уралит, магурлит, блемарен) корригируют метаболический ацидоз, повышают рН мочи до 6,5–7 и за счет этого растворяют мелкие уратные конкременты. Показаны при уратном нефролитиазе. Уралит или магурлит принимают до еды 3–4 раза в сутки в суточной дозе 6–10 г. При лечении необходим постоянный контроль за рН мочи, так как ее резкое ощелачивание может привести к кристаллизации фосфатов. Цитратные смеси противопоказаны при ХПН, при активном пиелонефрите, должны с осторожностью применяться при гипертонии (содержат много натрия). Цитратные смеси не эффективны при крупных конкрементах, когда показана дистанционная литотрипсия или пиелолитотомия.
В задачи гипотензивной терапии при подагрической нефропатии входит обеспечение нефропротективного и кардиопротективного эффектов. Не должны использоваться препараты, задерживающие мочевую кислоту (тиазидные диуретики), усугубляющие гиперлипидемию (неселективные β-адреноблокаторы). Препаратами выбора являются ингибиторы АПФ, блокаторы рецепторов А II, антагонисты кальция, селективные β-адреноблокаторы.
Статины (ловастатин, флувастатин, правастатин) применяются у больных подагрой с уровнем холестерина липопротеинов низкой плотности > 130 мг%. Статины III поколения (аторвастатин) обладают независимым гипоурикемическим эффектом [11].
Наиболее эффективна при подагрической нефропатии комбинация ингибиторов АПФ с блокаторами рецепторов A II, статинами и аллопуринолом. При указанном сочетании усиливаются гипоурикемический, антипротеинурический, гиполипидемический и гипотензивный эффекты c восстановлением циркадного ритма АД и замедлением ремоделирования миокарда левого желудочка, снижается риск формирования метаболического синдрома и сахарного диабета, уменьшается концентрации в крови С-реактивного белка. В результате снижается риск развития острого инфаркта миокарда, острых нарушений мозгового кровообращения и исхода в ХПН.
Литература
А. Ю. Николаев, доктор медицинских наук, профессор
Ю. С. Милованов, кандидат медицинских наук, доцент
ММА им. И. М. Cеченова, Москва