Что такое неметаллические окислительные свойства
Неметаллы
Общая характеристика неметаллов
Неметаллы в периодической системе расположены справа от диагонали «бор – астат». Это элементы главных подгрупп III, IV, V, VI, VII, VIII групп. К неметаллам относятся: бор, углерод, кремний, азот, фосфор, мышьяк, кислород, сера, селен, теллур, водород, фтор, хлор, бром, йод, астат, а также благородные газы: гелий, неон, криптон, ксенон, радон.
Среди неметаллов два элемента – водород и гелий – относятся к s-семейству, все остальные принадлежат к р-семейству.
На внешнем электронном слое у атомов неметаллов находится различное число электронов: у атома водорода – один электрон (1s 1 ), у атомов гелия – два электрона (1s 2 ), у атома бора – три электрона (2s 2 2p 1 ). Однако атомы большинства неметаллов, в отличие от атомов металлов, на внешнем электронном слое имеют большое число электронов – от 4 до 8; их электронные конфигурации изменяются от ns 2 np 2 у атомов элементов главной подгруппы IV группы до ns 2 np 6 у атомов инертных газов.
Физические свойства
Элементы – неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях:
Газы: гелий, неон, криптон, ксенон, радон, водород, кислород, азот, фтор, хлор.
Жидкость: бром
Твердые вещества: йод, углерод, кремний, фосфор, и др.
7 элементов-неметаллов образуют простые вещества, существующие в виде двухатомных молекул Э2 (H2, O2, N2, F2, Cl2, Br2, I2).

Кристаллические решетки металлов и твердых веществ-неметаллов отличаются между собой. Атомы металлов образуют плотно упакованную кристаллическую структуру, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электрический ток, не обладают пластичностью.
Химические свойства
Неметаллы как окислители
В этой реакции сера – окислитель, а фосфор – восстановитель, так как ЭО фосфора меньше ЭО серы.
На разной окислительной активности основана способность одних неметаллов вытеснять другие из растворов их солей. Например, бром, как более сильный окислитель, вытесняет йод в свободном виде из раствора йодида калия:
Неметаллы как восстановители
Стоит отметить, что неметаллы (кроме фтора) могут проявлять и восстановительные свойства. При этом электроны атомов неметаллов смещаются к атомам элементов- окислителей. В образующихся соединениях атомы неметаллов имеют положительные степени окисления. Высшая положительная степень окисления неметалла обычно равна номеру группы.
— взаимодействие с кислотами-окислителями:
— взаимодействие с солями-окислителями:
Наиболее сильные восстановительные свойства имеют неметаллы углерод и водород:
Таким образом, практически все неметаллы могут выступать как в роли окислителей, так и в роли восстановителей. Это зависит от того, с каким веществом взаимодействует неметалл.
Реакции самоокисления – самовосстановления
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления – самовосстановления (диспропорционирования). Например:
Скачать:
Скачать бесплатно реферат на тему: «Неметаллы» Неметаллы.docx (403 Загрузки)
Скачать рефераты по другим темам можно здесь
Неметаллы. Окислительно – восстановительные свойства типичных неметаллов
Неметаллы. Окислительно – восстановительные свойства типичных неметаллов.
Спасибо всем, кто принял участие в создании сетевого проекта. Сегодня доступ к нему закрываю. Если есть желание, можете успеть получить пятерки.
Сегодня на уроке нам потребуется рабочая тетрадь, учебник, письменные принадлежности.
На уроке вы познакомитес ь со свойствами неметаллов.
Вспомните строение не металлов и его взаимосвязь со свойствами.
На уроке нам понадобятся тетрадь рабочая и учебник.
ШАГ 1. Посмотрите фильм о положении неметаллов в периодической системе и строении.
Шаг 2. Запишите в тетради число, тему урока.
Шаг 3. Перепишите схемы превращений свойств, характерных для неметаллов. Для пяти из них (по одному уравнению из каждого свойства) уравняйте с помощью электронного баланса, Указывайте окислитель и восстановитель. Данная работа будет являться зачетом по ОВР. Должники по зачету присылают работу на проверку: это Киселева Екатерина и Назарова Полина.
Фото работ прислать СЕГОДНЯ до 15.00 на почту: simba20026@gmail.com
У ВСЕХ ОСТАЛЬНЫХ ДОЛЖЕН БЫТЬ КОНСПЕКТ.
Химические свойства неметаллов
Неметаллы взаимодействуют с: неметаллами, металлами, сложными веществами.
Неметаллы реагируют с металлами:
реагируют с кислотами окислителями (H 2 SO 4(конц.) и HNO 3 )
неМе + H 2 SO 4(конц.) = к-та(maxc.o.) + SO 2 + H 2 O
C + H 2 SO 4(конц.) = CO 2 +SO 2 +H 2 O
P + H 2 SO 4(конц.) = H 3 PO 4 + SO 2 + H 2 O
S + H 2 SO 4(конц.) = SO 2 +H 2 O
— HNO 3 окисляет неМе до соответствующих кислот
— у HNO 3 (конц.) азот восстанавливается до NO 2
S+HNO 3 (к) = H 2 SO 4 +NO 2 + H 2 O
P + HNO 3 = H 3 PO 4 + NO 2 + H 2 O
— уHNO 3 (разб.) азотвосстанавливаетсядоNO
3Si + HNO 3 + HF → H 2 [SiF 6 ] + NO + H 2 O
. для углерода и водорода как восстановителей характерно взаимодействие с оксидами Ме и неМе;
галогены (кроме фтора) и сера при взаимодействии со щелочами
S + KOH = K 2 S + K 2 SO 3 + H 2 O
Cl 2 + NaOH = NaClO + NaCl + H 2 O (на холоду)
Cl 2 + NaOH = NaClO 3 + NaCl +H 2 O (при нагревании)
хлор и бром при взаимодействии с водой
Cl 2 + H 2 O = HClO + HCl
Шаг 4. Всем учащимся Изучить параграф 30. Решу ЕГЭ, химия, задание 8, 3 номера (уравнения писать).
Должники по ЭЛЕКТРОЛИЗУ: Горшкова В., Киселев М., Минуллина К., Слепцова К., Степанов В. пишут уравнения электролиза из РЕШУ ЕГЭ, вопрос 22, № 6-10. Присылают мне на почту.
Для сдающих химию дополнительно: Вариант 2 досрочный ЕГЭ 2020
Окислительные свойства неметаллов
— взаимодействие с металлами:
2Na + S = Na2S
— взаимодействие с водородом (образуются летучие водородные соединения):
H2 + Cl2 = 2HCl
— любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение электроотрицательности:
2P + 3Cl2 = 2PCl3
— взаимодействие со сложными веществами:
CH4 + 2O2 = CO2 + 2H2O
Восстановительные свойства
— взаимодействие с кислородом (исключение – фтор):
4P + 5O2 = 2P2O5
— взаимодействие со сложными веществами-окислителями:
S + 6HNO3 = H2SO4 + 6NO2? + 2H2O.
При взаимодействии с неметаллами концентрированная серная кислота восстанавливается до SO2.
Реакция диспропорционирования
Характерна для активных неметаллов. Протекает в щелочной среде:
3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O.
Общая характеристика. Из всех известных в настоящее время элементов около 80% относятся к металлам: s-элементы I и II групп, все d- и f- элементы и ряд p-элементов главных подгрупп периодической системы. Наиболее типичные металлы расположены в начале периодов (кроме первого). Главной особенностью элементов-металлов является наличие у них на внешних энергетических уровнях небольшого числа электронов.(1,2,3).
В расплавленном состоянии металлы могут распределяться друг в друге, образуя сплавы. Большинство расплавленных металлов могут смешиваться друг с другом в неограниченных количествах. При смешивании расплавленных металлов происходит либо простое растворение расплавов одного металла в другом, либо металлы вступают в химическое соединение. Чаше всего сплавы представляют собой смеси свободных металлов с их химическими соединениями. В состав сплавов могут входить также и неметаллы (чугун – сплав железа с углеродом). Свойства металлов существенно отличаются от свойств составляющих их элементов.
Известно, что у металлов на внешнем энергетическом уровне (ВЭУ) имеется 1-3 валентных электрона. Поэтому они сравнительно легко отдают свои электроны неметаллам, у которых на ВЭУ 5-7 электронов. Так, металлы непосредственно реагируют с галогенами. Большинство Ме хорошо реагируют с кислородом (исключая золото, платину, серебро), образуя оксиды и пероксиды; взаимодействуют с серой с образованием сульфидов. Щелочные ищелочноземельные металлы легко реагируют с водой с образованием растворимых в ней щелочей. Металлы средней активности реагируют с водой только при нагревании. Малоактивные металлы с водой вообще не реагируют. Большинство металлов растворяется в кислотах. Однако химическая активность различных металлов различна. Она определяется легкостью атомов металла отдавать валентные электроны.
Квантовые числа электрона
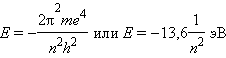 |
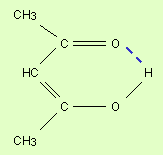
n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном.
В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д.
| Модель 2.2. Атом водорода. |
Орбитальное квантовое числоl характеризует форму орбиталей и принимает значения от 0 до n – 1. Кроме числовых l имеет буквенные обозначения
| l | = | … | |||||
| l | = | s | p | d | f | g | … |
Электроны с одинаковым значением l образуют подуровень.
Квантовое число l определяет квантование орбитального момента количества движения электрона 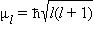
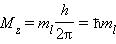 |
Все вышесказанное можно представить таблицей:
| |||||||||||||
| Таблица 2.1. Число орбиталей на энергетических подуровнях. |
Орбитали одного подуровня (l = const) имеют одинаковую энергию. Такое состояние называют вырожденным по энергии. Так p-орбиталь – трехкратно, d – пятикратно, а f – семикратно вырождены.
Граничные поверхности s-, p-, d-, f— орбиталей показаны на рис. 2.1.
Семь f-орбиталей, соответствующих l = 3 (n ≥ 4), изображаются в виде граничных поверхностей, приведенных на рис. 2.1.
Квантовые числа n, l и m l не полностью характеризуют состояние электрона в атоме. Экспериментально установленно, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое числоm s имеет только два значения m s = ±1/2, представляющие собой две проекции углового момента электрона на выделенную ось. Электроны с разными m sобозначаются стрелками, направленными вверх 
В многоэлектронных атомах, как и в атоме водорода, состояние электрона определяется значениями тех же четырех квантовых чисел, однако в этом случае электрон находится не только в поле ядра, но и в поле других электронов. Поэтому энергия в многоэлектронных атомах определяется не только главным, но и орбитальным квантовым числом, а вернее их суммой: энергия атомных орбиталей возрастает по мере увеличения суммы n + l; при одинаковой сумме сначала заполняется уровень с меньшим n и большим l. Энергия атомных орбиталей возрастает согласно ряду
В периодах электроотрицательность растет, а в группах уменьшается с ростом Z, то есть растет от Cs к F по диагонали периодической системы. Это обстоятельство до некоторой степени определяет диагональное сходство элементов.
В главных и побочных подгруппах свойства элементов меняются немонотонно, что обусловлено так называемой вторичной периодичностью, связанной с влиянием d— и f-электронных слоев.
Из анализа периодичности геометрических и энергетических параметров атомов следует, что периодическим законом можно пользоваться для определения физико-химических констант, предсказывать изменение радиусов, энергий ионизации и сродства к электрону, и, следовательно, кислотно-основные и окислительно-восстановительные свойства их соединений.
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 3.2).
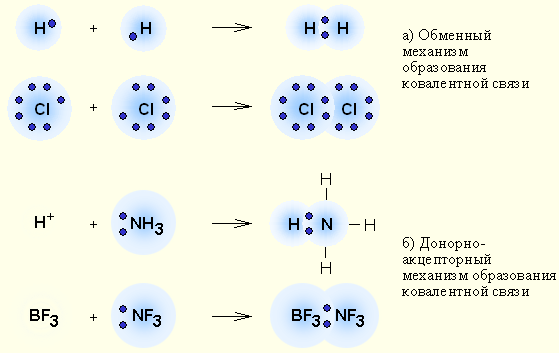 |
| Рисунок 3.2 Обменный (а) и донорно-акцепторный (б) механизмы образования ковалентной связи |
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
 |
| Модель 3.1. Виды химической связи |
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3.4).
|
|
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
КОВАЛЕНТНАЯ СВЯЗЬ
Осуществляется за счет электронной пары, принадлежащей обоим атомам. Различают обменный и донорно-акцепторный механизм образования ковалентной связи.
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
| H • + • H ® H : H |  | ® | 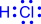 |
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь;
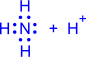 | ® | 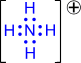 |
Два атома могут обобществлять неcколько пар электронов. В этом случае говорят о кратных связях:
 | ® | 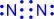 | (или NºN) – тройная связь |
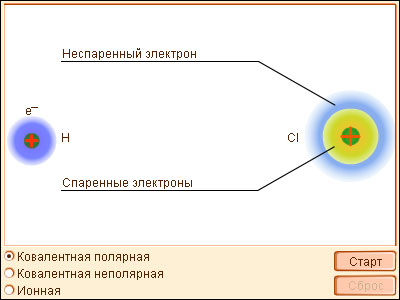
Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной.
Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной.
Полярность связи тем больше, чем больше разность электроотрицательностей атомов.
Усиление металлических и неметаллических свойств в таблице
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.