Что такое нежелательное явление
Что такое нежелательное явление
Общие терминологические критерии нежелательных явлений NCI (версия 3.0) — это описательная терминология, которую можно использовать при регистрации нежелательных явлений (НЯ). Для каждого НЯ предусмотрены степени тяжести.
Нежелательное явление (НЯ) — это любой неблагоприятный и непредусмотренный симптом (включая выходящий за рамки нормы результат лабораторного анализа) или заболевание, которые как связаны, так и не связаны с медикаментозным лечением или процедурой и возникают в период их применения.
Нежелательное явление (НЯ) — термин, который в медицинской документации и научных протоколах отражает четкое описание специфического явления. Каждое НЯ вносится в соответствии с MedDRA и кодом и располагается в алфавитном порядке по категориям.
Категория — широкая группа нежелательных явлений (НЯ), выделенная на основании анатомических и/или патофизиологических данных. Внутри каждой категории эти явления перечисляются по тяжести (степени).
Степень обозначает тяжесть нежелательных явлений (НЯ). На основании рекомендаций, представленных ниже, в общих терминологических критериях нежелательных явлений (версия 3.0) для каждого НЯ выделяют пять степеней тяжести с описанием специфических клинических проявлений.
В последующих отдельных статьях на сайте будут рассмотрены группы нежелательных явлений.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Нежелательные явления
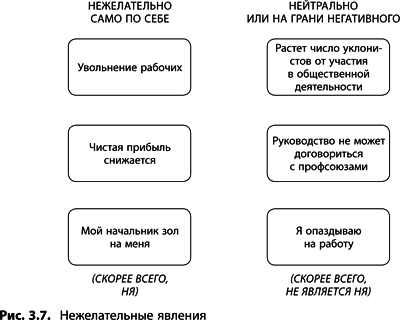
Один из первых блоков, которые понадобятся при построении дерева текущей реальности, – нежелательное явление (НЯ). Что это такое? В сущности, это первый показатель – в системе что-то неладно. Нежелательное явление – это событие, действительно существующее и являющееся негативным само по себе (рис. 3.7). Вам может быть известно о ряде нежелательных явлений (в сложных системах их, как правило, несколько) или же только об одном – дерево можно начинать строить и с одного.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
Читайте также
Ураганы, тайфуны и прочие природные явления, опасные для жизни
Ураганы, тайфуны и прочие природные явления, опасные для жизни Вам постоянно говорят, что их стало больше и они стали «разрушительнее».Ураганы и тайфуны действительно связаны с климатом. Правда это связано не с потеплением, а с разницей температур между зонами, но тут
НЕЖЕЛАТЕЛЬНЫЕ ДЕЙСТВИЯ
НЕЖЕЛАТЕЛЬНЫЕ ДЕЙСТВИЯ Наиболее часто (в порядке убывания) упоминалась нежелательность следующих действий:• не сводите все к заполнению бесконечных анкет;• не старайтесь все усложнять;• не бросайтесь очертя голову в новую систему;• не недооценивайте количество
Нежелательные любители легкой наживы в неурочное время
Нежелательные любители легкой наживы в неурочное время Без денег инновации невозможны. Проекты, которым не хватает ресурсов, страдают, потому что у них нет времени, людей и материалов, необходимых, чтобы собирать разнообразные идеи, испытывать их в новых комбинациях,
Нежелательные явления и ключевая проблема
Нежелательные явления и ключевая проблема Почти все, что нам не нравится в системе, является не проблемой, а сигналом о ее существовании. Сама проблема кроется в неких первопричинах конфликтов, существующих в нашей системе. Работа с нежелательными проявлениями подобна
Управление T через нежелательные явления
Управление T через нежелательные явления Голдратт полагает, что, пока не существует универсальной неденежной меры ценности, нет смысла измерять в деньгах T и пассивные I в некоммерческих организациях. Поэтому, говорит Голдратт, не стоит тратить время на такие попытки.
Нежелательные для кого?
Нежелательные для кого? Нежелательность события – понятие в некотором роде субъективное. То, что нежелательно для одного, может быть безразлично или даже желательно для другого.Примечание: событие, откровенно желательное для одних, но нежелательное для других, – это
Ключевые проблемы и крайне нежелательные явления
Ключевые проблемы и крайне нежелательные явления Как быть, если вы прошли всю процедуру, нашли ключевую проблему, но она никак не связана с нежелательным явлением, которое очень вас беспокоит? НЯ не равнозначны по важности: одни менее нежелательны, другие крайне
Глава 14. Когда два явления – это не одно и то же
Глава 14. Когда два явления – это не одно и то же «Зеленый лес», а также «синий». – Где мы ищем стрелу открытия. – Ирак в центре Пакистана. – Прометей никогда не оглядывался Я пишу эти строки в месте, очень подходящем для размышлений о стреле открытия: в Абу-Даби, городе,
Нежелательные явления
Регистрация нежелательных явлений является важнейшей составляющей изучения безопасности в рамках клинических исследований. В частности, в контролируемых исследованиях для изучения безопасности экспериментального препарата сравнивают частоту возникновения конкретных нежелательных явлений между группами экспериментального препарата и группами контроля (активного контроля либо плацебо). Достоверно более высокая частота НЯ в группе экспериментального препарата позволяет судить о причинно-следственной взаимосвязи конкретного НЯ c исследуемым воздействием.
Нежелательные явления классифицируют по оценке степени причинно-следственной связи с изучаемым воздействием (в частности: не связанные, возможно связанные, вероятно связанные и т. п.), серьезности (существуют строгие критерии понятия серьезное нежелательное явление), системно-органным классам англ. treatment-emergent adverse event ) и т. д.
Примечания
Полезное
Смотреть что такое «Нежелательные явления» в других словарях:
ПегИнтрон — Действующее вещество ›› Пэгинтерферон альфа 2b (Peginterferon alfa 2b) Латинское название PegIntron АТХ: ›› L03AB Интерфероны Фармакологическая группа: Иммуномодуляторы Нозологическая классификация (МКБ 10) ›› B18.0 Хронический вирусный гепатит B … Словарь медицинских препаратов
Базиликсимаб — (Basiliximab) Моноклональное антитело Организм источник Chimeric/Человек Мишень CD25 Классификация … Википедия
Вифенд — Действующее вещество ›› Вориконазол* (Voriconazole*) Латинское название Vfend АТХ: ›› J02AC03 Вориконазол Фармакологическая группа: Противогрибковые средства Нозологическая классификация (МКБ 10) ›› A41 Другая септицемия ›› B37 Кандидоз ›› B37.7… … Словарь медицинских препаратов
Аранесп — Действующее вещество ›› Дарбэпоэтин альфа* (Darbepoetin alfa*) Латинское название Aranesp АТХ: ›› B03XA02 Дарбэпоэтин альфа Фармакологическая группа: Стимуляторы гемопоэза Нозологическая классификация (МКБ 10) ›› D63.0 Анемия при новообразованиях … Словарь медицинских препаратов
Кселода — Действующее вещество ›› Капецитабин* (Capecitabine*) Латинское название Xeloda АТХ: ›› L01BC06 Капецитабин Фармакологическая группа: Антиметаболиты Нозологическая классификация (МКБ 10) ›› C16 Злокачественное новообразование желудка ›› C18… … Словарь медицинских препаратов
Гливек — Действующее вещество ›› Иматиниб* (Imatinib*) Латинское название Glivec АТХ: ›› L01XX28 Иманитиб Фармакологическая группа: Противоопухолевые средства — ингибиторы протеинтирозинкиназы Нозологическая классификация (МКБ 10) ›› C26… … Словарь медицинских препаратов
Майфортик — Действующее вещество ›› Микофеноловая кислота* (Mycophenolic acid*) Латинское название Myfortic АТХ: ›› L04AA06 Микофеноловая кислота Фармакологическая группа: Иммунодепрессанты Нозологическая классификация (МКБ 10) ›› T86.1 Отмирание и… … Словарь медицинских препаратов
Пегасис — Действующее вещество ›› Пэгинтерферон альфа 2а (40 кДа)* (Peginterferon alfa 2a (40 KD)*) Латинское название Pegasys АТХ: ›› L03AB11 Пэгинтерферон альфа 2a Фармакологическая группа: Иммуномодуляторы Состав и форма выпуска Раствор для подкожного… … Словарь медицинских препаратов
Авастин — Действующее вещество ›› Бевацизумаб* (Bevacizumab*) Латинское название Avastin АТХ: ›› L01XC07 Бевацизумаб Фармакологическая группа: Противоопухолевые средства — моноклональные антитела Нозологическая классификация (МКБ 10) ›› C18… … Словарь медицинских препаратов
Келикс — Действующее вещество ›› Доксорубицин* (Doxorubicin*) Латинское название Caelyx АТХ: ›› L01DB01 Доксорубицин Фармакологическая группа: Противоопухолевые антибиотики Нозологическая классификация (МКБ 10) ›› C50 Злокачественные новообразования… … Словарь медицинских препаратов
Что такое нежелательное явление
Нежелательное явление, НЯ (Adverse Event, AE) – любое выявленное у пациента или субъекта клинического исследования после применения ЛС/ исследуемого продукта неблагоприятное с медицинской точки зрения событие, которое может и не иметь причинно-следственной связи с его применением.
Нежелательное явление может представлять собой любой неблагоприятный симптом (напр., отклонение лабораторного показателя от нормы) или заболевание, время возникновения которых не исключает причинно-следственной связи с применением ЛС, вне зависимости от наличия или отсутствия такой связи.
Источник: Руководство по организации системы мониторинга безопасности лекарственных средств (фармаконадзора) в компаниях производителях лекарственных средств или держателях регистрационных удостоверений. 05 октября 2009г.
Нежелательное явление; НЯ (adverse event; AE): Любое выявленное у пациента или субъекта клинического исследования после применения лекарственного продукта неблагоприятное с медицинской точки зрения событие, которое может и не иметь причинно-следственной связи сего применением.
Таким образом, нежелательное явление (НЯ) может представлять собой любой неблагоприятный симптом (включая отклонение лабораторного показателя от нормы), жалобу или заболевание, время возникновения которого не исключает причинно-следственной связи с применением лекарственного (исследуемого) продукта вне зависимости от наличия или отсутствия такой связи (см. руководство ICH «Оценка данных по клинической безопасности: терминология и стандарты экспресс-отчётности»).
Источник: Национальный стандарт Российской Федерации. Надлежащая клиническая практика Good Clinical Practice (GCP), ГОСТР 52379-2005.
Источник: Правила клинической практики в Российской Федерации (утв. приказом Министерства здравоохранения Российской Федерации от 19 июня 2003 г. N 266)
Проблема разграничения понятий «нежелательные явления» и «нежелательные реакции» в процессе проведения клинических исследований лекарственного препарата для медицинского применения
Дата публикации: 12.05.2017 2017-05-12
Статья просмотрена: 1617 раз
Библиографическое описание:
Гребенщикова, А. А. Проблема разграничения понятий «нежелательные явления» и «нежелательные реакции» в процессе проведения клинических исследований лекарственного препарата для медицинского применения / А. А. Гребенщикова. — Текст : непосредственный // Молодой ученый. — 2017. — № 17.1 (151.1). — С. 8-11. — URL: https://moluch.ru/archive/151/42921/ (дата обращения: 11.12.2021).
В данной статье рассматривается проблема применения терминов фармаконадзора на основе анализа судебной практики. В работе изучается механизм действий организации, осуществляющей организацию проведения клинического исследования лекарственного препарата для медицинского применения, в случае выявления у пациента «нежелательного явления» или «нежелательной реакции».
Ключевые слова: клинические исследования лекарственного препарат для медицинского применения, нежелательные явления, нежелательные реакции, фармаконадзор
Согласно ст. 18 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации» [1] право на охрану здоровья обеспечивается путём производства и реализации безопасных лекарственных препаратов (далее по тексту — ЛП). Безопасность включает в себя сравнительный анализ эффективности и риска причинения вреда здоровью, которая устанавливается в ходе проведения клинического исследования. Клиническое исследование лекарственного препарата для медицинского применения (далее по тексту — КИ) — неотъемлемый этап «жизненного цикла» любого ЛП. Стадия проведения КИ обладает определенным набором характеристик. Так, с одной стороны исследование использует принципы доказательной медицины, которые позволяют изучать диагностические, лечебные, профилактические, а также фармакологические свойства ЛП. С другой стороны, КИ обладают высоким риском, как для здоровья пациента, так и для фармацевтической компании (спонсора), поскольку именно на этой стадии впервые удаётся определить соотношения риска и пользы действующего вещества будущего ЛП. Наибольший риск заключается в выявлении ранее неизвестных побочных явлений, нежелательных явлений (adverse event; AE), нежелательных реакций (adverse drug reaction; ADR).
В соответствие с Федеральным законом «Об обращении лекарственных средств» (далее по тексту — 61-ФЗ) под нежелательной реакцией следует понимать непреднамеренную неблагоприятную реакцию организма, которая может быть связана с применением лекарственного препарата. [2] В соответствии с Приказом Росстандарта «Об утверждении национального стандарта» [3] (далее по тексту — ГОСТ) нежелательные реакции — это все негативные последствия, связанные с применением любой дозы лекарственного продукта. При этом, имеется причинно-следственная связь между приёмом ЛП и причинением вреда здоровью пациента. В свою очередь, понятие «нежелательные явления» законодательного закрепления не имеет и содержится только в ГОСТе, под которым понимают любое неблагоприятное у пациента, с медицинской точки зрения, выявленное событие, симптом или заболевание. При этом событие может и не иметь причинно-следственной связи с участием пациента в КИ. Поскольку в 61-ФЗ из-за неоднозначного определения и отсутствия полного закрепления, использующегося понятийного аппарата, в судебной практике возникают проблемы их толкования и разграничения.
Согласно материалам дела, [4] медицинский центр «Н», обратился в суд с заявлением к Территориальному органу Федеральной службы по надзору в сфере здравоохранения (далее по тексту — территориальный орган Росздравнадзора) о признании незаконным и отмене постановления о привлечении к административной ответственности по статье 19.7.8 КоАП РФ. Было установлено, что в медицинском центре территориальным органом Росздравнадзора проводилась плановая выездная проверка в целях осуществления государственного контроля качества и безопасности медицинской деятельности в части соблюдения прав граждан в сфере охраны здоровья. В ходе проведенной проверки было установлено, что медицинский центр «Н» в рамках реализации договора выполнял многоцентровое, открытое, с активным препаратом сравнения КИ III фазы по изучению безопасности и эффективности препарата для коррекции анемии у пациентов, начавших получать регулярный диализ. При проведении КИ исследователем были выявлены «серьезные нежелательные явления» у пациента. Информация о серьезной нежелательной реакции при применении ЛП Э. у пациента должна была быть передана в административный орган или внесена через автоматизированную систему Росздравнадзора «Фармаконадзор». Однако, в указанный период времени, сведения о серьезной нежелательной реакции обществом не передавались. Поэтому территориальным органом Росздравнадзора был составлен протокол об административном правонарушении.
Суд, рассмотрев материалы дела, несмотря на то, что оценил наступление неблагоприятных, с медицинской точки зрения, последствий у пациента как серьёзное нежелательное явление, отказал в удовлетворении заявленных требований и посчитал привлечение к административной ответственности по ст. 19.7.8 КоАП РФ правомерным. Таким образом, суд использовал понятия «нежелательное явление» и «нежелательная реакция» в качестве синонимов, однако указанные понятия не тождественны. В апелляционном рассмотрении [5] с участием специалиста было установлено, что возникшие неблагоприятные последствия выраженные в госпитализации по причине инфекционного заболевания и по причине генетического заболевания у пациента не были связаны с приёмом испытуемого ЛП. Таким образом, поскольку имели место два нежелательных явления, не связанных с испытуемым препаратом или иным ЛП, следовательно общество не обязано было сообщать о данном факте в территориальный орган Росздравнадзора.
Существуют разные механизмы взаимодействия между спонсором, организацией, осуществляющей организацию проведения КИ ЛП (CRO) и государственным органом (Росздравнадзором) при выявлении нежелательной реакции или нежелательного явления. Требования к процедуре предоставлении информации (экспресс-отчёты), регистрации и сообщениям о нежелательных явлениях устанавливается в протоколе КИ. В соответствие с Приказом Минздрава России «Об утверждении правил надлежащей клинической практики» [6] исследователь обязан сообщить спонсору информацию о любом виде нежелательной реакции у пациента, за исключением тех, которые в протоколе или в брошюре определены как не требующие немедленного сообщения. Таким образом, при возникновении наступления вреда здоровью пациента, участвующего в КИ, вся информация по данному факту подлежит сбору, обработке и в кратчайшие сроки передается спонсору. Информацию подготавливает врач (исследователь), который готовит подробный отчёт с собственным предварительным мнением о причинах возникновения, а также о наличие или отсутствие причинно-следственной связи между приемом испытуемого ЛП и наступившими последствиями. Указанный отчёт должен идентифицировать участников КИ по присвоенным им уникальным кодам. После получения указанного отчёта, спонсор обрабатывает поступившую информацию и даёт заключение в котором определяет указанное событие как нежелательное явление или нежелательная реакция.
Как верно было отмечено в информационно-аналитическом бюллетене Ассоциации по организации клинических исследований (АОКИ) «учитывая сложность дизайна современных клинических исследований, а также то, что рандомизационный список (система, позволяющая в слепых исследованиях раскодировать информацию о том, попал ли участник в группу, получающую исследуемый препарат, либо в контрольную группу) хранится у спонсора, сделать какие-либо выводы на основе информации о серьезных нежелательных явлениях, полученной от отдельно взятых врачей-исследователей, уполномоченный орган любой страны не в силах». [7]
Учитывая положения Приказа Минздравсоцразвития РФ «Об утверждении порядка осуществления мониторинга безопасности лекарственных препаратов для медицинского применения, регистрации побочных действий, серьезных нежелательных реакций, непредвиденных нежелательных реакций при применении лекарственных препаратов для медицинского применения» [8] сообщение о выявлении любого вида нежелательной реакции в ходе проведения КИ должно направляться в Росздравнадзор не позднее 15 календарных дней со дня, когда стала известна соответствующая информация.
В соответствие с ч. 3 ст. 64 ФЗ-61, положениями Приказа Росздравнадзора от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора», [9] организация, получившая разрешение на проведение КИ, направляет по установленному образцу извещение о нежелательной реакции. Извещение, содержащее информацию о угрожающих жизни серьёзных непредвиденных реакциях, летальном исходе на исследуемый ЛП, направляется в срок не более 7 календарных дней, в остальных случаях, сведение о серьёзных нежелательных реакциях сообщается в течение 15 календарных дней. В отношении нежелательных явлений никакого порядка предоставления информации в уполномоченный федеральный орган не установлено. Следовательно, требование о сообщении наступления вреда здоровью пациента, участвующего в КИ, применимо только в случае выявления любого вида «нежелательной реакции», а не явления. За непредоставление сведений о любом виде нежелательной реакции предусмотрена административная ответственность по статье 19.7.8 КоАП РФ, которая влечет за собой наложение административного штрафа для должностных лиц — от 10 до 15 тысяч рублей, для юридических лиц — от 30 до 70 тысяч рублей. [10]
Таким образом, рассматриваемое судебное решение наглядно отражает тенденцию в унификации терминов аппарата фармаконадзора, а также механизма взаимодействия между организацией, получившей разрешение на проведение КИ, CRO и территориальным органом Росздравнадзора. В отличие от «нежелательной реакции», при «нежелательном явлении» отсутствует причинно-следственная связь между приёмом испытуемого ЛП и наступившими неблагоприятными, с медицинской точки зрения, последствиями у пациента. При этом, в случае выявления нежелательного явления организация, осуществляющая организацию проведения КИ, не обязана сообщать о выявленном факте в территориальный орган Росздравнадзора, а следовательно отсутствует состав административного правонарушения по ст. 19.7.8 КоАП РФ.
С целью создания надлежащей и правильной практики применения необходимо внести изменения в ст. 4 Федерального закона «Об обращении лекарственных средств» и изложить в следующей редакции:
«49.1) нежелательное явление — нежелательная реакция организма, выявленная в ходе проведения клинического исследования лекарственного препарата для медицинского применения, которая не связана с приёмом испытуемого лекарственного препарата».