Что такое нонсенс мутации
Расшифрован механизм, сглаживающий последствия нонсенс-мутаций

Рис. 1. Предполагаемый механизм компенсации последствий нонсенс-мутации. Ген, содержащий преждевременный стоп-кодон (нонсенс-мутацию), транскрибируется. Получившаяся матричная РНК выходит из ядра в цитоплазму (нонсенс-мутация помечена красной звездочкой). Здесь эта мРНК разрезается на кусочки системой нонсенс-опосредованного распада РНК (NMD, Nonsense-mediated decay). Фрагменты разрушенной мРНК объединяются с белками, участвующими в NMD, например, с белком Upf3a. Комплекс из Upf3a и фрагмента РНК отправляется в ядро. Там он взаимодействует с белковым комплексом COMPASS. Фрагмент мРНК используется для распознавания генов с похожей последовательностью, то есть родственных гену, испорченному мутацией. Вся эта конструкция прикрепляется к родственному гену, после чего COMPASS осуществляет эпигенетическую модификацию (триметилирование лизина 4) гистона H3 в промоторной области гена. В результате экспрессия родственного гена усиливается, и в клетке синтезируются дополнительные молекулы белка, похожего на тот, что был испорчен мутацией. Это может привести к частичной или полной компенсации фенотипических последствий нонсенс-мутации. Рисунок из синопсиса М. Ф. Уилкинсона (Miles F. Wilkinson) к обсуждаемым статьям M. A. El-Brolosy et al. и Z. Ma et al. в Nature
Разные способы отключения генов могут приводить к разным фенотипическим эффектам. Иногда подавление экспрессии гена («нокдаун») ведет к серьезному изменению фенотипа, в то время как мутанты, у которых тот же самый ген «нокаутирован» преждевременным стоп-кодоном (нонсенс-мутацией), имеют нормальный фенотип. Пытаясь разгадать этот парадокс, два исследовательских коллектива из Германии и Китая частично расшифровали неизвестный ранее механизм, повышающий устойчивость организмов к нонсенс-мутациям. Оказалось, что синтез матричных РНК, содержащих преждевременный стоп-кодон, через несколько промежуточных этапов (первым из которых является нонсенс-опосредованный распад РНК) ведет к повышению экспрессии генов, родственных испорченному нонсенс-мутацией. В результате в клетке синтезируются дополнительные белки, похожие на тот, чей ген был испорчен, что и позволяет частично или полностью скомпенсировать последствия нонсенс-мутации.
В ходе эволюции живые существа выработали целый ряд механизмов для повышения устойчивости к различным помехам, в том числе — к постоянно возникающим случайным мутациям. К таким механизмам можно отнести регуляторные контуры с отрицательными обратными связями, белки-шапероны, помогающие мутантным белкам принять правильную трехмерную конфигурацию (см.: Когда вредных мутаций много, они не так вредны, «Элементы», 06.12.2005), дублирование функций белок-кодирующих и регуляторных последовательностей, что порождает кажущуюся «генетическую избыточность» (см.: Устойчивое развитие конечностей у мышей обеспечивается дублированием регуляторов, «Элементы», 06.02.2018).
Еще один механизм, помогающий сгладить последствия потенциально вредных мутаций, называют нонсенс-опосредованным распадом мРНК (NMD, nonsense-mediated decay). Если в каком-то гене в результате мутации возникает преждевременный стоп-кодон (такие мутации называют нонсенс-мутациями), то считанная с такого гена матричная РНК уничтожается: ее разрезают на кусочки белки системы NMD. Это позволяет избежать синтеза бессмысленных «усеченных» белков, потенциально вредных для клетки и организма.
Как выяснилось, у системы NMD есть хитроумная надстройка, помогающая дополнительно снизить вредоносность нонсенс-мутаций. Сразу двум исследовательским коллективам из Германии и Китая удалось в общих чертах расшифровать принцип работы этого механизма, о чем рассказывается в двух статьях, опубликованных в свежем номере журнала Nature.
Обе группы пытались понять причины странного явления, которое состоит в следующем. Иногда подавление экспрессии («нокдаун») какого-нибудь гена приводит к серьезному изменению фенотипа. Но если тот же самый ген «нокаутировать» путем внесения в него нонсенс-мутации, то фенотип получается нормальный. Такое удивительное расхождение между результатами генетического нокдауна и нокаута было показано для многих генов у классических модельных объектов: мыши, рыбки данио-рерио и растения резуховидки Таля.
Недавно выяснилось, что в ответ на нокаут (но не нокдаун!) некоторых генов происходит усиление экспрессии генов, родственных нокаутированному, то есть имеющих похожую нуклеотидную последовательность. Обычно это паралоги — потомки одного и того же предкового гена, некогда возникшие в результате генных дупликаций, поделившие между собой функции и успевшие накопить нуклеотидные различия. В результате в клетках синтезируются дополнительные молекулы белков, похожих по своей аминокислотной последовательности на тот белок, чей ген был испорчен мутацией. По-видимому, эти белки частично берут на себя его функцию, тем самым помогая сгладить негативные последствия нонсенс-мутации. Явление назвали «генетическим компенсаторным ответом» (genetic compensation response, GCR; см. A. Rossi et al., 2015. Genetic compensation induced by deleterious mutations but not gene knockdowns).
Но каким образом нонсенс-мутация в одном гене приводит к активации экспрессии других генов, родственных нокаутированному? До сих пор ответа на этот вопрос не было.
Оба исследовательских коллектива работали с рыбками данио-рерио, а один из них (M. A. El-Brolosy et al.) — также с культурами мышиных клеток. Чтобы найти связующие звенья между нокаутом гена и активацией экспрессии родственных генов, обе группы провели множество экспериментов с широким кругом генов и мутаций, вызывающих (или не вызывающих) генетический компенсаторный ответ (GCR). Результаты, полученные на многих разных генах (и рыбьих, и мышиных), оказались схожими.
Установив эти факты, исследователи стали экспериментировать с другими мутациями гена capn3a. Оказалось, что GCR наблюдается только в тех случаях, когда мутация приводит к появлению преждевременного стоп-кодона в любом экзоне, кроме последнего. Это наводит на мысль об участии механизма NMD, потому что нонсенс-опосредованный распад мРНК включается как раз при наличии преждевременного стоп-кодона в любом экзоне, кроме последнего. Механизм NMD срабатывает, когда рибосома, осуществляющая трансляцию мРНК, прекращает свою работу на стоп-кодоне, не дойдя до группы белков, которые в ходе сплайсинга прикрепляются к мРНК в местах сращивания экзонов.
Аналогичные результаты дали и эксперименты с другими генами, в том числе с геном nid1a, нокдаун которого ведет к уменьшению длины тела данио-рерио, а нонсенс-мутации дают нормальный фенотип благодаря GCR (потому что повышается экспрессия родственных генов nid1b и nid2a).
Гипотеза об участии системы NMD в генетическом компенсаторном ответе была подтверждена дальнейшими экспериментами. В частности, оказалось, что GCR сходит на нет, если подавить экспрессию некоторых генов, участвующих в NMD — в особенности гена upf3a. Результаты по еще одному вовлеченному в NMD гену, upf1, у двух исследовательских групп получились разные: то ли этот ген важен для GCR (M. A. El-Brolosy et al.), то ли не очень (Z. Ma et al.).
Так или иначе, upf3a, по-видимому, является одним из главных связующих звеньев между нонсенс-мутациями и компенсаторным повышением экспрессии родственных генов. Ранее уже было замечено, что при GCR в промоторных областях генов, экспрессия которых повышается в ответ на нонсенс-мутацию родственного гена, растет частота встречаемости эпигенетической метки, которая называется H3K4me3 (триметилирование лизина, занимающего четвертую позицию в гистоне Н3). Эти метки, собственно, и являются причиной усиленной экспрессии упомянутых генов. Новые эксперименты подтвердили эти факты. Кроме того, они показали, что для появления дополнительных меток H3K4me3 в промоторных областях «компенсирующих» генов (но не в других частях генома) необходима нормальная работа гена upf3a. Если этот ген отключить, то GCR не происходит, по-видимому, именно по той причине, что в промоторных областях «компенсирующих» генов не образуются метки H3K4me3.
Полученные результаты в целом согласуются со схемой, показанной на рисунке. Некоторые детали этой схемы уже можно считать доказанными, в то время как другие нуждаются в дополнительных подтверждениях. К числу надежно установленных фактов можно отнести участие в GCR нонсенс-опосредованного распада мРНК, белка Upf3a, белкового комплекса COMPASS и эпигенетических меток H3K4me3 в промоторных областях «компенсирующих» генов, а также взаимодействие Upf3a c COMPASS. Идея о том, что обрезки разрушенной мРНК прикрепляются к белку Upf3a и используются им для обнаружения генов с похожей последовательностью (подобно «гидовым» РНК в системе CRISPR) и для привлечения к этим генам комплекса COMPASS, на данный момент является красивой и правдоподобной, но не доказанной гипотезой.
Полученные результаты важны как в теоретическом, так и в практическом плане. С одной стороны, они показывают, насколько неполны до сих пор наши знания и о регуляции экспрессии генов, и о механизмах устойчивости к мутациям. Кроме того, они объясняют, почему разные способы отключения одних и тех же генов могут давать разные результаты на уровне фенотипа. Это важно учитывать при планировании молекулярно-генетических экспериментов. Например, если мы хотим нокаутировать ген, чтобы выяснить его функцию, то нужно позаботиться о том, чтобы не сработал нонсенс-опосредованный компенсаторный ответ. Ведь иначе можно принять важный ген за «функционально избыточный» только потому, что эволюция сумела создать компенсаторный механизм, позволяющий справляться с некоторыми (но не любыми) его поломками. Наконец, исследование заставляет по-новому взглянуть на эволюционную роль генных дупликаций, благодаря которым в геномах эукариот присутствует так много семейств родственных генов (паралогов). Даже если паралоги давно поделили между собой функции и в норме работают в разных тканях и на разных стадиях развития, они, как выясняется, при необходимости могут привлекаться для «затыкания дырок» в других молекулярных системах, поврежденных мутациями, тем самым повышая помехоустойчивость организма.
Источники:
1) Mohamed A. El-Brolosy, Zacharias Kontarakis, Andrea Rossi, Carsten Kuenne, Stefan Günther, Nana Fukuda, Khrievono Kikhi, Giulia L. M. Boezio, Carter M. Takacs, Shih-Lei Lai, Ryuichi Fukuda, Claudia Gerri, Antonio J. Giraldez & Didier Y. R. Stainier. Genetic compensation triggered by mutant mRNA degradation // Nature. Published: 03 April 2019. DOI: 10.1038/s41586-019-1064-z.
2) Zhipeng Ma, Peipei Zhu, Hui Shi, Liwei Guo, Qinghe Zhang, Yanan Chen, Shuming Chen, Zhe Zhang, Jinrong Peng & Jun Chen. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components // Nature. Published: 03 April 2019. DOI: 10.1038/s41586-019-1057-y.
Что такое нонсенс мутации
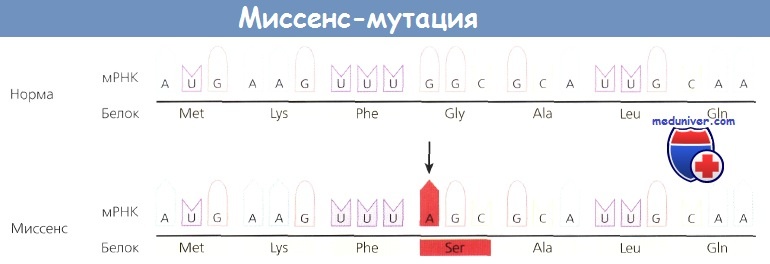
Замена единичного нуклеотида (или точковая мутация) в последовательности ДНК может изменять код в триплете и вызывать замену одной аминокислоты другой в продукте гена. Такие мутации называются миссенс-мутациями, поскольку они изменяют значение кодирующей последовательности гена, определяя другую аминокислоту.
При многих заболеваниях, например гемоглобинопатиях, наиболее часто обнаруживаемые мутации — миссенс-мутации.
Другие замены нуклеотидов, происходящие как в пределах, так и за пределами кодирующей последовательности гена, также могут влиять на продукт гена или создавать помехи непосредственно самому процессу транскрипции.
Множество мутаций в 5′-области промотора или 3′-нетранслируемой области гена b-глобина ведет к выраженному уменьшению количества готовой, зрелой мРНК b-глобина. На самом деле такие мутации позволили объяснить значение для экспрессии генов конкретных нуклеотидов в этих областях.
Мутации прекращающие синтез цепи
Точковые мутации последовательности ДНК, вызывающие замены нормального кодона аминокислоты на один из трех стоп-кодонов, называются нонсенс-мутациями. Поскольку при достижении стоп-кодона трансляция мРНК прекращается, мутации, преобразующие один из кодирующих кодонов экзона в стоп-кодон, прекращают на полпути трансляцию кодирующей последовательности мРНК.
Последствия мутаций преждевременного завершения трансляции двойственны. Во-первых, мРНК, несущая такую мутацию, часто неустойчива (нонсенс-распад мРНК), и трансляция оказывается невозможной. Даже если полученная мРНК достаточно стабильна для трансляции, усеченный белок обычно также неустойчив и быстро деградирует в пределах клетки.
Точковая мутация может не только создать кодон преждевременного завершения трансляции, но и уничтожить стоп-кодон, позволив продолжение трансляции до следующего стоп-кодона. Такая мутация создает белок с дополнительными аминокислотами на карбоксильном конце и может нарушать любые управляющие функции, предусматриваемые 3′-нетранслируемым участком, расположенным ниже нормального стоп-кодона.
Мутации процессинга РНК
Нормальный механизм преобразования первичной РНК в зрелую мРНК требует серии модификаций, включая полиаде-нилирование, закрытие 5′-конца и сплайсинг. Созревание РНК зависит от специфических последовательностей в пределах мРНК. При сплайсинге описаны два основных класса мутаций. Чтобы получить зрелую мРНК удалением интронов и сращиванием экзонов, необходимы конкретные нуклеотидные последовательности, располагающиеся непосредственно в или около соединений экзона и интрона (5′-донорский сайт) или интрона и экзона (3′-акцепторный сайт).
Мутации, повреждающие необходимые нуклеотиды в донорском и акцепторном сайте, нарушают (и в некоторых случаях прекращают) нормальный сплайсинг РНК в этом месте.
Второй класс мутаций сплайсинга включает замены оснований в интроне, не влияющие на донорский или акцепторный сайты. Данный класс мутаций создает альтернативный донорский или акцепторный сайт, конкурирующий с нормальными сайтами в ходе сплайсинга РНК. Таким образом, в этих случаях по крайней мере часть зрелой мРНК может иметь неправильно сращенные последовательности интрона.
Горячие точки мутаций
Нуклеотидные замены, включающие замену одного пуринового основания другим (А на G или наоборот) или одного пиримидинового на другое пиримидиновое (С на Т или Т на С), называются транзициями. Замена же пуринового основания на пиримидиновое (или наоборот) называется трансверсией. Если бы нуклеотидные замены были случайными, должно было быть в два раза больше трансверсий, чем транзиций, поскольку каждое основание может подвергаться двум трансверсиям и только одной транзиций. Разные мутагенные процессы преимущественно вызывают тот или другой тип замены.
Например, среди однонуклеотидных замен, вызывающих генетические болезни, преимущественно бывают транзиций. Это наблюдение, вероятно, может объясняться тем, что основная форма модификации ДНК в геноме человека представлена метилированием остатка цитозина (с формированием 5-метилцитозина), особенно когда он располагается рядом с гуанином (т.е. как динуклеотид 5′-CG-3′).
Спонтанное деаминирование 5-метилцитозина в тимидин в CG-динуклеотиде вызывает транзицию С > Т или G > А (в зависимости от нити ДНК, в которой видоизменяется 5-метилцитозин). Более 30% всех однонуклеотидных замен относятся к этому типу, они происходят в 25 раз чаще любой другой однонуклеотидной мутации. Таким образом, CG-динуклеотид представляет настоящую «горячую точку» для мутаций в геноме человека.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Как нонсенс-мутации ген обижали, и что потом было
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Мутации часто появляются совсем некстати и обижают гены живых организмов, ухудшая им жизнь. К счастью, организмы научились с ними справляться благодаря огромной помощи естественного отбора и некоторых молекулярных механизмов. Но что же произойдет, если ген обидит самая вредная и коварная из мелких мутаций — нонсенс-мутация? И сумеет ли ген найти способ, чтобы перехитрить ее?
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
В генах живых организмов постоянно происходят мутации. Чаще всего они связаны с ошибками, происходящими во время репликации, то есть удвоения ДНК, которое необходимо при делении клетки, и с ошибками при восстановлении повреждений ДНК, которые могут появиться по разнообразным причинам. Почти всегда они чинятся, но все же остаются случаи, когда вся молекулярная машинерия бессильна, и ошибка остается неисправленной. Тогда возникает мутация. Она может быть и в кодирующей, и в некодирующей частях генома, но давайте сосредоточим свое внимание только на первой, то есть на белок-кодирующих генах. Вдобавок, будем рассматривать только точечные мутации, которые заменяют лишь один нуклеотид.
Многие люди заведомо считают, что мутации всегда приносят только вред. На самом деле это верно, но не полностью. Есть «молчащие», или синонимичные мутации, которые не меняют кодируемую аминокислоту. Например, CGT, CGC, CGA, CGG кодируют аргинин и любая замена в третьей позиции кодона им не страшна. Такие мутации вреда не приносят. Другие мутации называются несинонимичными и меняют аминокислоту. Крайний, и как считается, самый вредный их вариант — нонсенс-мутация. О ней мы и будем говорить.
Но нужно начать с рассказа о самой сути нонсенс-мутаций. В начале транслируемой части каждого гена есть старт-кодон ATG (однако когда он расположен не в начале, то кодирует аминокислоту метионин), а в конце — стоп-кодон (один из трех: TAA, TAG или TGA), и для рибосомы они, словно дорожная разметка, обозначают откуда нужно начать синтезировать белок, а где — завершить. Поэтому синтез белка, трансляция, идет от старт-кодона до стоп-кодона. Но если из-за мутации любой кодон между настоящим стартом и стоп-кодоном превратится в стоп-кодон, то трансляция будет заканчиваться именно на этом, преждевременном стоп-кодоне. Так он и называется, «преждевременный стоп-кодон», или уже знакомым нам термином «нонсенс-мутация». По ее достижении трансляция обрывается и получается не хороший рабочий белок, а нефункциональный полипептид. Эффект от этого может и не проявиться в фенотипе, то есть не изменить никакой признак организма. Например, если организм по данному гену гетерозигота и одной функциональной копии гена для него достаточно. Но в некоторых случаях, в том числе если обе копии несут нонсенс-мутацию, или организм гаплоидный (второй копии гена у него попросту нет), или ген важный, то эффект виден невооруженным глазом.
В структуре белок-кодирующего гена можно выделить экзоны и интроны. Такое подразделение касается только ядерных организмов, а так как мы в статье говорим именно о них, то не станем обсуждать другие варианты строения гена. Информация о белке закодирована только в экзонах. Бывают гены, которые состоят всего из одного экзона, их меньшинство. А бывают гены, состоящие из нескольких десятков экзонов, которые при этом могут в разных сочетаниях давать разные белки — это называется «альтернативный сплайсинг». Например, если есть 5 экзонов [A, B, C, D, E], то они могут давать разные изоформы: и [A, B, C, D, E], и [A, B, C], и [B, C, E], и [A, C, D]. Таким образом достигается большое количество отличающихся по функциям белков, кодируемых одним геном.
Давно известно, что в геномах организмов присутствуют псевдогены — это участки, которые раньше были генами, но из-за мутации перестали таковыми быть и не кодируют функционирующий рабочий белок. Их еще называют мусорной ДНК [1]. Причиной может быть любая мутация — от однонуклеотидной, приводящей, например, к несинонимичной или нонсенс-мутации, до большой делеции, то есть удаления почти всего гена, или вставки в него транспозона, превращающего ген в псевдоген. В случае однонуклеотидной мутации или небольших делеции или инсерции можно посмотреть, как этот псевдоген появился и что с ним происходит. Нередко выяснялось, что после поломки ген начинал накапливать несинонимичные и синонимичные мутации с одинаковой скоростью. Это явление называется нейтральной эволюцией. Правда, по результатам было заметно, что в некоторых случаях из-за молодого возраста в псевдогене вообще не произошло никаких мутаций. А порой бывший ген просто не получалось найти, потому что он «старый» и сильно мутировал. Ученые описали нейтральную эволюцию для отдельных случаев, например, для семейств альфа- и бета-глобиновых генов [2], [3] или псевдогенов обонятельных рецепторов [4]. Но насколько наблюдаемое явление распространяется на все псевдогены, известно не было.
Ничто так не подстегивает ученых сделать обобщающее исследование, как противоречивость имеющейся информации. Разумеется, существует немало статей, в которых нонсенс-мутацию в гене ассоциировали с причиной развития заболевания [5], [6]. И стоит ожидать, что после такой поломки ген станет настоящим псевдогеном и начнет эволюционировать нейтрально. С другой стороны, есть статьи [7], в которых указывают на преимущество, получаемое организмом благодаря нонсенс-мутации. Выходит, здесь нонсенс-мутация благоприятна, и такой аллель не станет превращаться в псевдоген. А для некоторых генов вообще показали, что они — псевдо-псевдогены! [8] В них происходит редкое явление «чтение сквозь стоп-кодон», когда трансляция не обрывается, а продолжается дальше до настоящего стоп-кодона, и ген остается функциональным. Но это все же нечастое событие, и псевдогены в большинстве своем функций не несут.
Здесь мы, наконец, добрались до великой силы эволюции — естественного отбора. Он как раз и является силой, которая помогает генам не превратиться в бессмысленные бесполезные последовательности. Отбор очищает популяцию от вредных замен, в том числе и от интересных нам нонсенс-мутаций. Под столь возвышенной фразой имеется в виду лишь то, что особи с вредными мутациями либо не появляются на свет, потому что нежизнеспособны, либо не дают потомство. По очевидным причинам ген с «плохой» мутацией ну никак не может распространиться в популяции и удаляется из нее отбором.
В функционально важных генах естественный отбор поддерживает консервативность, потому как от их правильной работы зависит жизнь организма. И в них синонимичных мутаций накапливается намного больше, чем несинонимичных. В таких случаях говорят, что на ген действует отрицательный отбор, который как раз убирает несинонимичные замены. Повторю, многих генов с бóльшим числом несинонимичных мутаций мы не видим, потому как особи с ними не могут жить, либо не оставляют потомства. С другой стороны, есть меньшее число генов, в которых число несинонимичных замен больше числа синонимичных. Это указывает на работу положительного отбора, то есть наоборот хорошо, что ген сильно мутирует и аминокислоты в нем меняются. Например, так обстоит дело с генами главного комплекса гистосовместимости [9–11]. Третий вариант — равное соотношение синонимичных и несинонимичных замен. Это знак того, что отбору все равно, что происходит с геном, и он уже не ген вовсе, а псевдоген.
Зная о видах отбора и задумываясь о том, насколько противоречивы знания ученого мира о псевдогенах, мы решили установить порядок и понять, что же все-таки с ними происходит. И выбрали для этого модельный объект эволюционных биологов и генетиков — плодовую мушку Drosophila melanogaster. Поскольку она любимый объект биологов, о ней есть достаточно подходящей нам информации (что, на самом деле, даже в эпоху Больших данных иногда становится огромной проблемой и может заставить отложить исследование на некоторый срок). Поэтому решено было взять самый большой набор данных для одной замбийской популяции. Мы решили изучить случаи, когда стоп-кодон возникает из-за однонуклеотидной мутации. Скажем, был нормальный глутаминовый триплет CAA, а стал стоп-кодон TAA.
Чтобы узнать, что происходит с геном после появления нонсенс-мутации, мы решили посмотреть на силу естественного отбора в нем — на отношение несинонимичных замен к синонимичным, по-научному оно называется pN/pS. Здесь логика простая — если это значение будет равно 1, то мы наблюдаем искомую нейтральную эволюцию, и перед нами яркий пример псевдогенизации гена. А вот если оно будет ниже 1, то мы уже начинаем наблюдать отрицательный отбор, при котором несинонимичным мутациям не позволяется копиться с той же скоростью, что и синонимичным. А так как нас интересовало то, что происходит с геном после появления нонсенс-мутации, мы учитывали только те замены, которые появились именно после. Здесь слово «после» означает временные масштабы и указывает на то, что произошло с геном «потом». Это проще объяснить, глядя на рисунок ниже и объяснение в подписи к нему.
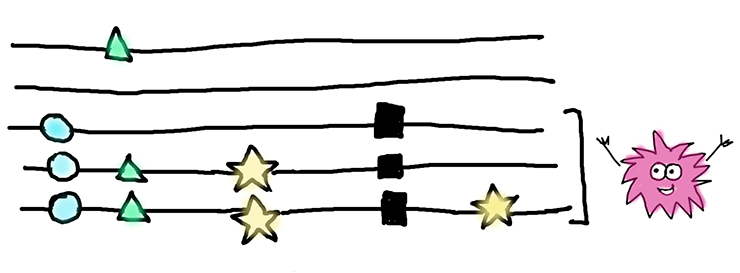
Перед нами — выравнивание для пяти последовательностей, или аллелей, одного гена. Черными квадратами отмечены нонсенс-мутации. Для нашей статистики интересны только замены, изображенные звездочками — именно они произошли после того, как в этих аллелях появилась нонсенс-мутация. Замены, изображенные кругами и треугольниками, скорее всего, произошли до нонсенс-мутации, и мы их в расчет не брали. Те, которые отмечены кругами встречаются во всех последовательностях, несущих нонсенс-мутацию, и, вероятнее всего, присутствовали в гене еще до нее. А мутации, обозначенные треугольниками, есть и у одной «здоровой» последовательности — они явно появились намного раньше нонсенса.
Казалось бы, у нас все есть — и данные, и статистика, которая поможет в подсчетах. Поэтому не терпится скорее приступить к анализу и получить ответ на терзающий душу ученого вопрос! И все же перед тем как брать все имеющиеся у нас нонсенс-аллели, то есть варианты гена с нонсенс-мутациями, и смотреть на замены внутри них, нужно эти аллели отфильтровать. Такой шаг может показаться странным, ведь нонсенс-аллелей и так мало (потому что они вредны и изымаются отрицательным отбором), куда еще фильтры использовать?! Но для того чтобы получить разумный результат, мы должны понимать, что работаем действительно с настоящими псевдогенами. Для генов, как мы уже обсудили, вообще-то нехорошо становиться псевдогенами. Поэтому все вредные мутации должны быть очень редкими в популяции, то есть, говоря научным языком, находиться на низкой частоте. А если мы видим потенциально вредную мутацию, но она присутствует у многих, то это говорит о том, что она безвредна, и организмам, у которых она есть, преспокойно живется. Иначе отрицательный отбор не позволил бы такой мутации добраться до высоких частот. Исходя из этого, в нашем исследовании мы брали во внимание только те нонсенс-мутации, которые встречались у небольшого количества мух, то есть были низкочастотными.
И, конечно, не нужно брать в расчет те нонсенс-мутации, которые расположены в самом начале и самом конце гена. Для расположенных в самом начале легко может оказаться так, что следующий за нонсенс-мутацией кодон будет метионином и сможет использоваться как альтернативный старт, а белок никакого вреда от этого не понесет. С расположением нонсенс-мутации в конце гена все еще проще — часто она находится в неважной для функции белка части и поэтому никакой роли не играет. Кстати, это не наше предположение: действительно, с большой частотой нонсенс-мутации предпочитают находиться в конце гена (это показывали во многих работах и на приматах, и на человеке, и мы — на плодовых мушках). Здесь внимательный читатель может возмутиться: «Что значит “предпочитают”? Они же не живые!». Все так, мы говорим «предпочитают», имея в виду, что нонсенс-мутаций там особенно много. Но это говорит лишь о том, что, находясь там, вреда они никакого не приносят, и поэтому не изымаются из популяции под действием отрицательного отбора.
И когда мы, наконец, отфильтровали ненужное и оставили только те гены, в которых нонсенс-мутация точно влияет на белок, то оказалось, что они действительно превратились в псевдогены и эволюционируют нейтрально [12]. Об этом нам рассказало соотношение pN/pS, которое равнялось 1, то есть несинонимичные замены накапливались с той же скоростью, что и синонимичные. Но ведь всегда хочется найти что-то интересное и неожиданное! И хоть у нас было совсем немного генов, мы решились и поделили их на две категории (к слову, больше мы выборку не подразделяли и глобальные выводы по двум–трем генам сделать не пытались). В первой категории были гены, которые состоят из одного экзона. Разумно, что если в них появился преждевременный стоп-кодон, то они должны сразу же превратиться в псевдоген. Так и оказалось. Чуть другой результат мы получили для генов из второй категории — для многоэкзонных генов. Мы заметили, что соотношение pN/pS в них меньше 1. Но в чем может быть причина? Во-первых, они длиннее одноэкзонных, а во-вторых, у них возможен альтернативный сплайсинг, с которым мы познакомились ранее. Поэтому некоторый экзон может присутствовать лишь в части изоформ. И, подсчитав pN/pS отдельно для экзона с нонсенс-мутацией и экзонов без нее, мы получили такой результат, о котором даже не мечтали!
Экзон, в котором появился преждевременный стоп-кодон, полностью ломался и начинал эволюционировать нейтрально. Его такая мутация «обижала», как и в случае одноэкзонного гена. А вот другие экзоны нонсенс-мутация, по-видимому, не затрагивала. Соотношение pN/pS в них было меньше 1, то есть мы наблюдаем воздействие на них отрицательного отбора, а вовсе не нейтральную эволюцию.
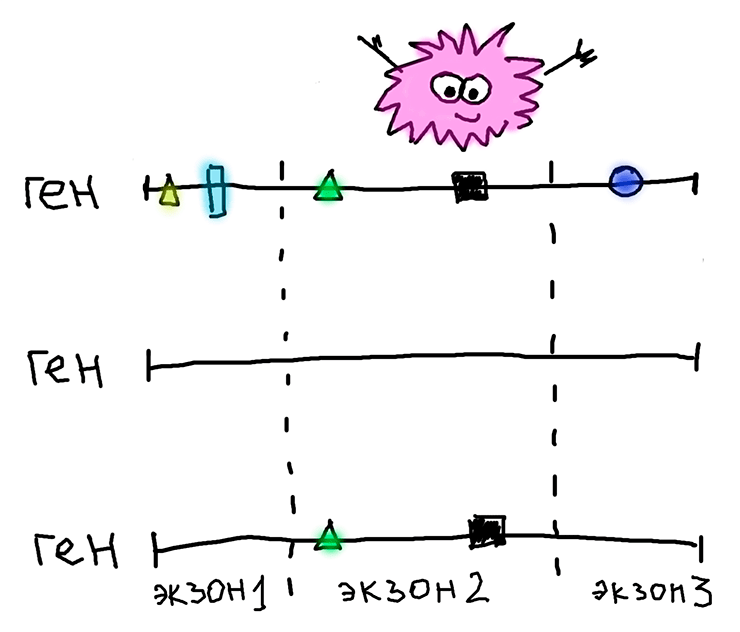
Вероятной причиной может быть рекомбинация, которая «разделяет» и «перемешивает» фрагменты генома. Поэтому даже если нонсенс-мутация «поразила» весь ген и другие экзоны тоже начали эволюционировать нейтрально, мы этого не увидим, потому что рекомбинация «принесла» эти самые другие экзоны из геномов мух без нонсенс-мутации. А у них они находятся под отрицательным отбором! Подробнее это изображено на рисунке ниже и разъяснено в подписи к нему.
Три варианта одного и того же многоэкзонного гена, принадлежащие трем разным мухам. Первый (вверху) — ген, в котором после появления нонсенс-мутации «сломались» все экзоны, он целиком стал псевдогеном и начал эволюционировать нейтрально (накопившиеся замены изображены геометрическими фигурами). Второй (посередине) — тот же ген, но без нонсенс-мутации, то есть кодирующий нормальный функциональный белок. Никаких замен в нем нет. Третий (нижний) — результат, который получился после рекомбинации между геномами первой и второй мух. Накопившиеся замены остались только в пораженном нонсенс-мутацией экзоне, а экзон 1 и экзон 3 были «принесены» от «здоровой» мухи (средний вариант на рисунке) без такой вредной мутации. Поэтому, из-за рекомбинации, мы и можем наблюдать отрицательный отбор, который на самом деле воздействовал на геном «здоровой» мухи, а у мухи с нонсенс-мутацией его и в помине нет.
Другая сила, которая может быть причастна к такому эффекту, — альтернативный сплайсинг, из-за которого у гена могут быть разные изоформы: и с экзоном с вредной нонсенс-мутацией, и без него. Получается, что другие, не имеющие «сломанного» экзона изоформы, могут спокойно функционировать, и с них получается нормальный работающий белок. И на такие варианты гена будет воздействовать отрицательный отбор.
Здесь внимательный читатель может поинтересоваться, откуда же возникают изоформы с экзонами, расположенными после нонсенс-мутации, если такая мутация, скорее всего, останавливает транскрипцию? Все дело кроется именно в ней. В геномах живых организмов транскрипция может проходить и с кодирующих, и с некодирующих участков ДНК. Она совсем неизбирательна, поэтому нельзя говорить о том, что она остановится именно на нонсенс-мутации. Исходя из этого, ученый мир считает, что такие мутации не влияют на транскрипцию, и полученная в результате пре-мРНК полноценна. Поэтому в результате сплайсинга могут появляться изоформы, включающие в себя экзоны, расположенные после экзона с нонсенс-мутацией.
Кстати, а когда мы взяли данные транскриптомов для плодовых мушек D. melanogaster, то стало видно, что изоформы, включающие в свой состав экзоны с нонсенс-мутациями, редко используются. Что видится логичным, ведь если бы эти вредные нонсенс-мутации были в часто используемых экзонах, то мы скорее всего такого организма не увидели — он просто не смог бы существовать. А в редко используемых вариантах гена нонсенс-мутации, видимо, не так губительны.
Сложно точно сказать, что же именно является причиной того, что мы видим отбор в других экзонах, — рекомбинация или сплайсинг, но результат однозначно интересный!
Таким образом, в своей статье [12] мы свели вместе разрозненные знания об эволюции генов, которые становятся псевдогенами из-за вредной и хитрой нонсенс-мутации. Она и вправду их обижает, но оказалось, что многоэкзонные гены ловко с ней справляются, исключая из использования пораженный экзон. В таких псевдогенах (и баловливых нонсенс-мутациях) скрыто еще немало интересного для изучения, и мы активно продолжаем их исследовать!