Что такое ноцицептивная боль
Что такое ноцицептивная боль
Боль определяется как неприятное сенсорное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения. В отличие от других сенсорных модальностей боль всегда субъективно неприятна и служит не столько источником информации об окружающем мире, сколько сигналом повреждения или болезни. Болевая чувствительность побуждает к прекращению контактов с повреждающими факторами среды.
Болевые рецепторы или ноцицепторы представляют собой свободные нервные окончания, расположенные в коже, слизистых оболочках, мышцах, суставах, надкостнице и во внутренних органах. Чувствительные окончания принадлежат либо безмякотным, либо тонким миелинизиро-ванным волокнам, что определяет скорость проведения сигналов в ЦНС и дает повод к различению ранней боли, короткой и острой, возникающей при проведении импульсов с большей скоростью по миелиновым волокнам, а также поздней, тупой и длительной боли, в случае проведения сигналов по безмякотным волокнам. Ноцицепторы относятся к полимодальным рецепторам, поскольку могут активироваться стимулами разной природы: механическими (удар, порез, укол, щипок), термическими (действие горячих или холодных предметов), химическими (изменение концентрации ионов водорода, действие гистамина, брадикинина и ряда других биологически активных веществ). Порог чувствительности ноцицепторов высок, поэтому лишь достаточно сильные стимулы вызывают возбуждение первичных сенсорных нейронов: например, порог болевой чувствительности для механических стимулов примерно в тысячу раз превышает порог тактильной чувствительности.
Центральные отростки первичных сенсорных нейронов входят в спинной мозг в составе задних корешков и образуют синапсы с нейронами второго порядка, расположенными в задних рогах спинного мозга. Аксоны нейронов второго порядка переходят на противоположную сторону спинного мозга, где образуют спиноталамический и спиноретикулярный тракты. Спиноталамический тракт оканчивается на нейронах нижнего заднелате-рального ядра таламуса, где происходит конвергенция проводящих путей болевой и тактильной чувствительности. Нейроны таламуса образуют проекцию на соматосенсорную кору: этот путь обеспечивает осознаваемое восприятие боли, позволяет определять интенсивность стимула и его локализацию.
Волокна спиноретикулярного тракта оканчиваются на нейронах ретикулярной формации, взаимодействующих с медиальными ядрами таламуса. При болевом раздражении нейроны медиальных ядер таламуса оказывают модулирующее влияние на обширные регионы коры и структуры лимбической системы, что приводит к повышению поведенческой активности человека и сопровождается эмоциональными и вегетативными реакциями. Если спиноталамический путь служит для определения сенсорных качеств боли, то спиноретикулярный путь предназначен играть роль сигнала общей тревоги, оказывать на человека общее возбуждающее действие.
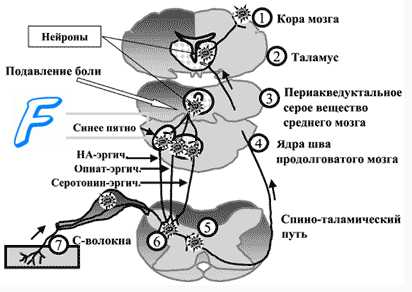
Субъективную оценку боли определяет соотношение нейронной активности обоих путей и зависимая от нее активация антиноцицептивных нисходящих путей, способных изменить характер проведения сигналов от ноцицепторов. В сенсорную систему болевой чувствительности встроен эндогенный механизм ее уменьшения путем регуляции порога синаптических переключений в задних рогах спинного мозга («ворота боли»). На передачу возбуждения в этих синапсах влияют нисходящие волокна нейронов серого вещества вокруг водопровода, голубого пятна и некоторых ядер срединного шва. Медиаторы этих нейронов (энкефалин, серотонин, норадреналин) тормозят активность нейронов второго порядка в задних рогах спинного мозга, чем уменьшают проведение афферентных сигналов от ноци-цепторов.
Аналгезирующим (обезболивающим) действием обладают опиатные пептиды (дайнорфин, эндорфины), синтезируемые нейронами гипоталамуса, которые имеют длинные отростки, проникающие в другие отделы головного мозга. Опиатные пептиды присоединяются к специфическим рецепторам нейронов лимбической системы и медиальной области таламуса, их образование увеличивается при некоторых эмоциональных состояниях, стрессе, продолжительных физических нагрузках, у беременных женщин незадолго перед родами, а также в результате психотерапевтического воздействия или акупунктуры. В результате повышенного образования опиатных пептидов активируются антиноцицептивные механизмы и повышается порог болевой чувствительности. Баланс между ощущением боли и ее субъективной оценкой устанавливается с помощью лобных областей мозга, участвующих в процессе восприятия болевых стимулов. При поражении лобных долей (например, в результате травмы или опухоли) порог болевой чувствительности не изменяется и поэтому сенсорный компонент болевого восприятия сохраняется неизменным, однако субъективная эмоциональная оценка боли становится иной: она начинает восприниматься лишь как сенсорное ощущение, а не как страдание.
Молекулярная биология боли
Они знают, что такое боль.
Автор
Редакторы
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Какая бывает боль?
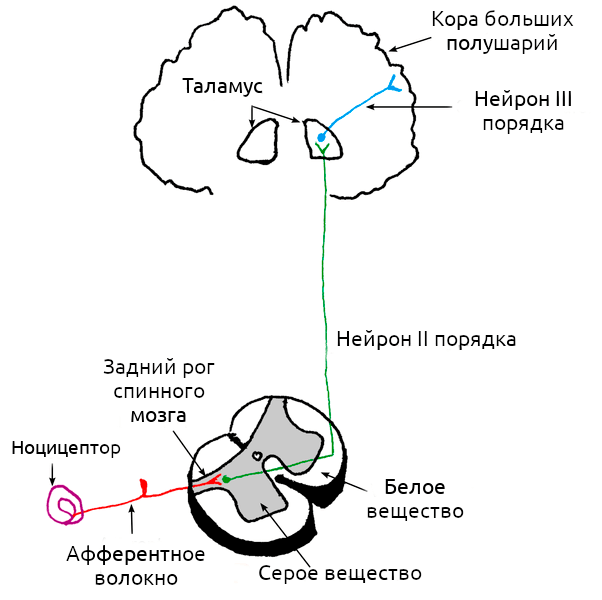
Ни для кого не секрет, что за ощущение боли отвечает нервная система. В общем виде работу этой системы можно представить так: рецепторы улавливают внешний сигнал и преобразуют его в нервный импульс (трансдукция), передают информацию по нерву (кондукция), а далее она обрабатывается в спинном мозге и «отсылается» в головной мозг (проекция) для генерации болезненных ощущений (восприятие) (рис. 1). Почти все помнят, что боль — это реакция на внешний раздражитель, но на самом деле это не всегда так: она может возникать и при поломке самой нервной системы.
Рисунок 1. Схема работы болевого импульса. В простейшем пути передачи сигнала участвуют три группы нейронов, чьи волокна обозначены на схеме разными цветами. За трансдукцию боли отвечает ноцицептор (обозначен на схеме фиолетовым), трансдукция происходит по нервным волокнам, обозначенным красным цветом, в спинном мозге происходит проекция боли на «зеленый» участок схемы, восприятие же боли начинается тогда, когда нейроны третьего порядка передадут нервный импульс от таламуса к коре больших полушарий.
Стоит отметить, что эволюционно боль появилась в качестве полезной адаптации, и на самом деле, до сих пор продолжает играть важную роль в нашей жизни. Задумайтесь, какой бы была жизнь без боли — мы не могли бы отдергивать руку, касаясь горячей поверхности, не замечали бы наносимых ран, а уж как осложнилась бы жизнь врачей, ставящих диагноз — сложно представить. Однако это не вся польза, которую приносит нам наша система восприятия боли. Рука об руку с ощущением боли идут ощущения давления, холода и тепла (то есть осязание) — и возможность организма в ответ на стимул из внешней среды изменить свои параметры. Существует ряд болезней (в основном генетически обусловленных), при которых восприятие боли нарушается. Их тяжесть варьирует в зависимости от того, какой именно рецептор или канал «поломан». Самые тяжелые формы (например, наследственная сенсорно-вегетативная невропатия IV типа) характеризуются полной потерей болевой чувствительности в конечностях и нарушением способности организма регулировать температуру тела. Но обо всем по порядку.
Классификация боли, предложенная Клиффордом Вульфом [1], включает в себя четыре типа: ноцицептивная, воспалительная, невропатическая и функциональная. Кроме того, стоит отметить и психогенную боль.
Поскольку мы решили остановиться на «нормальной» ноцицептивной боли, давайте разберемся поподробнее с каждым из этапов ее появления.
Эпизод I: Пойманная угроза
Чтобы определить любой сигнал, наш организм использует внушительный арсенал белков-рецепторов. Их задача заключается в том, что они реагируют на строго определенный внешний фактор и передают сигнал об этом связывании при помощи конформационных изменений [2], влекущих за собой и изменение биохимических свойств этого рецептора. Переданные от рецептора сигналы усиливаются каскадом белковых взаимодействий в клетке, могут передаваться с помощью нервной или эндокринной систем и, в конечном итоге, приводят к физиологическому ответу.
Нейроны, работающие в ноцицептивной системе, различаются по набору рецепторов. Среди этих нейронов выделяются четыре группы: несущие рецепторы температуры, химического воздействия, механического воздействия и полимодальные (с рецепторами всех раздражителей).
Одни из важнейших рецепторов, реагирующих на тепло, — белки группы TRP. Это ионные каналы, неспецифичные к катиону, — при открытии они пропускают в клетку натрий, магний и кальций, в результате чего в клетке возникает потенциал действия, необходимый для передачи нервного импульса. Этих доблестных воинов термочувствительности несколько: TRPV1–TRPV4 и TRPM8. Первые активируются при повышенной температуре, второй же реагирует на холод. Эти каналы обладают интересной особенностью — помимо температуры, они могут активироваться химическими стимулами.
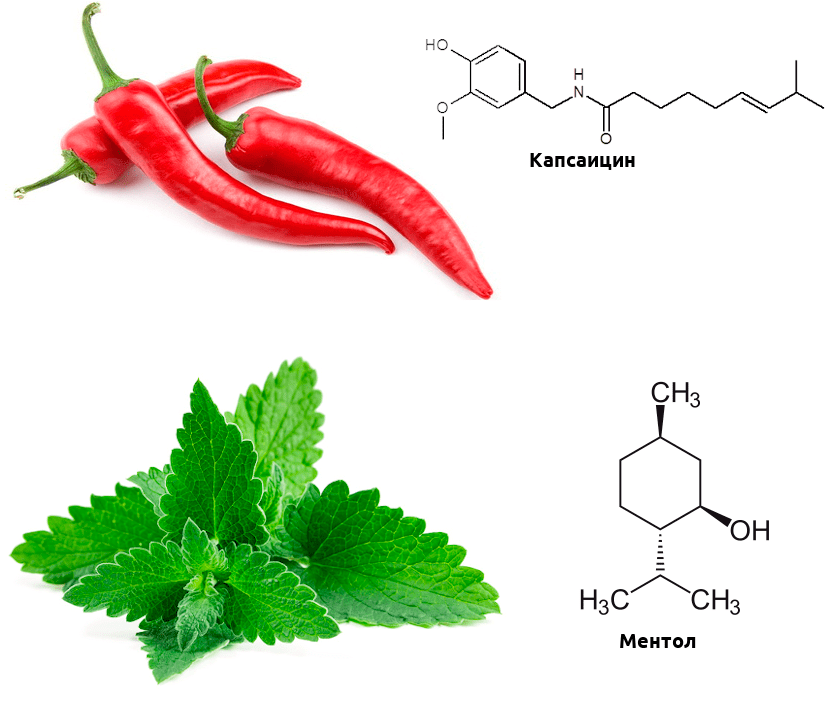
Биохимические механизмы этой активации отличаются от температурной, но в мозге возникают в ответ на эти химические стимулы практически те же ощущения, что и на изменение температуры. А теперь вспомните, какие продукты питания вызывают ощущение обжигания, а какие — холода? Думаю, почти каждый читатель сталкивался с этими продуктами. Острота перца чили обусловлена тем, что содержащийся в нем капсаицин активирует рецептор TRPV1 (такие вещества называются агонистами) [3]. А ментол, содержащийся в мяте, — агонист TRPM8, и вызывает чувство прохлады (рис. 2) [4].
Рисунок 2. Связывание рецепторами TRP капсаицина и ментола приводит к активации «температурной» ноцицепции. Интересно, что при определенных условиях капсаицин может не только вызывать боль, но и ослаблять ее — он десенсибилизирует (то есть делает менее чувствительными к стимулам) другие каналы семейства TRP, кроме того, провоцирует выброс эндорфинов, а вкупе с другими лекарственными средствами может оказаться. перспективным обезболивающим.
Но если можно с помощью небольших молекул заставить нас чувствовать эффект ноцицепции, то, может, с помощью других молекул можно этот рецептор заблокировать? Да! Разработка антагонистов TRPV1 [3], которые, блокируя рецептор, могут снижать болевые ощущения, например, от капсаицина, ведется с 1990-х годов, однако большинство препаратов пока не достигли рынка (рис. 3). Интересно, что эти препараты предлагается применять для лечения невропатической боли, то есть той, когда рецепторы активируются без внешней причины. Достигнут ли фармкомпании успеха — покажет время.
Рисунок 3. Один из первых разработанных антагонистов TPRV1 — капсазепин. Этот препарат находится сейчас на стадии клинических испытаний. Вообще, успех подобного рода лекарств может стать новой вехой в истории фармакологии анальгетиков — блокирование ноцицепторов вместо ослабления болевого импульса на более поздних стадиях.
Механоноцицепторы — куда более разнородная и многообразная группа рецепторов, чем терморецепторы. Среди них стоит отдельно выделить рецепторы, активируемые, помимо давления, сигнальным олигопептидом брадикинином. Его рецептор В-1 синтезируется в поврежденных клетках — например, при получении травмы. Связывая брадикинин, он активирует сигнальный каскад, приводящий к возникновению боли. Интересно, что в число прямых эффектов от связывания рецептора входит усиление воспаления — то есть поддержание стимула для дальнейшей активации болевых рецепторов: чем больше боли, тем больше боли. Поэтому частая активация В-1 (например, постоянным воспалением при аутоиммунных заболеваниях) может стать причиной развития хронической боли [5].
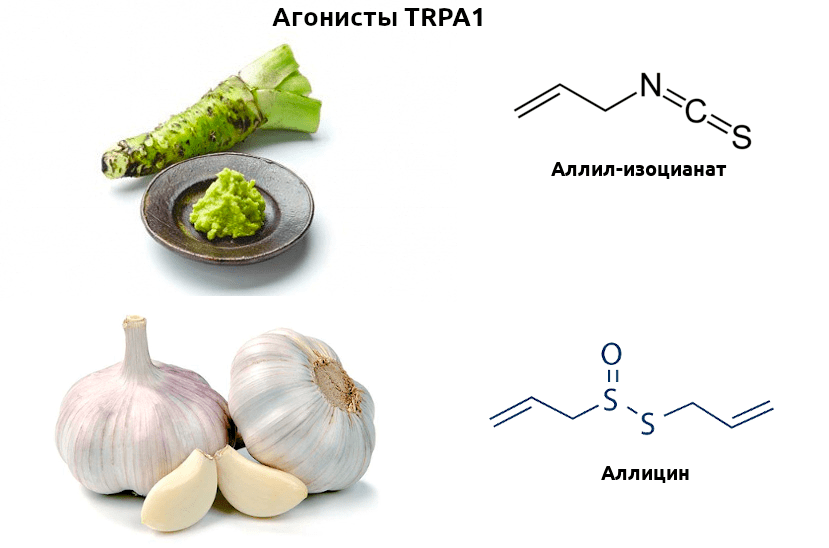
Рецепторы, воспринимающие различные химические раздражители (ирританты), тоже разнообразная, а местами малоизученная группа. Среди них особо примечателен член уже знакомого нам семейства TRP — TRPA1. Этот рецептор активируется совершенно разными молекулами, зачастую, вступая с ними в реакцию, что приводит к необратимости эффекта. В числе широко известных ирринантов, активирующих TRPA1, — аллилизоцианат, содержащийся в знаменитой японской приправе васаби, и аллицин, содержащийся в чесноке (рис. 4).
Рисунок 4. Вкус васаби сильно отличается от чесночного, однако за восприятие остроты этих приправ отвечает один рецептор — TRPA1. Серосодержащие летучие вещества этих растений способны активировать рецептор и дальнейшую ноцицептивную передачу. Эти агенты пригождаются ученым при изучении химических основ работы рецепторов.
Отдельно стоит упомянуть боль, возникающую при воспалении. Ключевое вещество, на которое реагируют ноцицепторы, — гистамин, который некоторые клетки нашей иммунной системы (например тучные) выбрасывают в кровь в ответ на стимулы к воспалению. Гистамин связывается со своими рецепторами (из семейства GPCR). Активация гистаминового рецептора 1 типа (H1) приводит к активации фосфолипазы С (PLC) и гидролизу фосфатидилинозитолбисфосфата (PIP2) с образованием инозитолтрифосфата (IP3), который затем запускает высвобождение Ca 2+ из эндоплазматической сети. Кальций, связавшись с кальмодулином, активирует протеинкиназу С, которая, при помощи дальнейшего фосфорилирования регуляторных киназ, подавляет экспрессию потенциал-зависимых калиевых каналов 7 типа (Kv1.7), что приводит к деполяризации мембраны и проведению болевого импульса [7]. Интересно, что гистаминовые рецепторы 3 типа, которые локализованы в ЦНС, могут ингибировать проведение определенных ноцицептивных импульсов [8].
Стоит отметить, что другие активные игроки воспалительного процесса — простагландины — действуют похоже: в результате связывания простагландина Е2 с рецептором PTGER2 активируется протеинкиназа А, которая, в свою очередь, увеличивает экспрессию уже знакомого нам TRPV1 [9].
Эпизод II: Атака нервных волокон | Кондукция
На примерах мы разобрались, как работают ноцицептивные рецепторы, но ведь они расположены «на переднем крае», близко к раздражителю, а приказ о болевых ощущениях отдается из мозга. Значит, необходимо донести сигнал до верховных инстанций. Для этого только что полученный потенциал действия рецептора активирует множество потенциал-управляемых ионных каналов. Натриевые и калиевые каналы необходимы для генерации потенциалов действия, которые передают ноцицепторные сигналы синапсам в дорсальном роге спинного мозга. Они — еще одна потенциальная терапевтическая мишень для новых групп анальгетиков. Кальциевые же каналы играют ключевую роль в высвобождении нейромедиаторов из центральных или периферических ноцицепторных синапсов, вызывая боль или воспаление соответственно.
В этом месте важно отметить, что нервные волокна, по которым ноцицепторный сигнал идет до спинного мозга, бывают трех типов — Aδ (а-дельта), Aβ (а-бета) и C. Эти волокна отличаются друг от друга по толщине, наличию или отсутствию «изолирующей» миелиновой оболочки и, как следствие, по скорости проведения нервного импульса и типу импульса, который по ним проводится.
Аδ-волокна проводят импульс быстро (10–30 м/с) и «специализируются» на сигналах о сильной механической боли и изменении температуры.
Aβ-волокна работают еще быстрее (30–100 м/с) и сильно миелинизированы. Механорецепторы, расположенные в этих волокнах, крайне чувствительны, поэтому функция этих волокон — проведение сигналов о слабых раздражителях. Избыточная активация волокон Aβ вызывает аллодинию — боль, возникающую от причин, обычно ее не вызывающих, — например, от сидения на стуле.
Волокна типа C проводят нервный импульс медленно (0,5–2 м/с); в основном это сигналы от высокочувствительных механорецепторов и хеморецепторов.
Волокна C и Aδ работают синергично, обеспечивая основную массу болевых ощущений.
Эпизод III: Месть эндорфинов
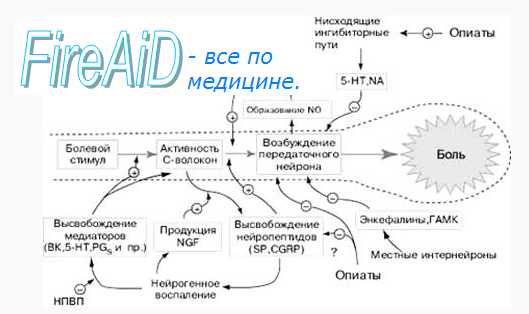
Сигнал о боли достиг нейронов задних рогов спинного мозга, и уже очень скоро будет жарко. Хотя постойте, может, можно что-нибудь сделать? Может, сигнал несет организму чрезмерные страдания, превышающие пользу? А может, наоборот, сигнал недостаточен для осознания всей беды? В спинном мозге происходит модуляция ноцицептивного сигнала. Это поле для нейрохимической битвы двух сил — тормозящей и усиливающей.
По своей природе опиоидные рецепторы тоже являются GPCR, однако — ингибиторными. Будучи активированными, они подавляют работу аденилатциклазы, снижают уровень внутриклеточного цАМФ и, через киназных посредников активируют работу калиевых каналов, которая приводит к реполяризации клеточной мембраны. В конечном итоге эти меры замедляют проведение нервного импульса.
Кроме описанной системы, в ослаблении боли принимают участие всем известные тормозные нейромедиаторы — гамма-аминомаслянная кислота (ГАМК) [11] и глицин [12]; а опосредованно — многие другие сигнальные молекулы.
Помимо «голубей», тормозящих проведение импульса, есть в спинном мозге и «ястребы», его усиливающие. Самый известный из них — глутамат [13]. В случае проведения ноцицептивного импульса, работа глутамата осуществляется через рецепторы NMDA и AMPA.
Глутамат действует хитро: связываясь с рецепторами АMPA, он вызывает в нейроне активацию уже знакомой нам протеинкиназы С, которая, в свою очередь, приводит к возрастанию уровня внутриклеточного кальция и поляризации мембраны. Помимо того, что это ускоряет проведение болевого импульса, это влияет на NMDA-рецепторы. В норме потенциал-зависимый канал закрыт магниевой «пробкой» и не открывается даже при связанном глутамате. Когда мембрана деполяризируется, магниевая пробка вылетает, и NMDA-рецептор запускает внутрь клетки катионы натрия и кальция, а наружу — калия, что способствует дальнейшей деполяризации мембраны. Самый известный антагонист NDMA-рецепторов — кетамин. Он нашел обширное применение в качестве операционного анестетика, но в последние годы из-за многочисленных нежелательных эффектов (в том числе наркотических), его применяют все реже. В ветеринарной же медицине кетамин, напротив, один из самых широко применяемых анестетиков.
То, в каком виде сигнал дойдет до головного мозга, определяется балансом между противоборствующими сторонами и силой изначального сигнала.
Часть IV: Новая проекция
В сером веществе спинного мозга различают 10 слоев (пластин Рекседа), каждый из которых отличается от других функционалом входящих в его состав нейронов, и, как следствие, — выполняемыми функциями. Чтобы нервный импульс попал на кору больших полушарий, сначала он должен пройти по восходящим путям этих пластин.
Синапс волокон Aδ и C со вторичными афферентными нейронами находится в дорсальном роге спинного мозга. Волокна Aδ и C передают информацию ноцицептивно-специфическим нейронам в I и II пластинах. Кроме того, импульс проецируется и на нейроны других пластин. Это нужно для того, чтобы впоследствии задействовать вторичные системы реакции мозга на боль (благодаря этому боль запоминается).
После того, как импульс проходит модуляцию в задних рогах, он передается нейронам восходящих трактов спинного мозга, каждый из которых имеет определенную функцию в распознавании боли.
Наиболее важны среди них спиноталамический тракт, участвующий в узнавании боли, спинопарабрахиальный тракт, участвующий в вегетативной и мотивационной регуляции реакции на боль, и спиномезенцефалический тракт, участвующий в активации нисходящих анальгетических путей, о действии которых мы говорили раньше.
Часть V: Головной мозг наносит ответный удар
Обработка информации о боли в головном мозге — самая разнообразная и индивидуальная для каждого человека часть работы ноцицепторной системы.
Сначала таламус и парабрахиальное ядро получают информацию от проекционных нейронов в различных пластинах, а затем передают эту сенсорную информацию в корковые и миндалевидные области, где информация расшифровывается как «болезненный стимул».
Стоит отметить, что у боли есть два разных компонента, за восприятие которых отвечают разные области мозга. Сенсорно-дискриминационные аспекты включают силу боли и ее локализацию, в то время как аффективно-эмоциональный компонент боли включает неприятный характер восприятия.
Для того чтобы мозг правильно локализовал источник боли, нервный импульс затем обрабатывается соматосенсорной корой.
Аффективно-мотивационный аспект боли опосредуется медиальным болевым путем, включающим внутриламинарные ядра таламуса, которые проецируются на соматосенсорные структуры коры и лимбической системы. Пластина V же передает ноцицептивные сообщения парабрахиальному внутреннему латеральному ядру. Нервные волокна этого ядра связаны с областями коры, отвечающими за когнитивные функции (например, поведенческую реакцию на боль) и агрессивное поведение [16].
Помимо «осознания боли» ответом часто является реакция «бей или беги», связанная с активацией норадреналинергических нейронов в голубом пятне. Кроме того, после «обработки» болевого сигнала соматосенсорной корой, информация о болевом сигнале передается в гиппокамп — чтобы затем отправиться в долговременную память.
На данный момент мы не можем с точностью сказать, какие молекулярные процессы, происходящие в мозге, отвечают за «субъективное восприятие» боли, поэтому вмешиваться с помощью лекарств на этом уровне восприятия боли никто не решается — слишком опасно.
Часть VI: Возвращение к наболевшему
С помощью одних и вопреки другим нейробиохимическим механизмам, болевой импульс дошел до мозга. На некоторое время организм ждут ощущения от неприятных до ужасающих. Сейчас кажется, что человечество овладело огромным количеством фармакологических методов для остановки боли — однако это лишь иллюзия, и как только противовоспалительные средства — ингибиторы циклооксигеназы — перестают снимать боль, врачам приходится применять «тяжелую артиллерию» опиоидных анальгетиков.
Как мы уже выяснили, сейчас выявлено очень много рецепторов, которые вовлечены в процесс передачи боли, но еще большее количество факторов пока ускользает от всевидящего взгляда ученых. Другой печальный факт заключается в том, что у многих из известных нам болевых рецепторов есть и другие физиологические функции, блокировка которых приведет к значительным побочным эффектам. Разработка антагонистов TRP, а также «опиоидов нового поколения», не вызывающих зависимость, может оказаться настоящим прорывом — но может и повлечь новые невзгоды. Сегодня нам ясно одно — в борьбе за повышение качества жизни боль рано или поздно должна быть взята под контроль, а для того чтобы оседлать этого страшного зверя, его нужно узнать.
Диагностика и лечение ноципластической скелетно-мышечной боли
Статья опубликована в журнале «Медицинский алфавит» № 27 / 2018, том № 3 Неврология и психиатрия
Резюме
Проблема боли, рационального обезболивания, профилактики хронизации болевого синдрома и лечения хронических болевых синдромов в последние годы подверглась активному переосмыслению в научной среде. Новейшие достижения в понимании мальадаптивных нейропластических, миопластических, хондропластических и остеопластических процессов, приводящих к формированию резистентных к противовоспалительной терапии хронических скелетно-мышечных болевых синдромов, привели к созданию термина «ноципластическая боль». Понимание преобладающих мальадаптивных механизмов хронизации боли у каждого конкретного пациента позволяет использовать комплексный персонифицированный подход к лечению, обосновывая экспертный выбор максимально безопасных и экономически целесообразных методов профилактики, лечения и реабилитации.
Ключевые слова: ноцицептивная боль, невропатическая боль, ноципластическая боль, скелетно-мышечная боль, эпидемиология боли, малоинвазивное лечение, локальная интервенционная терапия, реабилитация, Хондрорепарант Гиалрипайер.
Введение
Скелетно-мышечная боль резко снижает социальную и бытовую адаптацию пациентов. Снижение работоспособности, затраты на лечение, экономические потери делают проблему хронической скелетно-мышечной боли одной из лидирующих в рейтинге глобального бремени болезней. Так, например, боль в спине еще 27 лет назад находилась на 105-м месте, а в XXI веке вышла на лидирующую позицию среди причин утраты трудоспособности и экономических потерь (по таким показателям, как частота, распространенность и количество лет, прожитых с нарушенным здоровьем), обогнав 300 других нозологий по данным исследования, проведенного в 188 странах мира с 1990 по 2013 год [1]. Боль в поясничном отделе позвоночника возникает ежегодно у 36 % населения, регрессирует в 54–90 % случаев и рецидивирует вновь в течение года у 24–80 % пациентов [2]. Наиболее часто боль в спине возникает впервые в возрасте после 30 лет; распространенность этого недуга с возрастом экспоненциально возрастает, но после 65 лет снижается
Среди всех причин как острой, так и хронической боли в нижней части спины (БНЧС) скелетно-мышечная боль (СМБ), связанная с дисфункцией структур опорно-двигательного аппарата, встречается в 90 % случаев. При этом в 5 % случаев боль обусловлена радикулопатией, а еще в 5 % является симптомом опасного заболевания (травмы, остеопороза, неопластического процесса, инфекционного воспаления, аутоиммунного процесса и др.). Прогноз течения острой СМБ благоприятный. Считается, что боль может регрессировать самостоятельно без какого-либо лечения в течение 2–3 недель. Но даже при доброкачественном характере скелетно-мышечной боли в ряде случаев не происходит полного восстановления состояния и купирования болевого синдрома, и тогда уже следует говорить о самостоятельном заболевании — хроническом болевом расстройстве.
Установленными медицинскими факторами риска хронизации СМБ являются интенсивность и длительность боли, количество источников боли и их распространенность, тяжесть структурных повреждений, неоптимальное лечение, коморбидные заболевания (отягощающие соматический статус пациента), история злоупотребления психоактивными веществами, курение, ожирение и нарушения сна. К социодемографическим факторам хронизации относятся низкий уровень доходов и образования, отсутствие или неудовлетворенность работой, низкий уровень социальной поддержки и сниженная физическая активность. Психологическими факторами риска перехода острой боли в хроническую являются высокий уровень стресса, тревоги и депрессии, неадекватные стратегии преодоления боли (избегание) и катастрофизация, а также низкая самооценка [3].
В настоящее время наибольшее распространение получила биопсихосоциальная модель развития хронических болевых синдромов, согласно которой существует биологический источник ноцицептивной импульсации, при этом нарушаются механизмы ноцицепции и антиноцицепции, значительное влияние на процесс хронизации оказывают психическое состояние, социальное окружение и статус пациента. Источником периферической ноцицептивной импульсации может быть любая структура опорно-двигательной системы, содержащая ноцицепторы: мышцы, связки, надкостница, капсулы дугоотростчатых (фасеточных) суставов, крестцово-подвздошное сочленение (КПС), наружная треть фиброзного кольца межпозвонкового диска и др. [4, 5].
Новый взгляд на скелетно-мышечную боль
Классификацию СМБ проводят по ее длительности: если длительность боли не превышает 6 недель, она считается острой, при продолжительности боли от 6 до 12 недель — подострой, свыше 12 недель — хронической. Предполагается, что в основе острого болевого синдрома лежит микротравматизация структур опорно-двигательного аппарата. Частым фактором развития острой или обострения хронической боли является одномоментная чрезмерная нагрузка на фоне длительной статической нагрузки, особенно в нефизиологическом положении.
Сама по себе длительная статическая нагрузка способствует перегрузке и перерастяжению мышцы, связки или капсулы фасеточного сустава. В этом случае можно говорить об активации болевых рецепторов (ноцицепторов) в связи с повреждением ткани то есть о ноцицептивной боли. Средние сроки восстановления и купирования ноцицептивной боли в данном случае не превышают 2–3 недель. Однако у ряда пациентов длительность болевого синдрома выходит за сроки физиологического восстановления тканей, и в патологический процесс сенситизации начинают вовлекаться не только смежные анатомические регионы, но и отдаленные анатомические структуры. Для патогенетического обозначения этого процесса Международной ассоциацией по изучению боли (IASP) введен термин «ноципластическая боль» [6].
Согласно определению, ноципластическая боль возникает в связи с измененной ноцицепцией при отсутствии четких признаков существующего или возможного повреждения ткани, вызывающего активацию периферических ноцицепторов, а также признаков заболевания или повреждения соматосенсорной нервной системы, способных вызвать эту боль. Под измененной ноцицепцией подразумеваются ложноадаптивные (или мальадаптивные) пластические процессы в нервной (нейропластичность), мышечной (миопластичность), соединительнотканной (хондропластичность), костной (остеопластичность) и других системах. Вклад каждого из вышеперечисленных компонентов в формировании ноципластической боли вариабелен у разных пациентов, что обусловливает ответ на проводимую терапию.
Лечение ноципластической СМБ, направленное на мальадаптивный нейропластический компонент, может включать:
Для воздействия на мальадаптивные миопластические процессы при СМБ следует применять:
Базовой терапией мальадаптивных хондропластических процессов считается:
Наиболее сложной задачей является коррекция мальадаптивных остеопластических процессов ввиду их необратимости. Спектр лечебных воздействий в этом случае варьирует в следующем интервале:
Основой успешной персонифицированной терапии пациентов с ноципластической СМБ является адекватная диагностика с выявлением преобладающих механизмов хронизации боли. Основой диагностики как острой, так и хронической боли является клинический осмотр пациента с тщательным сбором анамнеза (для исключения симптомов опасности — «красных флажков»), оценкой неврологического и вертеброневрологического статусов. При отсутствии у пациента «красных флажков» не требуется дополнительная нейровизуализация.
Диагностика и лечение скелетно-мышечной боли
Диагностика первичной ноцицептивной и ноципластической СМБ — исключительно клиническая, какие-либо изменения в неврологическом статусе для нее нехарактерны (иначе боль будет отнесена к категории невропатической). Ярким примером ноципластической СМБ можно считать миофасциальный болевой синдром (МФБС). Для верификации наиболее вероятного ноцицептивного триггера рекомендуется проводить нейроортопедическое обследование пациента, при котором пальпаторно может определяться болезненность мышц, суставов и связочного аппарата, наличие триггерных зон (ТЗ) мышц, являющихся результатом мальадаптивной миопластичности. Критериями диагностики ТЗ являются выявление напряженного тяжа в структуре мышцы, локальная болезненность в пределах пальпируемого тяжа, воспроизводимость и узнаваемость боли при его пальпации. После пальпации производится оценка активных и пассивных движений в шейном, грудном и поясничнокрестцовом отделах позвоночника и конечностях. Оценка степени выраженности болевого синдрома проводится по визуальной аналоговой шкале (ВАШ) с использованием шкалы 10 см. Нейроортопедический статус также включает в себя оценку степени выраженности физиологических изгибов и выявление сколиотической деформации позвоночного столба, и в том числе оценку степени компенсации сколиоза при помощи вертикального отвеса и тест Адамса. Проводится исследование подвижности всех отделов позвоночника, крупных суставов, выявление ограничений при пассивных и активных движениях. Для исследования поясничного отдела применяются тест Шобера, проба Пьедаля для выявления функциональной блокады КПС, нагрузочные пробы на КПС, проба Патрика.
Эти пробы позволяют уточнить наличие и локализацию мальадаптивного хондропластического процесса в генезе ноципластической СМБ.
Для исключения специфических (вторичных) причин СМБ необходимо использовать общепринятую систему «красных флажков» [7]. Наличие симптомов опасности — признаков серьезной патологии — требует уже при первом обращении пациента проведения дополнительных методов инструментального обследования с целью исключения причин вторичной (специфической) боли в спине. Например, слабость в мышцах ног, снижение чувствительности в аногенитальной области по типу «седловидной анестезии», тазовые нарушения указывают на наличие компрессии корешков конского хвоста и требуют незамедлительного проведения МРТ или КТ для решения вопроса о необходимости срочного оперативного вмешательства.
«Красные флажки» — признаки серьезной патологии при боли в спине:
Во всех вышеперечисленных случаях при выявлении «красных флажков» проводится рентгенография соответствующих отделов позвоночника в прямой и боковой проекциях, скрининг анализов крови и мочи, а при подозрении на поражение спинного мозга и корешков — МРТ соответствующего отдела позвоночника. При необходимости уточнения состояния костных структур при подозрении на остеопороз необходима денситометрия, а при подозрении на метастатический характер поражения — радиоизотопная сцинтиграфия и онкопоиск.
Нейровизуализация не позволяет дифференцировать причины первичной ноципластической СМБ, поэтому применение рентгенографического обследования и (или) томографии малоинформативно для определения тактики лечения. Для верификации мальадаптивного миопластического компонента ноципластической боли в спине мы применяем УЗИ m.erector spinae, проводимое в В-режиме линейным датчиком с частотой 15 Мгц в поперечной и продольной плоскостях сканирования мышечных волокон с целью визуализации их структуры и эхогенности. Дополнительно используется режим энергетической допплерографии с наложением на В-режим для определения немой зоны отсутствия эхо-сигналов в зоне мышечного триггера при распространении колебаний от источника внешней вибрации.
Согласно современным клиническим рекомендациям [8, 9], лечение болевого синдрома включает купирование интенсивной боли, поддержание физической активности, лечебную гимнастику (кинезиотерапию). Основным средством купирования боли являются нестероидные противовоспалительные препараты (НПВП). Эффективность различных групп НПВП сравнительно одинаковая, акцент при назначении препаратов этой группы следует делать на наличие коморбидных заболеваний у пациента, оценивая риск осложнений со стороны желудочно-кишечного тракта и сердечно-сосудистой системы. Дополнительно для устранения мышечного напряжения, которое также считается источником ноцицептивной импульсации, используются миорелаксанты.
Приемы лечебной гимнастики могут быть использованы на каждом этапе лечения болевого синдрома. Ограничивать применение лечебной физкультуры (ЛФК) может только интенсивность болевого синдрома. Не рекомендуется включать в используемый комплекс упражнения, вызывающие боль. Эффективность данного метода доказана во многих контролируемых исследованиях, кинезиотерапия включена во все клинические рекомендации по лечению неспецифической боли в спине и имеет самый высокий уровень доказательности А [7, 8, 9]. Следует отметить, что существует несколько десятков вариаций лечебной гимнастики, однако достоверного преимущества какой-либо техники не показано. Вместе с тем вопрос о наиболее эффективном методе работы с пациентом, страдающим скелетно-мышечным болевым синдромом, остается открытым.
Каждая скелетная мышца имеет свое физиологическое предназначение: за долгое поддержание позы отвечают антигравитационные, статические мышцы (повышенное содержание волокон I типа делает их толерантными к физической нагрузке), а динамические мышцы отвечают за быстрое, силовое движение, например при подъеме тяжести (именно волокна II типа способны к такому сокращению). Следует отметить, что не существует мышцы со стопроцентным содержанием того или иного типа волокон.
Известно, что одним из самых эффективных немедикаментозных средств лечения и профилактики СМБ является ЛФК (кинезиотерапия). Ее эффективность доказана во многих исследованиях, однако конкретных рекомендаций по типу, темпу, структуре физической активности на данный момент нет; не выявлено и преимущества какого-то отдельного метода ЛФК перед другими.
Однако у пациентов, длительно страдающих хроническим болевым синдромом, из-за вовлечения центральных структур (центральной сенситизации), а также выбора неправильной стратегии преодоления боли формируется страх возникновения боли от любого движения — кинезиофобия. Предполагается, что для преодоления кинезиофобии необходимо как можно более раннее купирование болевого синдрома и патогенетически обоснованная методика лечебной гимнастики.
При лечении пациентов, страдающих ноципластической СМБ, эффективное обезболивание при помощи локальной инъекционной терапии приводит к увеличению физической активности и комплаенса в отношении кинезиотерапии, снижению количества потребляемых НПВП, а следовательно, способствует более быстрому восстановлению работоспособности и социализации.
Клинический случай 1
Пациентка К., 56 лет, обратилась с жалобами на боль в нижней части спины интенсивностью до 6–7 баллов ВАШ, усиливающуюся в вертикальном положении и при статической нагрузке (около 10 минут). Боль беспокоит пациентку в течение трех лет с периодическими обострениями (1–2 эпизода в месяц), средний уровень боли около 3 баллов, при обострении до 6–7 баллов. Настоящее обострение — в течение 10 дней, когда после длительного нахождения на неудобном стуле и резком наклоне боль усилилась до 6–7 баллов в покое и до 7–8 баллов при движении. Боль уменьшается при отдыхе лежа. При осмотре отмечает скованность в поясничном отделе позвоночника утром после сна, регрессирующую в течение 5–7 минут. По совету родственников прошла МРТ пояснично-крестцового отдела позвоночника, по данным которого выявлены дегенеративно-дистрофические изменения позвоночника, парамедианная грыжа диска LV–SI.
Назначена терапия Ацеклофенаком 100 мг по одной таблетке два раза в день, Толперизоном 150 мг два раза в день, даны рекомендации по сохранению привычной физической активности, ограничению провоцирующих боль нагрузок, комплекс ЛФК. Спустя 10 дней пациентка отмечает уменьшение выраженности болевого синдрома в покое до 5 баллов по ВАШ, при движении — до 5–6 баллов, однако комплекс лечебной гимнастики выполнять не может из-за боли. Учитывая выраженный болевой синдром, снижающий качество жизни, его хроническое течение, а также низкую эффективность амбулаторного лечения, пациентка была госпитализирована в Клинику нервных болезней Университетской клинической больницы № 3 Первого Московского государственного медицинского университета имени И.М. Сеченова.
Рисунок 1. Клинический случай 1. Пациентка К., 56 лет, с люмбалгией и остеоартрозом КПС. Разметка анатомических ориентиров и точек введения иглы: 1 — проекция остистых отростков LIII–LIV; 2 — проекция крестца; 3 — проекция крыла подвздошной кости; 4 — точка вкола иглы при блокаде фасеточного сустава LV–SI слева.
Больной предложено участие в научном исследовании, целью которого являтся диагностика и оптимизация лечения пациентов с МФБС. Учитывая отсутствие специфических изменений позвоночника по данным МРТ, для подтверждения диагноза и верификации ведущего патогенетического ноцицептивного триггера под рентгеновским контролем в левое КПС введено 2,0 мл 0,5% Прокаина. Пациентка отметила уменьшение интенсивности болевого синдрома на 50% в течение 30 минут после инъекции. Для дифференциации возможного плацебо-эффекта инвазивной процедуры выполнена повторная процедура: в левое КПС введено 2,0 мл 0,75% Ропивакаина. Боль уменьшилась на 50% в течение шести часов, на фоне чего больная стала успешнее справляться с комплексом ЛФК. Учитывая положительный эффект диагностических блокад с местным анестетиком, была проведена лечебная блокада левого КПС раствором ГКС пролонгированного действия (1,0 мл бетаметазона дипропионата и бетаметазона натрия фосфата) и 2,0 мл 0,5% Прокаина (рис. 1). На фоне терапии боль в нижней части спины уменьшилась до 3–4 баллов в покое и до 4 баллов по ВАШ при нагрузке.
Рисунок 2. Клинический случай 1. УЗ-навигация блокады фасеточного сустава. А — ультразвуковая визуализация манипуляции; Б — разметка ориентиров при УЗ-навигации: 1 — тень хода иглы; 2 — тень кончика иглы и проекция периартикулярной зоны фасеточного сустава; 3 — периартикулярное распределение препарата; 4 — дорсальная поверхность крестца; 5 — миофасциальный триггер.
При планировании дальнейших лечебных интервенций мы учитывали ранее проводимую терапию пролонгированным ГКС, поэтому с целью снижения потенциирования побочных эффектов предложили пациентке проведение блокады зоны фасеточного сустава препаратом Хондрорепарант® Гиалрипайер®-10 (рис. 1). Выбор препарата определяла клиническая картина болевого синдрома: интенсивность, признаки неспецифической воспалительной реакции фасеточного сустава на фоне дегенеративных изменений. Периартикулярное введение 2,0 мл 0,8% Хондрорепарант® Гиалрипайер®-10 произведено под УЗ-контролем (рис. 2).
Дополнительно с целью исследования состояния сократительных белков скелетной мышцы для оптимизации режима кинезиотерапии МФБС с учетом структурно-функциональных особенностей скелетной мышцы после подписания информированного согласия нами была выполнена биопсия миофасциального триггера, верифицированного с помощью УЗИ. При проведении ДСН-гель-электрофореза белков миниобразца скелетной мышцы пациентки было выявлено снижение содержания титина и небулина (от 20 до 40 %). Интерпретация полученных данных и оценка клинической значимости мальадаптивной миопластичности будут возможны после завершения набора когорты и статистической обработки материала проводимого нами исследования [10].
На фоне терапии больная отмечает уменьшение выраженности болевого синдрома, увеличение объема активных движений. Проводимые сеансы КПТ позволили ей преодолеть кинезиофобию, выросла приверженность к лечебной гимнастике, ушел страх относительно прогрессирования выявленных на МРТ изменений позвоночника и возможной инвалидизации. На контрольном осмотре через 10 дней после выписки пациентка отмечает регресс болевого синдрома в покое. При длительной статической физической нагрузке боль возникает лишь на уровне 1–2 баллов, пациентка ежедневно занимается кинезиотерапией.
Особенностью данного клинического случая является сочетание трех патогенетических мальадаптивных механизмов (нейропластического, миопластического и хондропластического) формирования хронической ноципластической СМБ, купирование которых было достигнуто при помощи междисциплинарного подхода. В основе плана лечения лежали кинезиотерапия, КПТ, рациональное обезболивание с использованием пероральных форм НПВП, локальная терапия ГКС пролонгированного действия, локальное введение Хондрорепарант® Гиалрипайер®-10, патогенетически обоснованного хондрорепаративного и нефармакологического противовоспалительного средства, позволяющего снизить кумулятивные риски ГКС.
Клинический случай 2
Рисунок 3. Клинический случай 2. Пациентка Т., 60 лет, с трохантеритом слева. А — разметка анатомических ориентиров и точек введения иглы: 1 — проекция крыла подвздошной кости; 2 — проекция седалищного бугра; 3 — большой вертел левой бедренной кости; Б — Выполнение блокады вертельной сумки под УЗ-контролем.
Пациентка Т., 60 лет, обратилась с жалобами на боль в нижней части спины интенсивностью до 5 баллов по ВАШ. Боль иррадиирует по заднебоковой поверхности левого бедра при физической нагрузке, отмечено усиление боли в положении лежа на левом боку, а также при физической нагрузке до 7 баллов. Боль беспокоит пациентку в течение четырех месяцев, возникновение боли не ассоциирует с каким-либо травмирующим фактором. Отмечает положительный эффект приема НПВП. Сопутствующие заболевания: артериальная гипертония I степени, среднего риска, достигнутая нормотензия; сахарный диабет второго типа, компенсированный (целевой уровень HbA1c 7,5%).
При оценке неврологического статуса не выявлено симптомов поражения центральной и периферической нервной системы. Симптом Ласега отрицательный. При оценке вертеброневрологического статуса: напряжение и болезненность при пальпации паравертебральных мышц, тест Шобера отрицательный, феномен опережения левого КПС в пробе Пьедаля, положительная проба Патрика, провоцирующая боль в области левого КПС, тест Бонне-Бобровниковой слабоположительный слева. Пальпация проекции большого вертела левой бедренной кости резко болезненна (рис. 3 А). Выполнена обзорная рентгенография костей таза и тазобедренных суставов, по данным которой выявлены признаки коксартроза I–II стадии с обеих сторон. На основании полученных данных сформулирован клинический диагноз «хроническая люмбоишиалгия скелетно-мышечного генеза на фоне дисфункции левого КПС, синдрома грушевидной мышцы слева, левостороннего трохантерита».
Назначена терапия Кетопрофеном 100 мг по одной таблетке два раза в день, даны рекомендации по сохранению привычной физической активности, ограничению нагрузок, провоцирующих боль, комплекс ЛФК. На повторном приеме спустя 10 дней пациентка отмечает уменьшение выраженности болевого синдрома в нижней части спины до 2 баллов, уверенно справляется с комплексом лечебной гимнастики, однако интенсивность боли при нагрузке осталась прежняя. При УЗИ левого тазобедренного сустава и периартикулярных тканей подтвержден трохантерит (бурсит вертельной сумки средней ягодичной мышцы). Таким образом, в генезе ноципластической СМБ у данной пациентки ведущими являются мальадаптивные миопластический и хондропластические механизмы.
Учитывая сохранение выраженно снижающей качество жизни боли при нагрузке и неэффективность приема НПВП более двух недель, под УЗ-контролем пациентке проведена лечебно-диагностическая блокада: 1,0 мл 0,4% Дексаметазона и 2,0 мл 0,5% Прокаина в область большого вертела бедренной кости (рис. 3 Б).
После проведения манипуляции проводилось суточное мониторирование АД в клинике. Спустя 30 минут после инъекции пациентка предъявила жалобы на умеренную головную боль, общую слабость. Отмечен подъем АД до уровня 175/90 мм рт. ст., купированный медикаментозно, увеличение гликемии до уровня 9 ммоль/л. Принимая во внимание факторы риска, после стабилизации состояния даны рекомендации по контролю уровня гликемии (четырехкратное измерение глюкозы капиллярной крови в течение дня) и артериального давления и их коррекции при необходимости.
Рисунок 4. Клинический случай 2. УЗ-навигация блокады вертельной сумки средней ягодичной мышцы. А — ультразвуковая визуализация манипуляции. Б — разметка ориентиров при УЗ-навигации: 1 — тень хода иглы; 2 — тень кончика иглы и проекция зоны энтезиса; 3 — распределение препарата в области энтезиса; 4 — надкостница бедренной кости; 5 — подвздошно-большеберцовый тракт.
При осмотре на следующий день пациентка отметила уменьшение выраженности болевого синдрома при ходьбе на 50%, однако колебания АД и уровня гликемии в течение дня исключили рассмотрение вопроса о продолжении терапии ГКС. При выборе препарата для продолжения локальных интервенций мы учли отсутствие влияние препаратов Хондрорепарант® Гиалрипайер® на уровень АД и гликемии, совместно с пациенткой принято решение о продолжении инъекционной терапии. Под УЗ-контролем в зону выявленных воспалительных изменений введены 2,0 мл 0,8% Хондрорепарант® Гиалрипайер®-10, переносимость процедуры хорошая (рис. 4 А, Б). Далее были продолжены кинезиотерапия и прием пероральных НПВП.
При следующем визите спустя семь дней пациентка сообщила о регрессе болевого синдрома в поясничном отделе позвоночника, уменьшении выраженности боли при ходьбе до 3–4 баллов. За этот период она самостоятельно отменила прием НПВП. При осмотре определяется локальная болезненность в проекции большого вертела бедренной кости слева, в связи с чем принято решение о продолжении локальной инъекционной терапии Хондрорепарант® Гиалрипайер®-10 в той же дозе под УЗ-контролем, переносимость блокады без особенностей. На очередном визите спустя семь дней пациентка отметила полный регресс боли, однако сохранялась легкая локальная болезненность при пальпации проекции большого вертела слева. При УЗИ в бурсе трохантера слева выявлено небольшое количество свободной жидкости. Для стимулирования репаративных процессов введено 2,0 мл 0,8% Хондрорепарант® Гиалрипайер®-02. При последующих визитах пациентка жалоб не предъявляла, боль при пальпации регрессировала, объем движений восстановился.
Заключение
В терапии хронической неспецифической боли в нижней части спины (ХНБНЧС) наиболее высоким уровнем доказательности обладают назначение НПВП, миорелаксантов, кинезиотерапия или ЛФК, когнитивно-поведенческая терапия (КПТ) [7, 8, 9]. Эти методы воздействия на мальадаптивный нейропластический и частично миопластический компоненты помогают купировать боль и восстановить утраченный объем движений большинству пациентов ввиду широкой распространенности в популяции этих механизмов ноципластической СМБ. Тем не менее до 40 % больных не получают облегчения симптомов при использовании вышеописанных методик из-за наличия более выраженных мальадаптивных миопластических, хондропластических или остеопластических компонентов СМБ. Работа с этой группой пациентов более сложна и требует большего объема интервенций для адекватного обезболивания с использованием не только местных анестетиков и ГКС, но и препаратов нового поколения.
Противовоспалительный и репаративный эффекты препаратов Хондрорепарант® Гиалрипайер® во флаконной форме для внесуставного введения позволяют применять их в локальной инъекционной терапии ноципластической СМБ с миопластическим и хондропластическим механизмами, обусловленной энтезопатиями, на фоне плохой переносимости ГКС, а также при недостаточном эффекте при применении ГКС. Хотя использование комбинированных инъекционных препаратов на основе солей гиалуроновой кислоты для внесуставного введения патогенетически обосновано при мальадаптивных миопластических и хондропластических процессах, а единичные клинические наблюдения подтверждают их эффективность, требуются дальнейшие рандомизированные клинические исследования для формирования доказательной базы [11].
Термин «ноципластическая боль» (nociplastic pain), предложенный в этом году Международной ассоциацией по изучению боли (IASP) требует дальнейшего уточнения [12]. Однако на современном этапе развития альгологии, нейрофизиологии и нейровизуализации становится очевидным, что старая патогенетическая классификация болевых синдромов на ноцицептивные, невропатические и психогенные не позволяет категоризировать всех пациентов с хронической болью. Наиболее близкий к ноципластической боли термин «дисфункциональная боль» может трактоваться более широко в контексте невропатической и психогенной боли. Соответственно и ноципластическая боль может иметь различные патогенетические механизмы возникновения измененной ноцицептивной импульсации, например, нейропластические, миопластические, хондропластические и остеопластические. Понимание преобладающего механизма развития ноципластической СМБ у каждого конкретного пациента позволяет экспертно подобрать персонифицированную терапию, направленную на устранение не только симптомов, но и первопричины заболевания.